- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
№ 4 Основні принципи класифікації мікробів. 8 страница
| № 68 Анафілактичний шок і сироватковахвороба. Прічіни виникнення. Механізм. Їх попередження. Анафілаксія представляет собою реакцію негайного типу, що виникає при парентеральному повторному введенні антигену у відповідь на шкідливу дію комплексу антиген - антитіло і характерізующуюся стереотипно протікає клінічної та морфологіческой картиною. Основну роль в анафілаксії грає цітотропний IgE, імеющій спорідненість до клітин, зокрема базофілам і огрядним клітинам. Після першого контакту організму з антигеном образуется IgE, який внаслідок цітотропності адсорбується на поверхні названих вище клітин. При повторному попаданні в організм цього ж антигену IgE пов'язує антиген з образованіем на мембрані клітин комплексу IgE - антиген. Комплекс пошкоджує клітини, які у відповідь на це виділяють медіатори - гістамін і гістаміноподібні речовини (серотонін, кинин). Ці медіатори зв'язуються рецепторами, наявними на поверхні функціональних м'язових, секреторних, слізістих та інших клітин, викликаючи їх відповідні реакції. Це веде до скорочення гладкої мускулатури бронхів, кишечнику-ника, сечового міхура, підвищення проникності судин та іншим функціональних і морфологічних змін, ко торие супроводжуються клінічним проявом. Клінічно анафілаксія проявляється у вигляді задишки, ядухи, слабкості, неспокою, судом, мимовільного сечовипускання, дефекаціі та ін. Анафілактична реакція протікає в три фази: в 1-й фазі відбувається сама реакція антиген - антитіло; у 2-й фазі виділяються медіатори анафілактичної реакції; в 3-й фазі проявляються функціональні зміни. Анафілактична реакція виникає через кілька мінут або годин після повторного введення антигену. Протікає у вигляді анафілактичного шоку або як місцеві прояви. Інтенсівность реакції залежить від дози антигену, кількості образующіхся антитіл, виду тварини і може закінчитися виздоровленіем або смертю. Анафілаксію легко можна викликати в експерименті на тварин. Оптимальною моделлю для воспроізведенія анафілаксії є морська свинка. Анафілаксія може виникати на введення будь-якого антигену будь-яким способом (підшкірно, через дихальні шляхи, травний тракт) за умови, що антиген викликає утворення іммуноглобулінов. Доза антигену, що викликає сенсибілізацію, т. Е. Повишенную чутливість, називається сенсибилизирующей. Вона зазвичай дуже мала, так як великі дози можуть викликати не сенсибілізацію, а розвиток імунного захисту. Доза антигену, введена вже сенсибілізованій до нього тварині і ви-викликають прояв анафілаксії, називається роздільною. Роздільна доза повинна бути значно більше, ніж сен-сібілізірующая. Стан сенсибілізації після зустрічі з антигеном сохраняется місяцями, іноді роками; інтенсивність сенсибілізації можна штучно зменшити введенням малих дозвільних доз антигену, які зв'язують і виводять з циркуляції в організмі частина антитіл. Цей принцип був використаний для десенсібілізаціі (гипосенсибилизации), тобто попередження анафілактіческого шоку при повторних введеннях антигену. Впервие спосіб десенсибілізації запропонував російський вчений А. Безредка (1907), тому він називається способом Безредки. Способ полягає в тому, що людині, раніше одержував якої-небудь антигенний препарат (вакцину, сироватку, антибіотики, препарати крові та ін. ), При повторному введенні (при наявності у нього підвищеної чутливості до препарату) спочатку вводят невелику дозу (0, 01; 0, 1 мл), а потім, через 1-1 '/ 2 ч, - основну. Таким прийомом користуються у всіх клініках для ізбежанія розвитку анафілактичного шоку; цей прийом является обов'язковим. Можливий пасивний перенос анафілаксії з антитілами. Сироваткової хворобою називають реакцію, що виникає при разовому парентеральному введенні великих доз сироваткових та інших білкових препаратів. Зазвичай реакція виникає через 10-15 діб. Механізм сироваткової хвороби пов'язаний з образованіем антитіл проти введеного чужорідного білка (антигену) і шкідливою дією на клітини комплексів антиген - антитіло. Клінічно сироваткова хвороба проявляється набряком шкіри і слизових оболонок, підвищенням температури тіла, при-Пуханов суглобів, висипом і свербінням шкіри; спостерігаються ізмененія в крові (збільшення ШОЕ, лейкоцитоз та ін. ). Терміни проявленія і тяжкість сироваткової хвороби залежать від содержанія циркулюючих антитіл і дози препарату. Це пояснюється тим, що до 2-му тижні після введення білків сироватки вирабативаются антитіла до білків сироватки і утворюється комплекс антиген - антитіло. Профілактика сироваткової хвороби здійснюватись за способом Безредки. |
№ 70 Особливості противірусного, противобактериального, противогрибкового, протипухлинного, трансплантаційного імунітету. Противірусний імунітет. Основою противірусного імунітету є клітинний імунітет. Клітини-мішені, інфіцірованние вірусом, знищуються цитотоксичними лімфоцітамі, а також NK-клітинами і фагоцитами, взаімодействующімі з Fc-фрагментами антитіл, прикріплених до вірус-специфічних білків інфікованої клітини. Протівовірусние антитіла здатні нейтралізувати лише внеклеточно розташовані віруси, як і фактори неспеціфіческого імунітету - сироваткові противірусні інгібітори. Такі віруси, оточені і блоковані білками організма, поглинаються фагоцитами або виводяться із сечею, потом і ін. (Так званий «видільний імунітет»). Інтерферони підсилюють противірусну резистентність, индуцируя в клетках синтез ферментів, що пригнічують утворення нуклеїнових кислот і білків вірусів. Крім цього, інтерферони чинять імуномодулюючу дію, посилюють в клітинах експрессію антигенів головного комплексу гістосумісності (МНС). Противірусний захист слизових оболонок обумовлена секреторнимі IgA, які, взаємодіючи з вірусами, препятствуют їх адгезії на епітеліоцитах. Протибактеріальний імунітет спрямований як проти бактерій, так і проти їх токсинів (антитоксичний іммунітет). Бактерії і їх токсини нейтралізуються антібактеріальнимі і антитоксическими антитілами. Комплекси бактерія (антигени) -антитіла активують комплемент, компоненти которого приєднуються до Fc-фрагменту антитіла, а потім образуют мембраноатакующего комплекс, що руйнує зовнішню мембрану клітинної стінки грамнегативних бактерій. Пептидогликан клітинних стінок бактерій руйнується лизоцимом. Антитіла і комплемент (СзЬ) обволікають бактерії і «приклеюють» їх до Fc- і С3b-рецепторам фагоцитів, виполняя роль опсонінов разом з іншими білками, що підсилюють фагоцитоз (С-реактивним білком, фибриногеном, маннан-зв'язує лектином, сироватковим амілоїдом). Основним механізмом антибактеріального імунітету є фагоцитоз. Фагоцити направлено переміщуються до об'єкта фагоцитозу, реагуючи на хемоаттрактанти: речовини мікробів, активовані компоненти комплементу (С5а, С3а) і цитокіни. Противобактериальное захист слизових оболонок обумовлена секреторними IgA, які, взаємодіючи з бактеріями, перешкоджають їх адгезії на епітеліоцитах. Протигрибковий імунітет. Антитіла (IgM, IgG) при мікозах виявляються в низьких титрах. Основою противогрибкового імунітету є клітинний імунітет. У тканинах проісходіт фагоцитоз, розвивається епітеліоїдна гранулематозная реакція, іноді тромбоз кровоносних судин. Мікози, особливо опортуністичні, часто розвиваються після тривалої антібактеріальной терапії і при імунодефіцитах. Вони сопровождаются розвитком гіперчутливості сповільненого тіпа. Можливий розвиток алергічних захворювань після реcпіраторной сенсибілізації фрагментами умовно-патогенних грибів родів Aspergillus, Penicillium, Mucor, Fusarium та ін. Протипухлинний імунітет заснований на Th1-залежному клітинному імунній відповіді, активуючий цитотоксичні Т-лімфоцити, макрофаги і NK-клітини. Роль гуморального (антитільної) імунної відповіді невелика, оскільки антітела, з'єднуючись з антигенними детермінантами на пухлинних клітинах, екранують їх від цитопатогенного діях іммунних лімфоцитів. Пухлинний антиген розпізнається антигенпрезентуючими клітинами (дендритними клітинами і макрофагамі) і безпосередньо або через Т-хелпери (Th1) представляется цитотоксическим Т-лімфоцитам, що руйнують опу-холеву клітину-мішень. Крім специфічного протипухлинного імунітету, імунний нагляд за нормальним складом тканин реалізуется за рахунок неспецифічних факторів. Неспецифічні фактори, що ушкоджують пухлинні клітини: 1) NK-клітини, сістема мононуклеарних клітин, протипухлинна активність яких посилюється під впливом інтерлейкіну-2 (ІЛ-2) та α -, β -інтерферонів; 2) ЛАК-клітини (мононуклеарние клітини і NK-клітини, активовані ІЛ-2); 3) цитокіни (α - і β -інтерферони, ФНО- α та ІЛ-2). Трансплантаційним імунітетом називают імунну реакцію макроорганізму, спрямовану проти пересадженою в нього чужорідної тканини (трансплантата). Знання механізмів трансплантаційного іммунітета необхідно для вирішення однієї з важнейшіх проблем сучасної медицини - пересадкі органів і тканин. Багаторічний досвід показав, що успіх операції з пересадки чужорідних органів і тканин в переважній більшості випадків залежить від іммунологіческой сумісності тканин донора і реці-піента. Імунна реакція на чужорідні клітини і тканини обумовлена тим, що в їх составе містяться генетично чужорідні для організму антигени. Ці антигени, що отримали назву трансплантаційних або антигенів гістосумісності, найбільш повно представлені на ЦПМ клітин. Реакція відторгнення не виникає у разі повної сумісності донора і реципієнта за антигенами гістосумісності - таке можливо лише для однояйцевих близнюків. Виразність реакції відторгнення під многом залежить від ступеня чужорідність, обсягу трансплантованого матеріалу і стану імунореактивності реципієнта. При контакті з чужорідними трансплантаціоннимі антигенами організм реагує факторами клітинного та гуморального звеньев імунітету. Основним фактором клеточного трансплантаційного імунітету є Т-кілери. Ці клітини після сенсібілізаціі антигенами донора мігрують в тканини трансплантата і роблять на них антітелонезавісімую клітинно-опосередковану цитотоксичність. Специфічні антитіла, які образуются на чужорідні антигени (гемаглютиніни, гемолізини, лейкотоксини, цитотоксини), мають важливе значення в формірованіі трансплантаційного імунітету. Вони запускають антітелоопосредованний цитолиз трансплантата (комплемент-опосередкований і антитілозалежна клітинно-опосередкована цитотоксичність). Можливий адоптивний перенесення трансплантаціонного імунітету з допомогою актівірованних лімфоцитів або зі специфічною антисироваткою від сенсибілізованої особини інтактних макроорганізму. Механізм імунного відторгнення пересаженних клітин і тканин має дві фази. У першій фазі навколо трансплантата і судин спостерігається скупчення імунокомпетентних клітин (лимфоидная інфільтрація), у тому числі Т-кілерів. У другій фазі проісходіт деструкція клітин трансплантата Т-кілерами, активуються макрофагальну ланку, природні кілери, специфічний антителогенез. Виникає імунне воспаленіе, тромбоз кровоносних судин, нарушается харчування трансплантата і відбувається його загибель. Зруйновані тканини утилізуються фагоцитами. У процесі реакції відторгнення форміруется клон Т- і В-клітин імунної пам'яті. Повторна спроба пересадки тих же органів і тканин викликає вторинний імунний ответ, який протікає дуже бурхливо і швидко закінчується відторгненням трансплантата. З клінічної точки зору виділяють острое, сверхострое і відстрочене відторгнення трансплантата. Розрізняються вони за часом реалізації реакції і окремим механізмам. |
№ 71 Поняття про клінічної імунології. Імунний статус людини і фактори, що впливають на нього. Клінічна імунологія - це клінічна та лабораторна дисципліна, що займається вивченням питань діагностики та лікування хворих з різними захворюваннями і патологічними станами, в основі яких лежать імунологічні механізми, а також станами, в терапії та профілактики яких імунопрепарати відіграють провідну роль. Імунний статус - це структурний і функціональний стан імунної сістеми індивідуума, яке визначається комплексом клінічних та лабораторних іммунологіческіх показників. Таким чином, імунний статус характерізует анатомо-функціональне состояніе імунної системи, т. Е. Її здатність до імунної відповіді на певний антіген в даний момент часу. На імунний статус впливають такі фактори: • клімато-географічні; • соціальні; • екологічні (фізичні, хімічні та біологічні); • «медичні» (вплив лікарських речовин, оперативні втручання, стрес і т. Д. ). Серед клімато-географічних чинників на імунний статус впливають температура, вологість, сонячна радіація, довжина світлового дня та ін. Наприклад, фагоцітарная реакція і шкірні алергічні проби менш виражені у жителів північних регіонов, ніж у жителів півдня. Вірус Епштейна-Барр у людей білої раси викликає інфекційне заболеваніе - мононуклеоз, в осіб негроїдної раси - онкопатологію (лімфома Беркітта), а в осіб жовтої раси - зовсім іншу онкопатологію (назофарингеального карцинома), причому тільки у чоловіків. Жителі Африки менш схильні до захворювання на дифтерію, ніж європейське населення. До соціальних чинників, який впливає на імунний статус, відносяться пітаніе, житлово-побутові умови, профес-сійної шкідливості і т. П. Важливе значеніе має збалансоване і раціональне харчування, оскільки з їжею в організм поступают речовини, необхідні для синтезу імуноглобулінів, для побудови іммунекомпетентних клітин та їх функціонірованія. Особливо важливо, щоб у раціоні були присутні незамінні амінокислоти і вітаміни, особливо А і С. Значний вплив на імунну статус організму надають житлово-побутові умови. Проживання в поганих житлових умов веде до зниження загальної фізіологіческой реактивності, відповідно иммунореактивности, що нерідко сопровождается підвищенням рівня інфекційної захворюваності. Великий вплив на імунний статус оказивают професійні шкідливості, поскольку людина проводить на роботі значітельную частину свого життя. До проізводственним факторам, які можуть шкідливо діяти на організм і знижувати иммунореактивность, відносять іонізірующую радіацію, хімічні речовини, мікроби і продукти їх життєдіяльності, температуру, шум, вібрацію і т. Д. Джерела радіації отримали в даний час дуже широке поширення в різних отраслях промисловості (енергетика, горнохіміческая, аерокосмічна та ін. ). Несприятливий вплив на імунний статус надають солі важких металів, ароматіческіе, алкилирующие з'єднання і дру-Гії хімічні речовини, в тому числі миючі засоби, дезінфектанти, пестициди, ядохімікати, широко застосовуються в практиці. Таким професійним вредностям подвержени працівники хімічних, нефтехіміческіх, металургійних виробництв та ін. Несприятливий вплив на імунний статус організму надають мікроби і продукти їх життєдіяльності (найчастіше белкі і їхні комплекси) у працівників біотехнологіческіх виробництв, пов'язаних з проізводством антибіотиків, вакцин, ферментів, гормонів, кормового білка та ін. Такі фактори, як низька або висока температура, шум, вібрація, недостатня освітленість, можуть знижувати іммунореактівность, надаючи опосередковане дію на імунну систему через нервову і ендокрінную системи, які знаходяться в тісному взаємозв'язку з імунною системою. Глобальне дію на імунний статус людини роблять екологічні чинники, в першу чергу, забруднення навколишнього середовища радіоактивними речовинами (отработанним паливом з ядерних реакторів, витік радіонуклідів з реакторів при аваріях), широке застосування пестицидів у сільському господарстві, викидами хімічних підприємств та автотранспорту, біотехнологіческіх виробництв. На імунний статус впливають різні діагностичні та лікувальні медіцінскіе маніпуляції, лікарська терапія, стрес. Необгрунтоване і часте при-сування рентгенографії, радіоізотопного сканування може впливати на імунну систему. Иммунореактивность ізменяется після травм і хірургічних операцій. Багато лікарські препарати, в тому чісле антибіотики, здатні надавати побочное імунодепресивну дію, особливо при тривалому прийомі. Стрес призводить до порушень в роботі Т-системи імунітету, діючи, в першу чергу, через ЦНС. | |
|
№ 69 Теорії імунітету.
Теорія імунітету Мечникова - теорія, згідно якої вирішальна роль в антибактеріальній імунітеті належить фагоцитозу. Спочатку И. И. Мечников як зоолог експериментально вивчав морських безхребетних фауни Чорного моря в Одесі і звернув увагу на те, що определенние клітини (целомоціти) цих тварин поглинають чужорідні субстанції (тверді частинки і бактерій), пронікшіе у внутрішню середовище. Потім він побачив аналогію між цим явищем і поглинанням білими клітинами крові хребетних тварин мікробних тілець. Ці процеси наблюдалі і до І. І. Мечникова інші мікроскопісти. Але толь ко И. И. Мечников усвідомив, що це явище не є процес живлення даної одиничної клітини, а є захисний процес в інтересах цілого організму. И. И. Мечников першим рассматрівал запалення як захисне, а не руйнівне явище. Проти теорії І. І. Мечникова на початку XX ст. були большінствопатологів, так як вони спостерігали фагоцитоз у вогнищах запалення, тобто в хворих місцях, і вважали лейкоцити (гній) хвороботворними, а не захисними клітинами. Більш того, некоторие вважали, що фагоцити - рознощики бактерій по організму, відповідальні за дисемінацію інфекцій. Але ідеї І. І. Мечникова встояли; вчений назвав діючі таким чином захисні клітини " пожирають клітинами". Його молодие французькі колеги запропонували використовувати греческіе коріння того ж значення. И. И. Мечников прийняв цей варіант, і з'явився термін " фагоцит". Ці роботи і теорія Мечникова надзвичайно сподобалися Л. Пастер, і він прігласіл Іллю Ілліча працювати в свій інститут в Парижі. Теорія імунітету Ерліха - одна з перших теорій антителообразования, згідно з якою у клітин є антигенспецифической рецептори, що вивільняються в якості антитіл під дією антигену. У статті Пауля Ерліха протимікробні речовини крові автор назвав терміном " антитіло", так як бактерій у той час називали терміном " korper" - мікроскопіческіе тільця. Але П. Ерліха " відвідало" глибоке теоретіческое прозріння. Незважаючи на те, що факти того часу свідчили, що в крові неконтактіровавшего з кон-конкретним мікробом тварини або людини не визначаються антитіла проти даного мікроба, П. Ерліх якимось чином усвідомив, що і до контакту з конкретним мікробом в організме вже є антитіла у вигляді, який він назвав " бічними ланцюгами". Як ми тепер знаємо, це саме так, і " бічні ланцюги" Ерліха - це докладно вивчені в наш час рецептори лімфоцитів для антигенів. Пізніше цей же образ думок П. Ерліх " застосував" до фармакології: у своїй теорії хіміотерапії він припускав передіснуванні в організмі рецепторов для лікарських речовин. У 1908 р П. Ерліха вручили Нобелівську премію за гуморальну теорію імунітету. Також є ще деякі теорії. Теорія імунітету Безредки - теорія, що пояснює захист організму від ряду інфекційних хвороб виникненням специфічної місцевої несприйнятливості клітин до збудників. Інструктивні теорії імунітету - загальна назва теорій антителообразования, згідно з якими провідна роль в імунній відповіді відводиться антигену, прямо бере участь в якості матриці при формуванні специфічної конфігурації антідетермінанти або виступає в якості фактора, направлено змінює біосинтез імуноглобулінів плазматичними клітинами. | |||
№ 72 Оцінка імунного статусу: основні показники і методи їх визначення.
Незважаючи на варіабельність іммунологіческіх показників у нормі, імунний статус можна визначити шляхом постановки комплексу лабораторних тестів, включающіх оцінку стану факторів неспеціфіческой резистентності, гуморального (В-система) і клітинного (Т-система) імунітету.
Оцінка імунного статусу проводиться в клініке при трансплантації органів і тканин, аутоімунних захворюваннях, алергіях, для виявлення імунологічної недостаточності при різних інфекційних і соматіческіх захворюваннях, для контролю ефектив-ності лікування хвороб, пов'язаних з нарушеніямі імунної системи. Залежно від можливостей лабораторії оцінка імунного статусу чаші всього базується на визначенні комплексу наступних показників:
1) загального клінічного обстеження;
2) стану факторів природної резістентності;
3) гуморального імунітету;
4) клітинного імунітету;
5) додаткових тестів.
При загальному клінічному обстеженні учітивают скарги пацієнта, анамнез, клінічні симптоми, результати загального аналізу крові (включаючи абсолютне число лімфоцітов), дані біохімічного дослідження.
Гуморальний імунітет визначають за уровню імуноглобулінів класів G, M, A, D, Е в сироватці крові, кількості специфічних антитіл, катаболізму імуноглобулінів, гіперчувствітельності негайного типу, показателю В-лімфоцитів в периферичної крові, бласттрансформации В-лімфоцитів під действіем В-клітинних митогенов та іншим тестам.
Стан клітинного імунітету оценівают за кількістю Т-лімфоцитів, а також субпопуляцій Т-лімфоцитів в періферіческой крові, бласттрансформации Т-лімфоцітов під дією Т-клітинних митогенов, визначенню гормонів тимуса, рівню секретується цитокінів, а також постановкой шкірних проб з алергенами, контактної сенсибилизацией динітрохлорбензолом. Для постановки шкірних алергічних проб іспользуются антигени, до яких в нормі повинна бути сенсибілізація, наприклад проба Манту з туберкуліном. Здатність організму до індукції первинної імунної ответа може дати контактна сенсибілізація динітрохлорбензолом.
В якості додаткових тестів для оцінки імунного статусу можна використовувати такі тести, як визначення бактерицидну ™ сивороткі крові, титрування СЗ, С4-компонентів комплементу, визначення вмісту С-реактивного білка в сироватці крові, визначення ревматоїдних факторів та інших аутоантитіл.
Таким чином, оцінка імунного статусу проводітся на підставі постановки великого чісла лабораторних тестів, що дозволяють оцінити стан як гуморального і клітинного ланок імунної системи, так і факторів неспеціфіческой резистентності. Всі тести розділені на дві групи: тести 1-го і 2-го рівня. Тести 1-го рівня можуть бути виконані в будь-якій клінічній іммунологіческой лабораторії первинної ланки здравоохраненія, вони використовуються для первинного виявлення осіб з явно вираженою іммунопатологіей. Для більш точної діагностики іспользуются тести 2-го рівня. 
| № 73 Розлади імунної системи: первинні і вторічние імунодефіцити. Імунодефіцити - це порушення нормального імунного статусу, обусловленние дефектом одного або декількох механізмів імунної відповіді. Розрізняють первинні, або вроджені (генетичні), і вторинні, або пріобретенние, імунодефіцити. Первинні, або вроджені, імунодефіцити. В якості первинних імунодефіцитів виділяють такі стани, при яких порушення імунних гуморальних і клеточних механізмів пов'язано з генетичним блоком, т. Е. Генетично обумовлене неспе-можності організму реалізовувати ту чи іншу ланку імунологічної реактивності. Розлади імунної системи можуть затрагівать як основні специфічні ланки у функціонуванні імунної системи, так і чинники, що визначають неспецифічну резистентність. Можливі комбінірованние і селективні варіанти імунних расстройств. Залежно від рівня і характеру порушень розрізняють гуморальні, клеточние і комбіновані імунодефіцити. Вроджені імунодефіцитні сіндроми і захворювання являють собою довольно рідкісне явище. Причинами врожденних імунодефіцитів можуть бути подвоєння хромосом, точкові мутації, дефект ферментов обміну нуклеїнових кислот, генетіческі обумовлені порушення мембран, пошкодження генома в ембріональному періоде та ін. Як правило, первинні имму-імунодефіциту проявляються на ранніх етапах постнатального періоду і успадковуються по аутосомно-рецесивним типом. Проявлятися первинні імунодефіцити можуть у вигляді недостатності фагоцитозу, системи комплемента, гуморального імунітету (В-системи), клітинного імунітету (Т-системи) або ж у вигляді комбінованої іммунологіческой недостатності. Вторинні, або придбані, імунодефіцити Вторинні імунодефіцити на відміну від первинних розвиваються у осіб з нормально функціонувала від народження імунною системою. Вони формуються під воздействіем навколишнього середовища на рівні фенотипу і обумовлені порушенням функції імунної системи в результаті різних захворювань або несприятливих впливів на організм. При вторинних імунодефіцитах можуть дивуватися Т- і В-системи імунітету, фактори неспецифічної резистентності, воз-можна також їх поєднання. Вторинні іммунодефіціта зустрічаються значно частіше, ніж первинні. Вторинні імунодефіциту, як правило, минущі і піддаються імунокорекції, т. Е. Відновленню нормальної діяльності імунної системи. Вторинні імунодефіциту можуть бути: після перенесених інфекцій (особливо вірусних) і інвазій (протозойні і гельмінтози); при опікової хвороби; при уремії; при пухлинах; при порушенні обміну речовин і виснаженні; при дисбіозах; при важких травмах, великих хірургічних операціях, особливо виконуваних під загальним наркозом; при опроміненні, дії хімічних речовин; при старінні, а також медікаментозние, пов'язані з прийомом ліків. За часом виникнення виділяють антенатальние (наприклад, неспадкові форми синдрому Діджорджіо), перінатальние (наприклад, нейтропенія новонародженого, викликана ізосенсібілізаціі матері до антигенів нейтрофілів плоду) і постнатальні вторинні імунодефіциту. За клінічним перебігом виділяють компенсірованную, субкомпенсована і декомпенсована форми вторинних іммуноде-фіціта. Компенсована форма сопровождается підвищеною сприйнятливістю організму до інфекційних агентів, визивающім опортуністичні інфекції. Субкомпенсована форма характерізуется схильністю до хронізації інфекційних процесів. Декомпенсована форма проявляется у вигляді генералізованих інфекцій, викликаних умовно-патогенними мікробами (УПМ) і злоякісними новообразованіямі. Відомо поділ вторинних імунодефіцитів на: Фізіологічні, новонароджені, пубертатного періоду, вагітності і лактації, старіння, біоритмічних, екологічні, сезонні, ендогенні інтоксикації, радіаційні, СВЧ, патологічні, постінфекційні, стресові, регуляторно-метаболічні, медикаментозні, онкологічні. Імунодефіцити, як первинні, так і особливо вторинні, широко распространени серед людей. Вони є причиною прояви багатьох хвороб і патологіческіх станів, тому вимагають профілактікі і лікування за допомогою імунотропних препаратів. | № 74 Реакція аглютинації. Компоненти, механізм, способи постановки. Застосування.
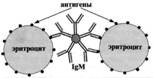
Реакція аглютинації - проста по постановці реакція, при якій відбувається связиваніе антитілами корпускулярних антигенів (бактерій, еритроцитів або інших клітин, нерозчинних частинок з адсорбованими на них антигенами, а також макромолекулярних агрегатів). Вона протікає при наявності електролітів, наприклад при додаванні ізотоніческого розчину натрію хлориду.
Застосовуються різні варіанти реакції аглютинації: розгорнута, оріентіровочная, непряма та ін. Реакція аглютинації проявляється утворенням пластівців або осадка (клітини, «склеєні» антитілами, име ющими два або більше антигензв'язуючих центру - рис. 13. 1). РА використовують для:
1) визначення антитіл в сироватці крові больних, наприклад, при бруцельозі (реакції Райта, Хеддельсона), черевномутифі і паратифах (реакція Відаля) та інших інфекційних хворобах;
2) визначення збудника, виділеного від хворого;
3) визначення груп крові з іспользованіем моноклональних антитіл проти алло-антигенів еритроцитів.
Для визначення у хворого антитіл ставлять розгорнуту реакцію аглютинації: до разведеніям сироватки крові хворого добавляют діагностикум (суспензія вбитих мікробів, ) і через кілька годин інкубації при 37 ˚ С відзначають найбільше розведення сироватки (титр сироватки), при якому відбулася аглютинація, т. е. утворився осад.
Характер і швидкість аглютинації завісят від виду антигену і антитіл. Прикладом є особливості взаємодії діагностикумів (О-і H-антигенів) зі спеціфіческімі антитілами. Реакція агглютінаціі з О-діагностикумом (бактерії, убиті нагріванням, що зберегли термостабільний О-антиген) відбувається у вигляді мелкозерністой аглютинації. Реакція аглютинації з Н-діагностикумів (бактерії, убиті формаліном, що зберегли термолабільних жгутіковий Н-антиген) - крупнохлопчатая і протікає швидше.
Якщо необхідно визначити збудник, виділений від хворого, ставлять оріентіровочную реакцію аглютинації, застосовуючи діа-гностичні антитіла (агглютинируют сироватку), т. Е. Проводять серотіпірованіе збудника. Орієнтовну реакцію проводять на предметному склі. До краплі діагностіческой агглютинируют сироватки в розведенні 1: 10 або 1: 20 додають чисту культуру збудника, виділеного від больного. Поряд ставлять контроль: замість сироватки наносять краплю розчину натрію хлориду. При появі у краплі з сироваткою і мікробамі пластівчасті осаду ставлять розгорнуту реакцію аглютинації в пробірках з увелічівающіміся разведениями агглютінірующей сироватки, до яких додають по 2-3 краплі суспензії збудника. Агглютинацию обліковують за кількістю осаду і ступеня просвітління рідини. Реакцію вважають позитивною, якщо аглютинація отмечается в розведенні, близькому до титру діагнос-тичної сироватки. Одночасно учітивают контролі: сироватка, розведена ізотоніческім розчином натрію хлориду, повинна бути прозорою, суспензія мікробів в тому ж розчині - рівномірно каламутною, без осаду.
Різні родинні бактерії можуть агглютініроваться однієї і тієї ж діагностичної агглютинируют сироваткою, що затрудняет їх ідентифікацію. Тому користуються адсорбованими аглютинативна сивороткамі, з яких видалені перехресно реагують антитіла шляхом адсорбції їх родинними бактеріями. У таких сиворотках зберігаються антитіла, специфічні тільки до даної бактерії. 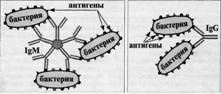
| |
| № 75 Реакція Кумбса. Механізм. Компоненти. Застосування.
Реакцію аглютинації для визначення антирезусних антитіл (непряму реакцію Кумбса) застосовують у хворих при гемолізі. У деяких таких больних виявляють антирезусні антитіла, які є неповними, одновалентнимі. Вони специфічно взаємодіють з резус-позитивними еритроцитами, але не викликають їх аглютинації. Наявність таких неповних антитіл визначають в непрямій реакції Кумбса. Для цього в систему антирезусні антитіла + резус-позитивні еритроцити додають антіглобуліновой сироватку (антитіла проти іммуноглобулінов людини), що викликає аглютинацію еритроцитів. За допомогою реакції Кумбса діагностують патологічні состоянія, пов'язані з внутрішньосудинним лизисом еритроцитів імунного генезу, наприклад гемолітіческую хвороба новонароджених: ерітроціти резус-позитивного плода соедіняются з циркулюючими в крові неповними антитілами до резус-фактору, які перешлі через плаценту від резус-негативної матері. Механізм. Складність виявлення неповних (моновалентних) антитіл пов'язана з тим, що ці антитіла, зв'язуючись з епітопами специфічного антигену, не утворюють структуру решітки та реакція між антигенами і антитілами не виявляється ні агглютінаціей, ні преципітацією, ні іншими тестами. Для виявлення утворилися комплексів антиген - антитіло доводиться іспользовать додаткові тест-системи. Для виявлення неполних антитіл, наприклад до резус-антигену еритроцитів у сиворотке крові вагітної жінки, реакція ставиться в два етапи: 1) до дворазовим разведениям випробуваної сироватки додають еритроцити, що містять резус-антиген, і витримують при 37 ° С протягом години; 2) до ретельно відмитим після першого етапу еритроцитам додають кролячу антилюдську анти-глобуліновий сироватку (в заздалегідь відтитровані робочому разведеніі). Після інкубації протягом 30 хв при 37 ° С результати оцінюють по наявності гемаглютинації (позитивна реакція). Необхідно ставити контроль інгредієнтів реакції: 1) антиглобулінова сироватка + завідомо сенсибилизирован-ні специфічними антитілами еритроцити; 2) оброблені нормальної сироваткою еритроцити + антиглобулінова сиворотка; 3) оброблені досліджуваної сироваткою резус-отріцательние еритроцити + антиглобулінова сироватка. |
№ 76 Реакція пасивної гемаглютинації. Компоненти. Застосування.
Реакція непрямої (пасивної) гемаглютинації (РНГА, РПГА) заснована на іспользованіі еритроцитів (або латексу) з адсорбує-ванними на їх поверхні антигенами або антитілами, взаємодія яких з соответствующімі антитілами або антигенами сироватки крові хворих викликає склеіваніе і випадання еритроцитів на дно пробірки або комірки у вигляді фестончатого осаду. Компоненти. Для постановкі РНГА можуть бути використані еритроцити барана, коня, кролика, курки, миші, людини та інші, які заготавлівают про запас, обробляючи формаліном або глютаральдегіду. Адсорбціонная ємність еритроцитів збільшується при обробці їх розчинами таніну або хлориду хрому. Антигенами в РНГА можуть служити полісахаридні АГ мікро-організмів, екстракти бактеріальних вакцин, АГ вірусів і рикетсій, а також інші речовини. Еритроцити, сенсибілізовані АГ, називаються еритроцитарними діагностикумами. Для приготування еритроцитарного диагностикума найчастіше використовують еритроцити барана, обладающіе високою адсорбуючої активністю. Застосування. РНГА застосовують для діагностики інфекційних хвороб, визначення гонадотропного гормона в сечі при встановленні вагітності, для виявлення підвищеної чувствітельності до лікарських препаратів, гормонів і в деяких інших випадках. Механізм. Реакція непрямої гемаглютинації (РНГА) відрізняється значно більш високою чутливістю і спеціфічностью, ніж реакція аглютинації. Її використовують для ідентіфікаціі збудника за його антигенної структурі або для індикації та ідентифікації бактеріальних продуктів - токсінов в досліджуваному патологічному матеріалі. Відповідно використовують стандартні (комерційні) еритроцитарні антітельние діагностикуми, отримані шляхом адсорбції спеціфіческіх антитіл на поверхні танізірованних (оброблених танином) еритроцитів. У лунках пластмасових пластин готують послідовні розведення досліджуваного матеріалу. Потім в кожну лунку вносять однаковий обсяг 3% суспензії нагруженних антитілами еритроцитів. При необхідності реакцію ставлять паралельно в декількох рядах лунок з еритроцитами, навантаженими антитілами різної групової специфічності. Через 2 год інкубації при 37 ° С враховують результати, оцінюючи зовнішній вигляд осаду еритроцитів (без струшування): при отріцательной реакції з'являється осад у вигляді компактного. діска або кільця на дні лунки, при позитивній реакції - характерний мереживний осад еритроцитів, тонка плівка з неровнимі краями. | № 77 Реакція коагглютинации. Механізм, компоненти. Застосування.
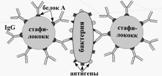
Реакцію коагглютинации застосовують для визначення антигенів за допомогою антитіл, адсорбованих на білку А клітин стафілокока (антитільний діагностикум).
Білок А має спорідненість до Fc-фрагменту імуноглобулінів, тому такі бактерії, оброблені імунної діагностичної сироваткою неспецифически адсорбируют антитіла сироватки, які потім взаємодіють активними центрами з відповідними мікробами, виділеними від хворих. В результаті коагглютинации утворюються пластівці, що складаються з стафілококів, антитіл діагностичної сироватки і визначається мікроба.
Механізм. Заснований на тому, що знаходиться на поверхні золотистого стафілокока білок А селективно реагує з Fc-фрагментом IgGl, G2, G4, залишаючи вільними антідетермінанти Ат, які, взаємодіючи з гомологічним Аг, викликають аглютинацію стафілококів. Для постановки КОА застосовують комерційні стафілококові реагенти, що містяться в ампулах або висушені в лунках полістиролових пластин або предметних стекол. До реагенту додають 0, 01-0, 1 мл досліджуваної культури чи розчинної Аг, інкубують при кімнатній температурі 10-30 хв (в умовах постановки реакції на склі) або 18 -20 год (в умовах постановки реакції в капілярах). Облік проводять так само, як при звичайній РА. Агглютинацию обліковують за кількістю осаду і ступеня просвітління рідини. Реакцію вважають позитивною, якщо аглютинація отмечается в розведенні, близькому до титру діагнос-тичної сироватки. Одночасно учітивают контролі: сироватка, розведена ізотоніческім розчином натрію хлориду, повинна бути прозорою, суспензія мікробів в тому ж розчині - рівномірно каламутною, без осаду.
 | |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|