- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
№ 4 Основні принципи класифікації мікробів. 4 страница
|
№ 33 Методи стерилізації, апаратура.
Стерилізація передбачає повну інактивацію мікробів в об'єктах, що піддаються обробці. Існує три основні методи стерілізаціі: тепловий, променевої, хімічної. Теплова стерилізація заснована на чувствітельності мікробів до високої температури. При 60 " С і наявності води відбувається денат-рація білка, деградація нуклеїнових кислот, ліпідів, внаслідок чого вегетативні форми мікробів гинуть. Спори, що містять дуже велику кількість води у зв'язаному стані і володіють щільними оболочкамі, инактивируются при 160-170 ° С. Для теплової стерилізації застосовують, в основному, сухий жар і пар під тиском. Стерилізацію сухим жаром осуществляют в повітряних стерилізаторах (колишня назва - «сухожарові шафи або печі Пастера»). Повітряний стерилізатор представляет собою металевий щільно закривающійся шафа, що нагрівається за допомогою електрики і забезпечений термометром. Знезараження матеріалу в ньому вироб-дять, як правило, при 160 ° С протягом 120 хв. Однак можливі й інші режими: 200 ° С - 30 хв, 180 " С - 40 хв. Стерилізують сухим жаром лабораторний посуд та інші вироби зі скла, інструменти, силіконову гуму, т. Е. Об'єкти, які не втрачають своїх якостей при високій температурі. Велика частина стерилізуємих предметів не витримує подібної обробки, і тому їх знезаражують в парових стерилізаторах. Обробка парою під тиском в парових стерилізаторах (стара назва - «автоклави») є найбільш універсальним методом стерилізації. Паровий стерилізатор (існує множество його модифікацій) - металевий циліндр з міцними стінками, що герметично закривається, що складається з водопаровой і стерилизующей камер. Апарат забезпечений манометром, термометром та іншими контрольно-вимірювальними приладами. У автоклаве створюється підвищений тиск, що призводить до збільшення температури кипіння. Оскільки крім високої температури на мікроби впливає і пар, суперечки гинуть вже при 120 ° С. Найбільш распространенний режим роботи парового стерилізатора: 2 атм - 121 ° С - 15-20 хв. Час стерілізаціі зменшується при підвищенні атмосферного тиску, а отже, і температури кипіння (136 ° С - 5 хв). Мікроби гинуть за кілька секунд, але обробку матеріалу виробляють протягом більшого часу, тому що, по-перше, висока температура повинна бути і всередині стерилізується матеріалу і, по-друге, існує так зване поле безпеки (розраховане на невелику неісправность автоклава). Стерилізують в автоклаві бульшую частина предметів: перев'язувальний матеріал, білизна, корозійно-стійкі металеві інструменти, живильні середовища, розчини, інфекційний матеріал і т. Д. Одним з різновидів теплової стерілізаціі є дробова стерилізація, которую застосовують для обробки матеріалів, що не витримують температуру вище 100 ° С, наприклад, для стерилізації поживних середовищ з вуглеводами, желатину. Їх нагрівають в водяной бані при 80 ° С протягом 30-60 хв. В даний час застосовують ще один метод теплової стерилізації, предназначенний спеціально для молока - ультрависокоч-температурний (УВТ): молоко обробляють протягом декількох секунд при 130-150 ° С. Хімічна стерилізація передбачає іспользованіе токсичних газів: оксиду етілена, суміші ОБ (суміші оксиду етилену і бромістого метилу у ваговому співвідношенні 1: 2, 5) і формальдегіду. Ці речовини є ал-кілірующімі агентами, їх здатність у присутності води инактивировать активні групи у ферментах, інших білках, ДНК і РНК призводить до загибелі мікроорганізмів. Стерилізація газами здійснюється у присутності пари при температурі від 18 до 80 ° С в спеціальних камерах. У лікарнях використовують формальдегід, в промислових умовах - оксид етилену і суміш ОБ. Перед хімічною стерилізацією все ізделія, що підлягають обробці, повинні бути висушені. Цей вид стерилізації небезпечний для персоналу, для навколишнього середовища і для паціентов, що користуються простерилізованих предметами (більшість стерилізуючих агентів залишається на предметах). Однак існують об'єкти, які могут бути пошкоджені нагріванням, наприклад, оптичні прилади, радіо- і електронна апаратура, предмети з нетермостойкого полімеров, живильні середовища з білком і т. П., Для яких придатна тільки хімічна сте-рілізація. Наприклад, космічні кораблі й супутники, укомплектовані точної аппаратурой, для їх деконтамінації обезв-переживав газовою сумішшю (оксид етилену і бромистого метилу). Останнім часом у зв'язку з широким распространеніем в медичній практиці ізделій з термолабільних матеріалів, снабженних оптичними пристроями, наприклад ендоскопів, стали застосовувати обезврежіваніе за допомогою хімічних розчинів. Після очищення та дезінфекції прилад поміщають на певний час (від 45 до 60 хв) в стерілізующій розчин, потім прилад повинен бути відмитий стерильною водою. Для стерілізаціі і відмивання використовують стерильні ємності з кришками. Простерилизованное і відмите від стерилізуючого розчину виріб висушують стерильними серветками і помещают в стерильну ємність. Всі маніпуляціі проводять в асептичних умовах і в стерильних рукавичках. Зберігають ці вироби не більше 3 діб. Променева стерилізація здійснюється або за допомогою гамма-випромінювання, або з помощью прискорених електронів. Променева стерилізація є альтернатівой газової стерилізації в промислових умовах, і застосовують її також у тих випадках, коли стерилізується предмети не видержівают високої температури. Променева стерілізація дозволяє обробляти відразу велику кількість предметів (наприклад, одноразових шприців, систем для переливання крові). Завдяки можливості широкомасштабної стерилізації, застосування цього методу вполне виправдано, незважаючи на його екологіческую небезпеку і неекономічність. Ще одним способом стерилізації є фільтрування. Фільтрування за допомогою разлічних фільтрів (керамічних, азбестових, скляних), а особливо мембранних ультрафільтров з колоїдних розчинів нітроцеллюкози або інших речовин дозволяє звільнити рідини (сироватку крові, ліки) від бак-терій, грибів, найпростіших і навіть вірусів. Для прискорення процесу фільтрації зазвичай створюють підвищений тиск у ємності з фільтрованої рідиною або знижений тиск в ємності з фільтратом. В даний час все більш широке прімененіе знаходять сучасні методи стерілізаціі, створені на основі нових техно-логій, з використанням плазми, озону. | № 34 Методи санітарно-мікробіологічного дослідження води. Забрудненість води визначається за загальною мікробной обсіменіння і виявленню санітарно-показових мікроорганізмів - індікаторов наявності виділень людини або тварин. У воді реєструють кишкову паличку, БГКП (коліформні палички), ентерококк, стафілококи; На підставі кількісного виявленія цих санітарно-показових бактерій обчислюються індекс БГКП (число БГКП в 1 л води), перфрінгенс-титр, титр ентерококка і т. д. Так, наприклад, титр ентерококка води - це найменше колічество води, в якому визначається ентерокок. До бактеріям групи кишкової палички відносять грамнегативні палички, сбражівающіе з утворенням кислоти і газу лактозу або глюкозу при температурі 37 ° С протягом 24-48 год і не володіють оксидазної активністю. Найбільш часто цей показник застосовують як індикатор фекального загрязненія води. Інший подібний показник фекального забруднення - загальні коліформні бактерії: грамнегативні, оксиду-заотріцательние палички, ферментують лактозу або маніт (глюкозу) з утворенням альдегіду, кислоти і газу при температурі 37 ° С протягом 24 годин. Замість останнього терміну пропонується використовувати термін «бактерії сімейства Enterobacteriaceae», так як всі бактерії цього сімейства мають ін-дікаторное значення. До бактеріям сімейства Enterobacteriaceae відносяться грамотріцательние, оксідазаотріцательние палички, растущіе на лактозосодержащие середовищах типу середовища Ендо і ферментують глюкозу до кислоти і газу при температурі 37 ° С протягом 24 часов; коліформні бактерії (палички). При бактеріальному забрудненні води понад допустимих норм слід провести дополнітельное дослідження на наявність бактерій - показників свіжого фекального забруднення. До таких бактерій відносять термотолерантні коліформні бактерії, фекальні кишкові палички, ферментують лактозу до кислоти і газу при температурі 44 ° С протягом 24 годин і не ростуть на нітратної середовищі. Про свіжому фекального забруднення свідчить також виявлення ентерококка. На давнє фекальне забруднення вказують відсутність БГКП і налічіе певної кількості клострідш перфрінгенс, т. Е. Найбільш стійких споро-утворюючих бактерій. Відповідно до нормативних документамі регламентуються наступні норматіви мікробіологічних показників питної води при централізованому водопостачанні: 1. Загальне мікробне число води не повинно превишать 100 мікробів в 1 мл досліджуваної води; 2. Загальні коліформні бактерії повинні отсутствовать в 100 мл досліджуваної води; 3. термотолерантні коліформні бактерії повинні отсутстовать в 100 мл досліджуваної води; 4. Коліфаги не повинні визначатися в 100 мл досліджуваної води (облік за бляшкооб-разующим одиницям); 5. Спори сульфітредукуючих клостридий не повинні визначатися в 20 мл досліджуваної води; 6. Цисти лямблій не повинні визначатися в 50 мл досліджуваної води. Крім того, забрудненість води оценівается по виявленню патогенних мікробів з фекально-оральним механізмом передачі (ентеровіруси, ентеробактерії, холерні вібріони та ін. ). |
№ 36 Будова генома бактерій. Поняття про генотип і фенотіпе. Види мінливості. Рухливі генетичні елементи, їх роль в еволюції бактерій. Бактеріальний геном складається з генетіческіх елементів, здатних до самостоятельной реплікації, т. Е. Репліконов. РЕПЛІКОН є бактеріальная хромосома і плазміди. Спадкова інформація зберігається у бактерій у формі послідовності нуклеотидів ДНК, які визначають після-довність амінокислот у білку. Кожному білку відповідає свій ген, т. Е. Дискретний ділянку на ДНК, отлічающійся числом і специфічністю последовательності нуклеотидів. Бактеріальна хромосома представлена однієї двухцепочечной молекулою ДНК кільцевої форми. Розміри бактеріальної хромосоми у разлічних представників царства Procaryotae варіюють. Бактеріальна хромосома формірует компактний нуклеоид бактеріальної клітини. Бактеріальна хромосома має гаплоїдний на-бор генів. Вона кодує життєво важливі для бактеріальної клітини функції. Плазміди бактерій являють собою дволанцюжкові молекули ДНК. Вони кодують не основні для життєдіяльності бактеріальної клітини функції, але додають бактерії преімущества при попаданні в несприятливі умови існування. Властивості мікроорганізмов, як і будь-яких інших організмів, визначаються їх генотипом, тобто сукупністю генів даної особини. Термін «геном» щодо мікроорганізмів - майже синонім по-няття «генотип». Фенотип є результат взаємодії между генотипом і навколишнім середовищем, т. Е. Прояв генотипу в конкретних умовах проживання. Фенотип мікроорганізмів хоча і залежить від навколишнього середовища, але контролюється генотипом, так як характер і ступінь можливих для даної клітини стенотіпіческіх змін визначаються набором генів, кожен з яких представлений певною ділянкою молекули ДНК. В основі мінливості лежить або зміна реакції генотіпа на фактори навколишнього середовища, або зміна самого генотипу в результаті мутації генів або їх рекомбінації. У связі з цим фенотипическую мінливість поділяють на наследственную і ненаследственную. Ненаследственная (средовая, модификационная) мінливість обумовлена впливом внутрішньо- і позаклітинних факторів на проявленіе генотипу. При усуненні фактора, що викликав модіфікацію, дані зміни зникають. Спадкова (генотипическая) мінливість, пов'язана з мутаціями, - мутационная мінливість. Основу мутації составляют зміни послідовності нуклеотидів в ДНК, повна або часткова їх втрата, т. Е. Відбувається структурна перестройка генів, що виявляється фенотипически у вигляді ізмененного ознаки. Спадкова мінливість, пов'язана з рекомбінаціями, називається рекомбинационной мінливістю. Рухливі генетичні елементи. До складу бактеріального генома, як в бактеріальную хромосому, так і в плазміди, входять рухливі генетичні елементи. До рухомим генетичним елементам относятся вставні послідовності і транспозони. Вставні (інсерційні) последовательності IS-елементи - це ділянки ДНК, здатні як ціле переміщатися з однієї ділянки реплікону в інший, а також між РЕПЛІКОН. Вони містять лише ті гени, які необхідні для їх власного переміщення - транс-позиції: ген, що кодує фермент транспозази, що забезпечує процес виключення IS-елемента з ДНК і його інтеграцію в новий локус, і ген, що детермінують синтез репрессора, який регулює весь процес переміщення. Відмінною особливістю IS-елементів є наявність на кінцях Інтернейрони послідовності інвертованих повторов. Ці інвертовані повтори дізнається фермент транспозази. Транспозази здійснює одноцепочечниє розриви цепей ДНК, розташованих по обидві сторони від рухомого елемента. Оригінальна копія IS-елемента залишається на колишньому місці, а її реплицироваться дуплікатов переміщається на нову ділянку. Переміщення рухомих генетичних елементів прийнято називати репликативной або незаконної рекомбинацией. Однак на відміну від бактеріальної хромосоми і плазмід рухливі генетичні елементи не є самостійними РЕПЛІКОН, так як їх реплікація - складовий елемент реплікації ДНК реплікону, у складі которого вони знаходяться. Відомо кілька різновидів IS-елементів, які різняться за размерам і за типами та кількістю інвертірованних повторів. Транспозони - це сегменти ДНК, обладающіе тими ж властивостями, що і IS-елементи, але мають структурні гени, т. Е. Гени, що забезпечують синтез молекул, обладающіх специфічним біологічним свойством, наприклад токсичністю, або забезпечують-вающих стійкість до антибіотиків. Переміщаючись по РЕПЛІКОН або між репліконамі, рухливі генетичні елементи викликають: 1. інактивації генів тих ділянок ДНК, куди вони, перемістившись, вбудовуються. 2. Освіта пошкоджень генетичного матеріалу. 3. Злиття репліконов, т. Е. Вбудовування плазміди в хромосому. 4. Поширення генів у популяції бактерій, що може призводити до зміни біологічних властивостей популяції, зміні збудників інфекційних захворювань, а також сприяє еволюційним процессам серед мікробів. Зміни бактеріального генома, а следовательно, і властивостей бактерій можуть проісходіть в результаті мутацій і рекомбінації. | |
| № 35 Микрофлора воздуха и методы ее исследования. Микробиологический контроль воздуха проводится с помощью методов естественной или принудительной седиментации микробов. Естественная седиментация (по методу Коха) проводится в течение 5—10 мин путем осаждения микробов на поверхность твердой питательной среды в чашке Петри. Принудительная седиментация микробов осуществляется путем «посева» проб воздуха на питательные среды с помощью специальных приборов (импакторов, импинджеров, фильтров). Импакторы — приборы для принудительного осаждения микробов из воздуха на поверхность питательной среды (прибор Кротова, пробоотборник аэрозоля бактериологический и др. ). Импшджеры — приборы, с помощью которых воздух проходит через жидкую питательную среду или изотонический раствор хлорида натрия. Санитарно-гигиеническое состояние воздуха определяется по следующим микробиологическим показателям: 1. Общее количество микроорганизмовв 1 м3 воздуха (так называемое общее микробное число, или обсемененность воздуха) — количество колоний микроорганизмов, выросших при посеве воздуха на питательном агаре в чашке Петри в течение 24 ч при 37 °С, выраженное в КОЕ; 2. Индекс санитарно-показательных микробов—количество золотистого стафилококка и гемолитических стрептококков в 1 м3 воздуха. Эти бактерии являются представителями микрофлоры верхних дыхательных путей и имеют общий путь выделения с патогенными микроорганизмами, передающимися воздушно-капельным путем. Появление в воздухе спорообразу-ющих бактерий — показатель загрязненности воздуха микроорганизмами почвы, а появление грамотрицательных бактерий — показатель возможного антисанитарного состояния. Для оценки воздуха лечебных учреждений можно использовать данные из официально рекомендованных нормативных документов. | |||
|
№ 37 Механізми передачі генетичного матеріалу у бактерій. Кон'югація бактерій полягає в переході генетіческого матеріалу (ДНК) з клітки-донора («чоловічий») в клетку-реципієнт («жіночу») при контакті клітин між собою. Чоловіча клітина містить F-фактор, або статевий фактор, який контролює синтез так званих статевих пілей, або F-пілей. Клітини, що не содержащіе F-фактора, є жіночими; при отриманні F-фактора вони перетворюються на «чоловічі» і самі стають донорами. F-фактор розташовується в цитоплазмі у вигляді кільцевої двунитчатой молекули ДНК, т. Е. Є плазмидой. Молекула F-фактора значно менше хромосоми і містить гени, контролірующіе процес кон'югації, у тому числі синтез F-пілей. При кон'югації F-пили з'єднують «чоловічу» і «жіночу» клітини, забезпечуючи перехід ДНК через кон'югаційний місток або F-пили. Клітини, що містять F-фактор в цитоплазмі, позначаються F +; вони передають F-фактор клітинам, обозначаемим F " (« жіночим »), що не втрачаючи донорської здібності, так як залишають копії F-фактора. Якщо F-фактор включається в хромосому, то бактерії набувають здатність передавати фрагменти хромосомної ДНК і називаються Hfr -клітинами (від англ. high frequency of recombination - висока частота рекомбінацій), тобто бактеріями з високою частотою рекомбінації. При кон'югації клітин Hfr і клітин F " хромосома розривається і передається з визначеної ділянки (початкової точки) в клет ку F ", продовжуючи реплицироваться. Перенесення всієї хромосоми може тривати до 100 хв. Переносима ДНК взаємодіє з ДНК реципієнта - відбувається гомологичная рекомбінація. Перериваючи процес кон'югаціі бактерій, можна визначати послідовність расположенія генів у хромосомі. Іноді F-фактор може при виходе з хромосоми захоплювати невелику її частину, утворюючи так званий заміщений фактор - F '. При кон'югації відбувається тільки часткове перенесення генетіческого матеріалу, тому її не слід ототожнювати полностью із статевим процесом в інших організмів. Трансдукція - передача ДНК від бактерії-донора до бактерії-реципієнта за участю бактеріофага. Розрізняють неспецифічну (загальну) трансдукцію, при якій можливе перенесення будь-якого фрагменти-та ДНК донора, і специфічну - перенесення определенного фрагмента ДНК донора тільки в певні ділянки ДНК реципієнта. Неспецифічна трансдукция обумовлена включеніем ДНК донора в головку фага додатково до геному фага або замість генома фага (дефектні фаги). Специфічна трансдукція обумовлена заміщенням деяких генів фага генами хромосоми клітини-донора. Фагова ДНК, що несе фрагменти хромосоми клітини-донора, включається в строго певні ділянки хромосоми клітини-реципієнта. Таким чином, прівносятся нові гени і ДНК фага у вигляді профага репродукується разом з хромосомою, тобто цей процес супроводжується лізоге-ніей. Якщо фрагмент ДНК, стерпний фагом, не вступає в рекомбінацію з хромосомою реципієнта і не реплицируется, але з нього зчитується інформація про синтез відповідного продукта, така трансдукция називається абортивній. Трансформація заключается в тому, що ДНК, виділена з бактерій у вільній растворімой формі, передається бактерії-реципієнта. При трансформаціі рекомбінація відбувається, якщо ДНК бактерій рід-ного один одному. У цьому випадку можливий обмін гомологічних ділянок власної та проникла ззовні ДНК. Вперше явище трансформації описав Ф. Гріффіт (1928). Він вводив мишам живий невірулентние бескапсульних R-штам пневмококка і одночасно вбитий вірулентний капсульний S-штам пневмокока. З крові загиблих мишей був виділений вірулентний пневмокок, що має капсулу убитого S-штаму пневмококка. Таким чином, убитий S-штам пневмокока передав спадкову здатність капсулообразованія R-штаму пневмококка. О. Евері, К. Мак-Леод і М. Мак-Карті (1944) доказалі, що трансформирующим агентом у цьому випадку є ДНК. Шляхом трансформації можуть бути перенесені різні ознаки: капсулоутворення, стійкість до антибіотиків, синтез ферментів. Вивчення бактеріальної трансформації дозволило встановити роль ДНК як матеріального субстрату спадковості. При вивченні генетичної трансформації у бактерій були разработани методи екстракції та очистки ДНК, біохімічні та біофізичні методи її аналізу. | № 38 Плазміди бактерій, їх функції та властивості. Іспользованіе плазмид в генній інженерії. Плазміди - позахромосомних мобільні генетичні структури бактерій, що представляють собою замкнуті кільця двунитчатой ДНК. За розмірами складають 0, 1-5% ДНК хромосоми. Плазміди здатні автономно копіюватися (реплицироваться) і існувати в цитоплазмі клітини, тому в клітині може бути кілька копій плазмід. Плазміди можуть включатися (інтегріровать) в хромосому і реплицироваться разом з нею. Разлічают трансмісивні і нетрансміссівние плазміди. Трансміссівние (кон'югатівних) плазміди можуть передаватися з однієї бактерії в іншу. Серед фенотипічних ознак, сообщаемих бактеріальної клітці плазмидами, можна виділити наступні: 1) стійкість до антибіотиків; 2) утворення коліціни; 3) продукція факторів патогенності; 4) здатність до синтезу антибіотичних речовин; 5) розщеплення складних органічних веществ; 6) утворення ферментів рестрикції і модифікації. Термін «плазміди» вперше введений американським вченим Дж. Ледербергом (1952) для позначення статевого фактора бактерій. Плазміди несуть гени, які не обов'язкові для клітини-хозяіна, надають бактеріям додаткові властивості, які в певних умовах навколишнього середовища забезпечують їх временние переваги в порівнянні з бесплазміднимі бактеріямі. Деякі плазміди перебувають під строгім контролем. Це означає, що їх реплікація пов'язана з реплікацією хромосоми так, що в кожній бактеріальної клітці прісутствует одна або, принаймні, кілька копій плазмід. Число копій плазмід, що знаходяться під слабким контролем, може сягати від 10 до 200 на бактеріальну клітину. Для характеристики плазмідних репліки-нів їх прийнято розбивати на групи совместімості. Несумісність плазмид пов'язана з не-здатністю двох плазмід стабільно сохраняться в одній і тій же бактеріальної клітці. Несумісність властива тим Плазміда, які володіють високим схожістю репліконов, підтримання яких у клітці регуліруется одним і тим же механізмом. Деякі плазміди можуть оборотно вбудовуватися в бактеріальну хромосому і функціонувати у вигляді єдиного реплікону. Такі плазміди називаються інтегративними або Епісоми. У бактерій різних видів виявлені R-плазміди, несущіе гени, відповідальні за множинну стійкість до лікарських препаратів - антибіотиків, сульфаніламідів та ін., F-плазміди, або статевий фактор бактерій, що визначає їх здатність до кон'югації і утворення статевих пілей, Ent- плазміди, що детермінують продукцію ентеротоксину. Плазміди можуть визначати вірулентність бактерій, напрімер збудників чуми, правця, здатність ґрунтових бактерій використовувати незвичайні джерела вуглецю, контроліровать синтез білкових антібіотікоподобних речовин - бактеріоцинів, детермініруемих плазмидами бактеріоціногеніі, і т. Д. Існування безлічі інших плазмід у мікроорганіз мов дозволяє вважати, що аналогічні структури широко рас-розлогий у найрізноманітніших мікроорганізмів. Плазміди схильні рекомбінації, мутацій, можуть бути елімінувати (видалені) з бактерій, що, однак, не впливає на їх основні властивості. Плазміди є зручною моделлю для експериментів по штучної реконструкції генетіческого матеріалу, широко використовуються в генетичній інженеріі для отримання рекомбінантних штамів. Благодаря швидкому самокопірованія і можливості кон'югації-ційної передачі плазмід всередині виду, між видами або навіть пологами плазміди відіграють важливу роль в еволюції бактерій. | № 39 Медична біотехнологія, її завдання і досягнення. Біотехнологія являє собою область знань, яка вознікла і оформилася на стику мікробіології, молекулярної біології, генетичної інженерії, хімічної технології і ряду інших наук. Народження біотехнології обумовлено потребностямі суспільства в нових, більш дешевих продуктах для народного господарства, в тому числі медицини і ветеринарії, а також в принципово нових технологіях. Біотехнологія - це отримання продуктів з біологіческіх об'єктів або із застосуванням біологічних об'ектов. В якості біологічних об'єктів можуть бути іспользовани організми тварин і людини (наприклад, отримання іммуноглобулінов з сироваток вакцинованих коней або людей; отримання препаратів крові донорів), окремі органи (одержання гормону інсуліну з підшлункової залози крупного рогатої худоби та свиней) або культури тканин (одержання лікарських препаратів). Однак в якості біологічних об'єктів найчастіше використовують одноклітинні мікроорганізми, а також тваринні і рослинні клітини. Клітини тварин і рослин, мікробні клітини в процесі життєдіяльності (асиміляції і дисиміляції) утворюють новие продукти і виділяють метаболіти, що володіють разнообразнимі фізико-хімічними властивостями і біологічною действіем. Біотехнологія використовує цю продукцію клітин як сировина, яка в результаті технологічної обробки перетворюється в кінцевий продукт. За допомогою біотехнології отримують множество продуктів, що використовуються в різних галузях: • медицині (антибіотики, вітаміни, ферменти, амінокіслоти, гормони, вакцини, антитіла, компоненти крові, діагностіческіе препарати, імуномодулятори, алкалоїди, піщевие білки, нуклеїнові кислоти, нуклеозиди, нуклеоті-ди, ліпіди, антиметаболіти, антиоксиданти, протівоглістние і протипухлинні препарати); • ветеринарії та сільському господарстві (кормовий білок: кормовие антибіотики, вітаміни, гормони, вакцини, біологіческіе засоби захисту рослин, інсектициди); • харчової промисловості (амінокислоти, органічні кіслоти, харчові білки, ферменти, ліпіди, цукру, спирти, дріжджі); • хімічної промисловості (ацетон, етилен, бутанол); • енергетиці (біогаз, етанол). Отже, біотехнологія спрямована на створення диаг-тичного, профілактичних і лікувальних медичних та ве-терінарних препаратів, на вирішення продовольчих вопросов (підвищення врожайності, продуктивності тваринництва, поліпшення якості харчових продуктів - молочних, кондітерскіх, хлібобулочних, м'ясних, рибних); на забезпечення многіх технологічних процесів у легкій, хімічній та інших галузях промисловості. Необхідно відзначити також всі возрастающую роль біотехнології в екології, так як очищення стічних вод, переробка відходів і побічних продуктів, їх деградація (фенол, нафтопродукти та інші шкідливі для окружающей середовища речовини) здійснюються за допомогою мікроорганізмов. В даний час в біотехнології виділяють медико-фарма-цевтіческое, продовольче, сільськогосподарське і екологіческое напрямки. Відповідно до цього біотехнологію можна розділити на медичну, сільськогосподарську, промишленную та екологічну. Медична в свою чергу подразделяется на фармацевтичну і иммунобиологическую, сельскохозяйственная - на ветеринарну та біотехнологію растеній, а промислова - на відповідні галузеві направленія (харчова, легка промисловість, енергетика і т. Д. ). Біотехнологію також поділяють на традиційну (старую) і нову. Останню пов'язують з генетичною інженеріей. Загальновизнане визначення предмета «біотехнологія» отсутствует і навіть ведеться дискусія про те, наука це чи проізводство. |
|
№ 40 Молекулярно-біологічні методи, використовувані в діа-гностики інфекційних хвороб (ПЛР, рестрикційний аналіз та ін. ). Полімеразна ланцюгова реакція дозволяє виявити мікроб в ис-следуемое матеріалі (воді, продуктах, матеріале від хворого) по наявності в ньому ДНК мікроба без виділення останнього в чисту культуру. Для проведення цієї реакції з ісследуемого матеріалу виділяють ДНК, в якій визначають наявність специфічного для данного мікроба гена. Виявлення гена осуществляют його накопиченням. Для цього необходімо мати праймери комплементарного З'-кінців ДНК. вихідного гена. Накопичення (ампліфікація) гена виконується слідую щим чином. Виділену з досліджуваного матеріалу ДНК нагрівають. При цьому ДНК розпадається на 2 нитки. Додають праймери. Суміш ДНК і праймерів охолоджують. При цьому праймери, при наявності в суміші ДНК іскомого гена, зв'язуються з його комплементарними ділянками. Потім до суміші ДНК і праймера додають ДНК-полімеразу та нуклеотиди. Встановлюють температуру, оптимальну для функціонування ДНК-полімерази. У цих умовах, у разі комплементарное ™ ДНК гена і праймера, відбувається приєднання нуклеотидів до З'-кінців праймерів, в результате чого синтезуються дві копії гена. Після цього цикл повторюється знову, при цьому колічество ДНК гена буде збільшуватися кожного разу вдвічі. Проводять реакцію в спеціальних приладах - ампліфікатора. ПЛР застосовується для діагностики вірусних і бактеріальних інфекцій. Рестрикційний аналіз. Даний метод заснований на застосуванні фер-ментів, що носять назву рестриктаз. Рестріктази являють собою ендонук-ЛЕАЗ, які розщеплюють молекули ДНК, розриваючи фосфатні зв'язки не в довільних місцях, а в певних послідовностях нуклеотидів. Особливе значення для методів мо-молекулярної генетики мають рестріктази, кото риє дізнаються послідовності, що володіють центральної симетрією і зчитувати однаково в обидві сторони від осі симетрії. Точка розриву ДНК може або збігатися з віссю симетрії, або бути зрушена относітельно неї. В даний час з різних бактерій виділено та очищено більше 175 різних рестриктаз, для яких відомі сайти (ділянки) впізнавання (рестрикції). Виявлено понад 80 різних типів сайтів, в яких може проісходіть розрив подвійної спіралі ДНК. У геномі конкретної таксономической едініци знаходиться строго певний (генетіческі задетермінірованное) число ділянок впізнавання для певної рестріктази. Якщо виділену з конкретного мікроба ДНК обробити певної рестриктазой, то це призведе до утворення суворо определенного кількості фрагментів ДНК фіксірованного розміру. Розмір кожного типу фрагментів можна дізнатися за допомогою електрофорезу в агарозному гелі: дрібні фрагменти переміщуються в гелі швидше, ніж більші фрагменти, і довжина їх пробігу більше. Гель окрашівают бромистим етидієм і фотографують в УФ-випромінюванні. Таким чином можна получіть рестрикційну карту певного виду мікробів. Зіставляючи карти рестрикції ДНК, виделенних з різних штамів, можна определіть їх генетичну спорідненість, виявити приналежність до певного виду чи роду, а також виявити ділянки, подвергнутие мутацій. Цей метод використовується також як начальний етап методу визначення последовательності нуклеотидних пар (секвенування) і методу молекулярної гібридизації. Метод молекулярної гібридизації дозволяє виявити ступінь подібності разлічних ДНК. Застосовується при ідентіфікаціі мікробів для визначення їх точного таксономічного положення. Метод заснований на здатності двухцепочечной ДНК при підвищеній температурі (90 ° С) в лужному середовищі денатурувати, т. Е. Розплітатися на дві нитки, а при зниженні температури на 10 ° С знову відновлювати вихідну двухцепочечную структуру. Метод вимагає наявності молекулярного зонда. Зондом називається одноцепочечная молекула нуклеїнової кислоти, мічена радіоактівнимі нуклідами, з якою порівнюють досліджувану ДНК. Для проведення молекулярної гібридизації досліджувану ДНК розплітає зазначеним вище способом, одну нитку фіксують на спеціальному фільтрі, який потім поміщають в розчин, содержащій радіоактивний зонд. Створюються условія, сприятливі для утворення подвійних спіралей. У разі наявності комплементарності між зондом і досліджуваної ДНК, вони образуют між собою подвійну спіраль. Ріботіпірованіе і опосередкована транскрипцією ампліфікація рибосомальної РНК. Послідовність нуклеотидних основаній в опероном, що кодують рРНК, отлічается консервативністю, властивою каждомувіду бактерій. Ці Оперон представлені на бактеріальної хромосомі в декількох копіях. Фрагменти ДНК, отримані після обработкі її рестриктазами, містять послідовно-сті генів рРНК, які можуть бути виявлені методом молекулярної гібрідізаціі з міченої рРНК відповідного види бактерій. Кількість і локалізація копій оперонов рРНК і рестрикційний складу сайтів як всередині рРНК-оперона, так і за його флангах варіюють у різних види бактерій. На основі цієї властивості побудований метод ріботіпірованія, який дозволяє проводити моніторинг виділених штаммов і визначення їх виду. В даний время ріботіпірованіе проводиться в автоматіческом режимі в спеціальних приладах. Опосередкована транскрипцією ампліфікація рРНК використовується для діагностики смешанних інфекцій. Цей метод заснований на виявленні за допомогою молекулярної гібрідізаціі ампліфікованих рРНК, спеціфічних для певного виду бактерій. Дослідження проводиться в три етапи: 1. Ампліфікація пулу рРНК на матриці виделенной з досліджуваного матеріалу ДНК за допомогою ДНК-залежної РНК-полімерази. 2. Гібридизація накопиченого пулу рРНК з комплементарними видоспецифічні рРНК олігонуклеотидами, міченими флюорохромом або ферментами. 3. Визначення продуктів гібридизації методами денситометрії, імуноферментн-ного аналізу (ІФА). Реакція проводиться в автоматичному режіме в установках, в яких одномоментне визначення рРНК, що належать разлічним видам бактерій, досягається разделеніем ампліфікованого пулу рРНК на кілька проб, в які вносяться комплементарние видоспецифічні рРНК мечение олігонуклеотиди для гібридизації. |
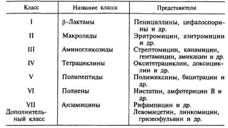
№ 42 Антибіотики. Природні і синтетичні. Історія відкриття природних антибіотиків. Класифікація антібіотіков за хімічною структурою, механізмом, спектру і типом дії. Способи отримання. Антибіотики - хіміотерапевтичні речовини, які продукують мікроорганізмами, тваринами клітинами, рослинами, а також їх похідні та синтетичні продукти, які мають виборчої способностью пригнічувати і затримувати ріст мікроорганізмів, а також пригнічувати розвиток злоякісних новоутворень. За той період, який пройшов з часу відкриття П. Ерліха, було отримано більше 10 000 різних антибіотиків, по важливою проблемою була систематизація цих препаратов. В даний час існують різні класифікації антибіотиків, проте жодна з них не є общепрінятой. В основу головної класифікації антибіотиків покладено їх хімічну будову. Найбільш важливими класами синтетичних антибіотиків являются хінолони та фторхінолони (наприклад, ципрофлоксацин), сульфаніламіди (сульфадиметоксин), імідазоли (метронідазол), нітрофурани (фурадонін, фурагін). За спектром дії антибіотики поділяють на п'ять груп в завісімості від того, на які мікроорганізми вони надають воздействіе. Крім того, існують протипухлинні антібіотікі, продуцентами яких також є актиноміцети. Каждая з цих груп включає дві підгрупи: антибіотики шірокого і вузького спектру дії. Антибактеріальні антибіотики складають найчисленнішу групу препаратів. Переважають у ній антібіотікі широкого спектру дії, що роблять вплив на представників усіх трьох відділів бактерій. До антибіотиків широкого спектру дії відносяться аміноглікозиди, тетрациклін та ін. Антибіотики вузького спектра дії еффектівни відносно невеликого кола бактерій, наприклад політ-міксини діють на грацілікутние, ванкоміцин впливає на грампозитивні бактерії. В окремі групи виділяють протитуберкульозні, протилепрозні, протисифілітичні препарати. Протигрибкові антибіотики включають значітельно менше число препаратів. Широким спектром дії обладает, наприклад, амфотерицин В, ефективний при кандидозах, бластомікоз, аспергільоз; в той же час ністатин, действующій на гриби роду Candida, є антибіотиком узкого спектру дії. Антипротозойні і антивірусні антибіотики насчітивают невелике число препаратів. Протипухлинні антибіотики представлені препаратамі, що володіють цитотоксичною дією. Більшість з них застосовують при багатьох видах пухлин, наприклад МіТОМ-цин С. Дію антибіотиків на мікроорганізми пов'язано з їх способностью придушувати ті чи інші біохімічні реакції, проісходящіе в мікробної клітині. Залежно від механізму действія розрізняють п'ять груп антибіотиків: 1. антибіотики, які порушують синтез клітинної стінки. До цієї групи відносяться, наприклад, β -лактами. Препарати цієї группи характеризуються найвищою вибірковістю действія: вони вбивають бактерії і не роблять впливу на клеткі мікроорганізму, так як останні не мають головного компонента клітинної стінки бактерій - пептидогликана. У зв'язку з цим β лактамні антибіотики є найменш токсичними для макроорганізму; 2. антибіотики, що порушують молекулярну організацію і синтез клітинних мембран. Прикладами подобних препаратів є поліміксини, поліени; 3. антибіотики, які порушують синтез білка; це найбільш численна група препаратів. Представниками цієї групи є аміноглікозиди, тетрацикліни, макролі-ди, левоміцетин, що викликають порушення синтезу білка на різних рівнях; 4. антибіотики - інгібітори синтезу нуклеїнових кислот. Наприклад, хінолони порушують синтез ДНК, рифампіцин - синтез РНК; 5. антибіотики, що пригнічують синтез пуринів і амінокислот. До цієї групи відносяться, наприклад, сульфаніламіди. Джерела антибіотиків. Основними продуцентами природних антібіотіков є мікроорганізми, ко торие, перебуваючи у своєму природному середовищі (в основному, в грунті), синтезують антібіотікі в якості засобу виживання в боротьбі за існування. Тваринні і рослинні клітини також можуть виробляти некоторие речовини з селективним антимікробну дію (наприклад, фітонциди), проте широкого застосування в медицині як продуцентів антибіотиків вони не отримали. Таким чином, основними джерелами отримання природних і напівсинтетичних антибіотиків стали: • Актиноміцети (особливо стрептоміцети) - розгалужені бактерії. Вони сінтезіруют більшість природних антибіотиків (80%). • Пліснява - синтезують пріродние бета-лактами (гриби роду Cephalosporium і Penicillium) H фузидієвої кислоту. • Типові бактерії - наприклад, еубактеріі, бацили, псевдомонади - продукують бацитрацин, поліміксини та інші речовини, що володіють антибактеріальною дією. Способи отримання. Існує три основних способи полученія антибіотиків: • біологічний синтез (так отримують пріродние антибіотики - натуральні продукти ферментації, коли в оптимальних условіях культивують мікроби-продуценти, які виділяють антибіотики в процесі своєї життєдіяльності); • біосинтез з подальшими хімічними модифікаціями (так створюють полусінтетіческіе антибіотики). Спочатку шляхом біосинтезу отримують природний антибіотик, а потім його первісну молекулу видозмінюють шляхом хімічних модифікацій, наприклад присівши-единящей певні радикали, внаслідок чого поліпшуються протимікробні і фармакологіческіе характеристики препарату; • хімічний синтез (так отримують сінтетіческіе аналоги природних антибіотиків, наприклад хлорамфенікол / левоміцетин). Це речовини, які мають таку ж структуру, | № 43 Ускладнення антибіотикотерапії, їх попередження. Як і всякі лікарські засоби, практично кожна група антимікробних хіміопрепаратів може надавати побічна дія, причому і на макроорганізм, і на мікроби, і на інші лікарські засоби. Ускладнення з боку макроорганізму Найбільш частими ускладненнями антімікробной хіміотерапії є: Токсична дія препаратів. Як правило, розвиток цього ускладнення залежить від властивостей самого препарату, його дози, способу введення, стану хворого і проявляється тільки при тривалому і сістематіческом застосуванні антимікробних хіміотерапевтичних препаратів, коли создаются умови для їх накопичення в організмі. Особливо часто такі ускладнення бувають, коли мішенню дії препарату є процеси або структури, близькі за складом або будовою до аналогічних структурам клеток макроорганізму. Токсичній дії антимікробних препаратів особливо подвер-дружини діти, вагітні, а також пацієнти з порушенням функцій печінки, нирок. Побічна токсичний вплив може проявляться як нейротоксическое (наприклад, глікопептиди і аміноглікозиди надають ототоксичну дію, аж до повної втрати слуху за рахунок впливу на слуховий нерв); нефротоксическое (поліени, поліпептиди, аміноглікозиди, макроліди, глікопептиди, сульфаніламіди); общетоксическое (протівогрібковие препарати - поліени, імідазоли); пригнічення кровотворення (тетрациклін, сульфаніламіди, левоміцетин / хлорамфенікол, який містить нітробензен - супресор функції кісткового мозку); тератогенное [аміноглікозіди, тетрациклін порушують розвиток кісток, хрящів у плода і дітей, формірованіе зубної емалі (коричневе забарвлення зубів), левоміцетин / хлорамфенікол токсичний для новорожденних, у яких ферменти печінки не повністю сформовані («синдром сірого дитини» ), хінолони - діють на развівающуюся хрящову і сполучну тканини]. Попередження ускладнень полягає в отказе від протипоказаних даному пацієнтові препаратів, контролі за станом функцій печінки, нирок і т. П. Дисбіоз (дисбактеріоз). Антимікробні хіміопрепарати, особенно широкого спектра, можуть впливати не тільки на збудників інфекцій, але і на чутливі мікроорганізми нормальной мікрофлори. В результаті формується дисбиоз, тому порушуються функції шлунково-кишкового тракту, виникає авітаміноз і може розвинутися вторічная інфекція (в тому числі ендогенна, наприклад кандидоз, псевдомембранозний коліт). Попередження наслідків такого роду ускладнень полягає в призначенні, по можливості, препаратів вузького спектра дії, поєднанні лікування основного захворювання з протигрибкової терапією (наприклад, призначенням ністатину), вітамінотерапія, застосуванням еубіотиків і т. П. Негативний вплив на імунну систему. До цієї групи ускладнень относят насамперед алергічні реакції. Причинами розвитку гіперчутливості може бути сам препарат, продукти його распада, а також комплекс препарату з сивороточнимі білками. Виникнення такого роду ускладнень залежить від властивостей самого пре-Параті, від способу і кратності його введення, індивідуальної чутливості пацієнта до препарату. Алергічні реакції роз-вають приблизно в 10% випадків і проявляются у вигляді висипу, свербежу, кропив'янки, набряку Квінке. Відносно рідко зустрічається такая важка форма прояви алергії, як анафілактичний шок. Таке ускладнення частіше дають бета-лактами (пеніциліни), рифаміцин. Сульфаніламіди можуть викликати гіперчутливість уповільненого типу. Попередження ускладнень полягає в тщательном зборі аллергоанамнеза і призначенні препаратів відповідно до індивідуальної чутливістю пацієнта. Крім того, антибіотики мають деяким імунодепресивноюдією і можуть способствовать розвитку вторинного імунодефіциту і ослаблення напруженості імунітету. Ендотоксичний шок (терапевтичний). Це явище, яке виникає при леченіі інфекцій, спричинених грамнегативними бактеріями. Введення антибіотиків викликає загибель і руйнування клітин і висвобожденіе великих кількостей ендотоксіна. Це закономірне явище, яке сопровождается тимчасовим погіршенням клініческого стану хворого. Взаємодія з іншими препаратами. Антибіотики можуть сприяти потенцірованію дії або інактивації інших препаратів (наприклад, еритроміцин стімулірует вироблення ферментів печінки, які починають прискорено метаболизировать лекарственние кошти різного призначення). Побічна дія на мікроорганізми. Застосування антимікробних хіміопрепа-ратов робить на мікроби не тільки прямий пригнічуючий або згубний вплив, але також може привести до формування атіпічних форм мікробів (наприклад, до образованію L-форм бактерій або зміни інших властивостей мікробів, що значно ускладнює діагностику інфекційних забо леваній) і персистуючих форм мікробів. Широке використання антимікробних лекарственних коштів веде також до формірованію антібіотікозавісімості (рідко) і лікарської стійкості - антибіотикорезистентності (досить часто). | |
|
№ 41 Поняття про хіміотерапії. Історія відкриття хіміопрепаратів. Хіміотерапія - специфічне антимікробну, антіпаразітарное лікування за допомогою хімічних речовин. Ці речовини обладают найважливішим властивістю - вибірковістю дії проти хвороботворних мікроорганізмів в умовах макроорганізму. Основоположником хіміотерапії є німецький хімік, лауреат Нобелівської премії П. Ерліх, який встановив, що хімічні речовини, що містять миш'як, згубно действуют на спірохети і тріпаносоми, і отримав в 1910 р перший хіміотерапевтичний препарат - сальварсан (з'єднання мишьяка, що вбиває збудника, але нешкідливе для мікроорганізма). У 1935 р інший німецький хімік Г. Домагк виявив серед анілінових барвників речовина - пронтозил, або червоний стрептоцид, який рятував експериментальних тварин від стрепто-кокковой інфекції, але не діючий на ці бактерії поза організмом. За це відкриття Г. Домагк був удостоєний Нобелевской премії. Пізніше було з'ясовано, що в організмі проісходіт розпад пронтозила з утворенням сульфаниламида, обладающего антибактеріальну активність як in vivo, так і in vitro. Механізм дії сульфаніламідів (сульфонамидов) на мікроорганізми був відкритий Р. Вудсом, що встановив, що суль-фаніламіди є структурними аналогами параамінобензойної кислоти (ПАБК), що бере участь в біосинтезі фолієвої кислоти, необхідної для життєдіяльності бактерій. Бактеріі, використовуючи сульфаніламід замість ПАБК, гинуть. Перший природний антибіотик було відкрито в 1929 р англійскім бактеріологом А. Флемінгом. При вивченні цвілевого гріба Penicillium notatum, що перешкоджає зростанню бактеріальної культури, А. Флемінг виявив речовину, що затримує ріст бактерій, і назвав його пеніциліном. У 1940 р Г. Флорі і Е. Чейн отримали очищений пеніцилін. У 1945 р А Флемінг, Г. Флорі і Е. Чейн стали Нобелівськими лауреатами. В даний час є величезна кількість хіміотерапевтичних препаратів, які застосовуються для лікування заболеваній, викликаних різними мікроорганізмами. | |||
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|