- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
МЕТОДЫ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ 3 страница
|
№ 16 Повреждение клетки: характеристика понятия; основные причины и типовые механизмы повреждения клетки. ПОВРЕЖДЕНИЕ КЛЕТКИ - такие изменения её структуры, метаболизма, физико-химических свойств и функции, которые ведут к нарушению жизнедеятельности. Причины повреждения. Повреждение клетки — результат воздействия на неё множества патогенных агентов. Причины повреждения клетки классифицируют по природе патогенных факторов, их происхождению и эффектам. Природа повреждающего фактора может быть физической, химической и биологической. ФИЗИЧЕСКИЕ ФАКТОРЫ ПОВРЕЖДЕНИЯ Наиболее частыми причинами повреждения клетки физической природы являются механические, температурные, осмотические, свободнорадикальные (избыток свободных радикалов и продуктов активации липопероксидных процессов повреждает мембраны и денатурирует белки). Патогенное действие на клетку могут оказывать также ионизирующая радиация, электромагнитные факторы и другие агенты физического характера. К механически повреждающим факторам относятся удары, растяжения (например, при перерастяжении мышечной ткани или органов), сдавление (в частности, опухолью, гематомой, рубцом, экссудатом), гравитационные перегрузки и др. Колебания температуры. Повышение температуры среды, окружающей клетку, до 40—50 °С и выше может привести к денатурации белка, нуклеиновых кислот, декомпозиции ЛП, повышению проницаемости клеточных мембран и другим изменениям. Значительное снижение температуры существенно замедляет или прекращает внутриклеточные метаболические процессы и может привести к кристаллизации внутриклеточной жидкости и разрьюам мембран, что означает гибель клетки. Изменения осмотического давления. Гиперосмия может развиться вследствие накопления в клетке продуктов неполного окисления органических субстратов или избытка ионов. Последнее, как правило, сопровождается поступлением в клетку воды по градиенту осмотического давления, набуханием клетки и растяжением (вплоть до разрыва) плазмолеммы и мембран органелл. Снижение внутриклеточного осмотического давления или повышение его во внеклеточной среде приводит к потере клеточной жидкости, сморщиванию (пикнозу) и нередко — к гибели клетки. ХИМИЧЕСКИЕ ФАКТОРЫ ПОВРЕЖДЕНИЯ К ним относятся органические и неорганические кислоты и щёлочи, соли тяжёлых металлов, цитотоксические соединения и ЛС. Повреждение клетки может возникать как при избытке, так и при дефиците одного и того же агента. Цитотоксические соединения. Классические примеры цитотоксических соединений — ингибиторы ферментов. Так, цианиды подавляют активность цитохромоксидазы; этанол и его метаболиты ингибируют многие ферменты клетки; вещества, содержащие соли мышьяка, угнетают пируватоксидазу. Лекарственные средства. Неправильное применение ЛС (чаще в виде передозировки) может привести к повреждению клеток. БИОЛОГИЧЕСКИЕ ФАКТОРЫ ПОВРЕЖДЕНИЯ К ним относят главным образом инфекционные агенты и цитотоксические факторы системы ИБН. Инфекционные агенты (вирусы, риккетсии, микробы, гельминты, грибы, при-оны) как сами по себе, так и в виде продуктов их жизнедеятельности или деградации вызывают расстройства функций клетки, нарушают течение в ней метаболических реакций, проницаемость или даже целостность мембран, подавляют активность клеточных ферментов. К цитотоксическим факторам системы ИБН относятся эндо- и экзотоксины, аутоагрессивные Т-лимфоциты, в ряде случаев — AT (например, при явлениях молекулярной мимикрии). ГЕНЕЗ ПОВРЕЖДАЮЩИХ ФАКТОРОВ Причины повреждения клеток классифицируют в зависимости от их происхождения на экзогенные или эндогенные, инфекционные или неинфекционные. Экзогенными факторами повреждения являются физические воздействия (механические травмы, электрический ток, тепло, холод), химические агенты (кислоты, щёлочи, этанол, сильные окислители) и биологические факторы (вирусы, риккетсии, бактерии, гельминты и др. ). К эндогенным факторам повреждения относятся агенты физической природы, химические факторы, факторы биологической природы. Примерами инфекционно-паразитарных факторов могут быть эндо- и экзотоксины микроорганизмов, много- и одноклеточные паразиты. К факторам неинфекционного генеза относятся агенты физической, химической или биологической (но неинфекционной) природы. ЭФФЕКТЫ ПОВРЕЖДАЮЩИХ ФАКТОРОВ Действие повреждающих факторов на клетки осуществляется прямо (первичные факторы повреждения) или опосредованно. В последнем случае речь идет о формировании цепи вторичных реакций, реализующих повреждающее влияние так называемых первичных патогенных факторов. Общие механизмы повреждения. Расстройства энергетического обеспечения клетки: Снижение интенсивности и/или эффективности ресинтеза АТФ, Нарушение транспорта энергии АТФ, Нарушение использования энергии АТФ. Повреждение мембран и ферментов клетки: Чрезмерная интенсификация свободнорадикальных реакций и СПОЛ, Значительная активация гидролаз, Внедрение амфифильных соединений в липидную фазу мембран и их детергентное действие, Торможение ресинтеза повреждённых компонентов мембран и/или синтеза их de novo, Нарушение конформации макромолекул белка, ЛП, фосфолипидов, Перерастяжение и разрыв мембран набухших клеток и/или их органелл. Дисбаланс ионов и воды в клетке: Изменение соотношения отдельных ионов в цитозоле, Нарушение трансмембранного соотношения ионов, Гипергидратация клеток, Гипогидратация клеток, Нарушения электрогенеза. Нарушения в геноме и/или механизмов экспрессии генов: Мутации, Дерепрессия патогенных генов, Репрессия жизненно важных генов, Трансфекция (внедрение в геном чужеродной ДНК), Дефекты транскрипции, процессинга, трансляции, посттрансляционной модификации, Дефекты репликации и репарации, Нарушение митоза и мейоза Расстройства регуляции функций клеток: Рецепции регулирующих факторов, Образования вторых посредников, Регуляции метаболических процессов в клетке |
№ 17 Типовые формы патологии клеток: виды, основные причины, механизмы развития, проявления, последствия. Дистрофии. Клеточные дистрофии — нарушения обмена веществ, сопровождающиеся расстройством функций клеток, пластических процессов в них, а также структурными изменениями, ведущими к нарушению жизнедеятельности клеток. Механизмы дистрофий разнообразны. К числу ведущих относятся следующие: • синтез аномальных, в норме не встречающихся в клетке, веществ (например, белково-полисахаридного комплекса — амилоида); • избыточное превращение одних соединений в другие (например, жиров и углеводов в белки, углеводов в жиры); • декомпозиция (фанероз): распад субклеточных структур и/или веществ (например, белково-липидных комплексов мембран); • инфильтрация клеток и межклеточного вещества органическими и неорганическими соединениями (например, ЛПНП и Са2+ клеток интимы артерий при атеросклерозе). Виды клеточных дистрофий.
Основным критерием классификации клеточных дистрофий является преимущественное нарушение метаболизма отдельных классов веществ. Согласно этому, различают диспротеинозы (белковые дистрофии), липидозы (жировые дистрофии), диспигментозы (пигментные дистрофии), углеводные и минеральные дистрофии. Отдельную группу составляют тезаурисмозы (болезни накопления). ДИСПРОТЕИНОЗЫ Для белковых дистрофий характерно изменение физико-химических свойств клеточных белков и как следствие — нарушение их ферментативной и структурной функций. Различают зернистую, гиалиново-капельную и гидропичес-кую дистрофии. Эти разновидности диспротеинозов — последовательные этапы нарушений обмена белков, приводящие к некрозу клеток. Чаще диспротеинозы являются приобретёнными (вторичными). Реже встречаются первичные (наследуемые и врождённые) их варианты. Обычно эти последние — результат ферментопатий и обусловлены нарушениями обмена аминокислот, например цистеина (цистиноз), фенилпировиноградной кислоты (фе-нилкетонурия), тирозина (тирозиноз) и некоторых других. ЛИПИДОЗЫ К липидам относят различные по химическому составу гидрофобные вещества. Для липидозов (жировых дистрофий) характерно увеличение содержания внутриклеточных липидов, появление липидов в клетках, где они в норме отсутствуют, а также образование липидов аномального химического состава. Различают липидозы первичные (наблюдаются, как правило, при ферментопа-тиях: ганглиозиддипидоз, цереброзидлипидоз, сфингомиелинлипидоз и др. ) и вторичные (вызванные различными патогенными факторами: этанолом, соединениями фосфора, четырёххлористым углеродом, некоторыми ЛС — цито-статиками, антибиотиками, барбитуратами и др. ). Вторичные липидозы, подобно диспротеинозам, наиболее часто выявляются в клетках миокарда, печени, почек, мозга и носят соответствующие названия (жировая дистрофия сердца, печени, почек, мозга). УГЛЕВОДНЫЕ ДИСТРОФИИ Углеводные дистрофии характеризуются нарушениями обмена полисахаридов (гликогена, мукополисахаридов) и гликопротеинов (муцина, мукоидов). ДИСПИГМЕНТОЗЫ Клеточные пигменты — хромопротеиды — соединения, состоящие из белка и хромофора. Виды пигментов: гемоглобиногенные, или железозависимые; протеиногенные, или тирозиногенные; липидогенные, или липопротеиногенные. Виды диспигментозов. Пигментные дистрофии (диспигментозы) классифицируют в зависимости от их происхождения, механизма развития, структуры пигмента, проявлений и распространённости. МИНЕРАЛЬНЫЕ ДИСТРОФИИ Из минеральных дистрофий наибольшее значение имеют нарушения обмена кальция, калия, железа, цинка, меди в виде отложения солей этих химических элементов. ТЕЗАУРИСМОЗЫ Тезаурисмозы (болезни накопления) — накопление избытка различных веществ в клетках, что сопровождается нарушением их структуры и функции, а также интенсивности и характера метаболических и пластических клеточных процессов. Практически все тезаурисмозы — результат наследственных ферментопатий, передающихся, как правило, по аутосомно-рецессивному типу. В отдельные группы принято выделять болезни накопления лизосомные и пероксисомные. В зависимости от типа накапливающихся веществ тезаурисмозы подразделяют на липидные (липидозы), гликогеновые (гликогенозы), аминокислотные, нуклеопротеиновые, мукополисахаридные (мукополисахаридозы), муколипидные (муколипидозы). Наиболее распространёнными разновидностями тезаурисмозов являются липидные и гликогеновые. Дисплазии. ДИСПЛАЗИИ - нарушения дифференцировки клеток, сопровождающиеся стойкими изменениями их структуры, метаболизма и функции, ведущими к нарушению их жизнедеятельности Дифференцировка клеток определяется генетической программой, но реализация этой программы в существенней мере зависит от сложных взаимодействий ядра и цитоплазмы, микроокружения клетки, влияния на клетку БАВ и многих других факторов. Именно поэтому даже при одном и том же отклонении в геноме различных клеток проявления дисплазии могут носить «разноликий» характер. Среди дисплазии выделяют метаплазии, характеризующиеся замещением в конкретном органе характерных для него клеток клетками другого типа. Существенно, что клеточные дисплазии лежат в основе опухолевого роста и в клинической практике рассматриваются как предраковые состояния. Как правило, при дисплазиях клетки увеличены в размерах, имеют неправильную, причудливую форму («клетки-монстры»), соотношение различных орга-нелл в них диспропорционально. Нередко в таких клетках обнаруживаются различные включения и признаки дистрофических процессов. | № 18 Гибель клеток: некроз и апоптоз, их виды, причины, стадии, механизмы развития, различие и значение. Известно два качественно различных варианта смерти клеток: некроз и апоптоз. НЕКРОЗ Некроз — собственно смерть повреждённой клетки, сопровождающаяся необратимым прекращением её жизнедеятельности. Некроз является завершающим этапом клеточных дистрофий или следствием прямого действия на клетку повреждающих факторов значительной (разрушающей) силы. Некроз, как правило, сопровождается воспалительной реакцией. Паранекроз и некробиоз. Некрозу предшествуют паранекроз (метаболические и структурные изменения ещё обратимы) и некробиоз. На этапе некробиоза патогенные изменения приобретают необратимый характер и приводят к некрозу. Основные звенья патогенеза некроза те же, что и при повреждении клеток, но при развитии некроза они максимально интенсифицированы и развиваются на фоне недостаточности адаптивных механизмов (защиты и регенерации повреждённых структур, компенсации нарушенных процессов в клетке). Лизис и аутолиз. Некротизированные клетки подвергаются деструкции (лизис) при помощи лизосомных ферментов и свободных радикалов. • Гидролиз внутриклеточных компонентов и межклеточного вещества происходит под влиянием ферментов лизосом альтерированных клеток. Высвобождению лизосомных ферментов способствует развитие внутриклеточного ацидоза. • Деструкция повреждённых компонентов клеток осуществляется при участии активных форм кислорода и свободных радикалов. Известны факты интенсификации свободнорадикальных и липопероксидных реакций при остром воспалении, механическом повреждении, на определённых этапах инфаркта (частной формы некроза, развивающегося вследствие нарушения кровоснабжения ткани), опухолевого роста (сопровождается гибелью большого числа как злокачественных, так и окружающих нормальных клеток) и других патологических процессах. Эти два механизма обеспечивают саморазрушение структур клетки (аутолиз). Разрушение повреждённых и некротизированных клеток происходит и при участии других клеток — фагоцитов, а также микроорганизмов. В отличие от аутолитического распада, последний механизм обозначают как гетеролитический. АПОПТОЗ Апоптоз является другим вариантом гибели клеток. АПОПТОЗ - форма гибели отдельных клеток, возникающая под действием вне- или внутриклеточных факторов, осуществляющаяся путём активации специализированных внутриклеточных процессов, регулируемых определёнными генами. Таким образом, апоптоз — программированная гибель клетки. В этом его принципиальное отличие от некроза. Другое принципиальное отличие апоптоза от некроза состоит в том, что программу апоптоза запускает информационный сигнал, тогда как некроз клетки развивается под влиянием повреждающего агента. В финале некроза происходит лизис клетки и освобождение её содержимого в межклеточное пространство, тогда как апоптоз завершается фагоцитозом фрагментов разрушенной клетки. Некроз — всегда патология, тогда как апоптоз наблюдается в ходе многих естественных процессов, а также при адаптации клетки к повреждающим факторам. Апоптоз — в отличие от некроза — энергозависим и требует синтеза РНК и белков. Примеры апоптоза. Запрограммированная гибель клеток; Гибедь клеток, выполнивших свою функцию; Дегенерация; Ликвидация аутоагрессивных Т-клеток; Старение; Трансфекция; Повреждение клетки; Опухолевый рост. Механизм апоптоза. При реализации апоптоза условно можно выделить четыре стадии. Стадия инициации. На этой стадии информационные сигналы рецептируются клеткой. Патогенный агент либо сам является сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регулятор-ным структурам и молекулам. Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоп-тозу путём активации исполнительной программы (её эффекторами являются цистеиновые протеазы — каспазы и эндонуклеазы), либо блокируют потенциально летальный сигнал. Стадия реализации программы. Стадия реализации программы апоптоза (исполнительная, эффекторная) состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов. Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство, а при апоптозе отсутствует воспалительная реакция. Этот признак отличает апоптоз от некроза, который сопровождается развитием перинекротического воспаления. | |
|
№ 19 Адаптивные процессы в клетке при действии на них повреждающих агентов. Методы повышения устойчивости клеток к повреждению. Действие на клетку патогенных факторов сопровождается активацией (или включением) различных реакций и процессов, направленных на устранение либо уменьшение степени повреждения и его последствий, а также обеспечивающих устойчивость клеток к повреждению. ХАРАКТЕР ПОВРЕЖДЕНИЙ КЛЕТОК Любое повреждение клетки вызывает в ней разной степени выраженности специфические и неспецифические изменения Специфические изменения клеток при повреждении Специфические изменения клеток при повреждении характерны для данного патогенного фактора при действии его на различные клетки. • Осмотическое давление. Повышение осмотического давления в клетке сопровождается её гипергидратацией, растяжением мембран и нарушением их целостности. • Разобщители. Под влиянием разобщителей окисления и фосфорилирования снижается или блокируется сопряжение этих процессов и уменьшается эффективность биологического окисления. • Гиперальдостеронемия. Повышенное содержание в крови гормона коры надпочечников — альдостерона ведёт к накоплению в клетке Na+. Действие различных повреждающих агентов на определённые виды клеток вызывает специфические для этих клеток изменения. Неспецифические изменения клеток при повреждении Неспецифические (стереотипные, стандартные) изменения в клетках находят при альтерации различных видов клеток и действии на них широкого спектра патогенных агентов: гипоксии; ацидоза; чрезмерной активации свободнорадикальных и перекисных реакций; денатурации молекул белка; повышения проницаемости клеточных мембран; дисбаланса ионов и воды. Выявление конкретного спектра выраженных в разной мере специфических и неспецифических изменений в клетках органов и тканей даёт возможность судить о характере и силе действия патогенного фактора, о степени и масштабе повреждения, а также об эффективности (или неэффективности) применяемых для лечения медикаментозных и немедикаментозных средств. Механизмы адаптации клеток к повреждению Комплекс адаптивных реакций клеток условно подразделяют на внутриклеточные и межклеточные, или системные. К внутриклеточным адаптивным механизмам относятся следующие реакционные процессы: компенсация нарушений энергетического обеспечения клетки; защита мембран и ферментов клетки; уменьшение выраженности или устранение дисбаланса ионов и воды в клетке; устранение дефектов генетической программы клетки и механизмов её реализации; компенсация расстройств механизмов регуляции внутриклеточных процессов; снижение функциональной активности клеток; регенерация; гипертрофия; гиперплазия. Для межклеточных (системных) механизмов адаптации к повреждению характерно взаимодействие клеток друг с другом. Такое взаимодействие осуществляется несколькими путями: Обмен метаболитами, местными БАВ — цитокинами, ионами; Реализация реакций системы ИБН; Изменения лимфо- и кровообращения; Эндокринные влияния; Нервные воздействия. Повышение устойчивости к повреждению.
ПРОФИЛАКТИЧЕСКИЕ И ЛЕЧЕБНЫЕ МЕРОПРИЯТИЯ Агенты, имеющие целью защиту интактных клеток от повреждения (профилактические) или стимуляцию адаптивных механизмов при их альтерации (лечебные), подразделяют на немедикаментозные, медикаментозные и комбинированные. Немедикаментозные агенты. Немедикаментозные средства применяют главным образом с целью профилактики повреждения клетки. Немедикаментозные средства повышают устойчивость клеток органов и тканей, а также организма в целом к ряду патогенных агентов. Медикаментозные средства. Лекарственные средства (ЛС) применяют в основном для активации адаптивных механизмов после воздействия патогенного агента. Большинство ЛС применяется с целью этиотропной или патогенетической терапии. Комбинированные воздействия. Комбинированные воздействия дают наибольший эффект, как лечебный, так и профилактический. Этиотропные, саногенетические и патогенетические воздействия Этиотропные воздействия направлены на устранение, прекращение, уменьшение силы и/или длительности действия патогенных факторов на клетки, а также на устранение условий, способствующих реализации этого действия. Саногенетические мероприятия имеют целью активацию адаптивных механизмов (компенсации, защиты, восстановления и приспособления клеток) к изменившимся условиям. Патогенетические воздействия направлены на разрыв звеньев механизма развития (патогенеза) патологического процесса. | № 20 Воспаление, характеристика понятия. Основные причины и патогенез. Компоненты механизма развития воспаления, их характеристика.
ВОСПАЛЕНИЕ - типовой патологический процесс; возникающий в ответ на действие патогенного фактора; характеризуется развитием как патологических, так и адаптивных реакций организма; направлен на локализацию, уничтожение и удаление из организма флогогенного фактора, а также на ликвидацию последствий его действия.
Причины.
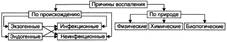 Природа флогогенного фактора. Природа флогогенного фактора может быть физической, химической и биологической.
Физические факторы. Наиболее частые физические факторы: механическая травма тканей, чрезмерно высокая или низкая температура, воздействие электрического тока или лучистой энергии, внедрение в ткань инородного тела и т. п.
Химические факторы: экзо- и эндогенные органические или неорганические кислоты и щелочи в высоких концентрациях; избыток в тканях органических соединений: продуктов метаболизма, экскретов, компонентов биологических жидкостей; ЛС, вводимые в ткани и др.
Биологические агенты— одна из наиболее распространённых причин воспаления: инфекционные; иммуноаллергические; токсины насекомых, животных, растений.
Генез флогогенного фактора
В зависимости от происхождения флогогенные факторы подразделяют на экзогенные и эндогенные. В свою очередь, в каждой из этих групп выделяют инфекционные и неинфекционные агенты.
Экзогенные воспалительные факторы. Биологические агенты, инфекционно-паразитарные возбудители, токсины и яды растений, насекомых и животных. Чужеродная плазма, сыворотка или цельная кровь; взвеси клеток; трансплантированные ткани или органы.
Эндогенные факторы. Биологические агенты (продукты деструкции повреждённых или погибших тканей, например, в результате их ушиба, ожога, отморожения или нарушения кровотока в них; активировавшаяся условно-патогенная микрофлора; иммуноаллергические комплексы Аг+АТ+комплемент и др. ).
Эндогенные химические агенты (в частности продукты нормального или нарушенного метаболизма, если они не выводятся из организма с экскретами).
Выраженность воспалительного эффектафлогогенных факторов зависит не только от его природы или происхождения, но и от интенсивности действия: чем она выше, тем, как правило, более остро протекает воспалительная реакция.
МЕХАНИЗМЫ РАЗВИТИЯ ВОСПАЛЕНИЯ
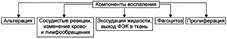
Закономерная динамика воспаления как типового патологического процесса определяется тем, что в основе его развития находится несколько общих и взаимосвязанных компонентов (например, альтерация, экссудация, фагоцитоз и пролиферация). Каждый из этих компонентов воспаления, в свою очередь, сложный динамический комплекс взаимозависимых реакций, процессов и факторов. Как правило, по ходу воспаления, преимущественно альтеративные изменения в очаге воспаления закономерно сменяются преимущественно экссудативными и далее — преимущественно пролиферативными фазами (стадиями) воспаления. Однако в большинстве случаев, особенно при значительной площади воспаления и/или при его хроническом течении, даже в соседних участках очага воспаления одновременно выявляются признаки различных компонентов воспалительной реакции — и альтерации, и экссудации, и пролиферации.
Принято выделять следующие компоненты воспаления: альтерация, сосудистые реакции и изменения крово- и лимфообращения, экссудация и эмиграция лейкоцитов, фагоцитоз, пролиферация.
Природа флогогенного фактора. Природа флогогенного фактора может быть физической, химической и биологической.
Физические факторы. Наиболее частые физические факторы: механическая травма тканей, чрезмерно высокая или низкая температура, воздействие электрического тока или лучистой энергии, внедрение в ткань инородного тела и т. п.
Химические факторы: экзо- и эндогенные органические или неорганические кислоты и щелочи в высоких концентрациях; избыток в тканях органических соединений: продуктов метаболизма, экскретов, компонентов биологических жидкостей; ЛС, вводимые в ткани и др.
Биологические агенты— одна из наиболее распространённых причин воспаления: инфекционные; иммуноаллергические; токсины насекомых, животных, растений.
Генез флогогенного фактора
В зависимости от происхождения флогогенные факторы подразделяют на экзогенные и эндогенные. В свою очередь, в каждой из этих групп выделяют инфекционные и неинфекционные агенты.
Экзогенные воспалительные факторы. Биологические агенты, инфекционно-паразитарные возбудители, токсины и яды растений, насекомых и животных. Чужеродная плазма, сыворотка или цельная кровь; взвеси клеток; трансплантированные ткани или органы.
Эндогенные факторы. Биологические агенты (продукты деструкции повреждённых или погибших тканей, например, в результате их ушиба, ожога, отморожения или нарушения кровотока в них; активировавшаяся условно-патогенная микрофлора; иммуноаллергические комплексы Аг+АТ+комплемент и др. ).
Эндогенные химические агенты (в частности продукты нормального или нарушенного метаболизма, если они не выводятся из организма с экскретами).
Выраженность воспалительного эффектафлогогенных факторов зависит не только от его природы или происхождения, но и от интенсивности действия: чем она выше, тем, как правило, более остро протекает воспалительная реакция.
МЕХАНИЗМЫ РАЗВИТИЯ ВОСПАЛЕНИЯ
Закономерная динамика воспаления как типового патологического процесса определяется тем, что в основе его развития находится несколько общих и взаимосвязанных компонентов (например, альтерация, экссудация, фагоцитоз и пролиферация). Каждый из этих компонентов воспаления, в свою очередь, сложный динамический комплекс взаимозависимых реакций, процессов и факторов. Как правило, по ходу воспаления, преимущественно альтеративные изменения в очаге воспаления закономерно сменяются преимущественно экссудативными и далее — преимущественно пролиферативными фазами (стадиями) воспаления. Однако в большинстве случаев, особенно при значительной площади воспаления и/или при его хроническом течении, даже в соседних участках очага воспаления одновременно выявляются признаки различных компонентов воспалительной реакции — и альтерации, и экссудации, и пролиферации.
Принято выделять следующие компоненты воспаления: альтерация, сосудистые реакции и изменения крово- и лимфообращения, экссудация и эмиграция лейкоцитов, фагоцитоз, пролиферация.
| № 21 Первичная и вторичная альтерация в очаге воспаления: причины возникновения, механизмы формирования, проявления, значение в развитии воспалительной реакции. Альтерация — первое и непосредственное следствие повреждающего действия флогогенного фактора и инициальное звено механизма развития воспаления. Альтерация, как первичная, так и вторичная, — сложный комплекс изменений разных сторон жизнедеятельности клеток. В очаге воспаления выделяют зоны первичной и вторичной альтерации. Зона первичной альтерации. Причина формирования: флогогенный фактор, действующий на ткань. Локализация: место прямого контакта причины воспаления с тканью (эта зона — эпицентр очага воспаления). Основные механизмы • Повреждение мембранных структур и внутриклеточных ферментов, а также структур межклеточного вещества. • Расстройства энергетического обеспечения функций и пластических процессов в повреждённой ткани. • Нарушения трансмембранного переноса и градиента ионов, соотношения их между собой, содержания жидкости внутри и за пределами клетки и в зоне альтерации в целом. Проявления • Расстройства функции повреждённых, но ещё жизнеспособных участков ткани вне зоны некроза. • Некроз. • Значительные физико-химические изменения. • Различные формы дистрофии. Зона вторичной альтерации Причины • Эффекты флогогенного агента (хотя за пределами эпицентра очага воспаления эффективность его патогенного воздействия значительно ниже). • Влияние факторов, вторично формирующихся в зоне первичной альтерации в связи с образованием медиаторов воспаления, развитием метаболических, физико-химических и дистрофических изменений. Локализация • Частично в месте контакта флогогенного агента с тканью (там, где сила его воздействия была минимальной). • В основном вокруг области первичной альтерации. Обычно площадь этой зоны значительно больше площади первичной. Механизмы развития • Расстройства местных механизмов нервной регуляции в связи с повреждением тел нейронов, нервных стволов и/или их окончаний, синтеза, накопления и высвобождения из них нейромедиаторов. • Нарушение выброса нейромедиаторов (норадреналина, ацетилхолина и др. ) из нервных терминалей симпатической и парасимпатической системы в очаге воспаления и стадийные изменения чувствительности тканей к нейромедиаторам в этом очаге. • Расстройства аксонного транспорта трофических и пластических факторов (углеводов, липидов, белков, адениннуклеотидов, нуклеиновых кислот, БАВ, ионов и других агентов) от тел нейронов к соматическим клеткам. • Стадийные изменения тонуса сосудов микроциркуляторного русла и в связи с этим — расстройства кровообращения • БАВ, поступающие в зону вторичной альтерации из зоны первичной альтерации, а также образующие за пределами очага воспаления. В совокупности эти изменения обусловливают расстройства обмена веществ, значительные физико-химические сдвиги в зоне вторичной альтерации, развитие различных видов дистрофий и даже некроза. Проявления • Изменения структуры клеток и межклеточного вещества тканей, обычно обратимые (например, признаки повреждения клеток, архитектуры ткани и др. ). • Расстройства метаболизма (выражается различными отклонениями в обмене веществ и развитии). • Умеренные отклонения физико-химических параметров (например, рН, осмоляльности жидкости, температуры тканей, трансмембранного распределения ионов). • Обратимые изменения функции тканей и органов |
|
№ 22 Изменения обмена веществ и физико-химические сдвиги в очаге воспаления: причины и механизмы возникновения; значение в развитии воспаления. ИЗМЕНЕНИЯ ОБМЕНА ВЕЩЕСТВ В очаге воспаления наблюдаются закономерные фазные изменения метаболизма. Их причины: действие флогогенного фактора и вторичные расстройства в ткани, выражающиеся в перестройке местных механизмов нервной и гуморальной регуляции, микроциркуляции, в формировании физико-химических сдвигов. На начальном этапе воспаления в ткани (зоны не только первичной, но и вторичной альтерации) преобладают реакции катаболизма, затем — при развитии артериальной гиперемии и активации процессов пролиферации, — как правило, начинают доминировать анаболические реакции. Углеводы. В очаге воспаления метаболизм углеводов претерпевает характерные изменения, выражающиеся в преобладании гликолиза и развитии ацидоза. Причины • Повреждения мембранного аппарата и митохондриальных ферментов, возникающие под действием как флогогенного агента, так и других факторов, активирующихся или образующихся в ходе воспалительной реакции вторично. • Избыток Са2+, оказывающий (наряду с жирными кислотами) существенное разобщающее действие на окислительное фосфорилирование. • Увеличение в клетках уровня АДФ, АМФ и неорганического фосфата. Это активирует ключевые (лимитирующие) ферменты гликогенолиза и гликолиза. В связи с этим в очаге воспаления начинает возрастать удельный вес гликолитического ресинтеза АТФ. Липиды. Обмен липидов в очаге воспаления характеризуется доминированием липолиза над реакциями их синтеза. Причины • Прямое повреждающее влияние флогогенного агента может привести к ферментативной и неферментативной деструкции мембранных фосфо-липидов, ЛП, гликолипидов и других липидсодержащих соединений с высвобождением из них ВЖК, свободных липидов и образованием ке-токислот. • Основной механизм липолиза в очаге воспаления — интенсификация гидролиза липидов и их комплексов с другими веществами в результате повышенного высвобождения липаз и фосфолипаз из повреждённых клеток, а также из лейкоцитов, в большом количестве накапливающихся в очаге воспаления. •Активация деструкции липидов за счёт интенсификации реакций сво-боднорадикального перекисного окисления липидов. Проявления • Активация процессов липолиза и накопление продуктов липолиза. • Торможение реакций синтеза липидов. • Активация перекисного окисления липидов и накопление перекисей и гидроперекисей липидов. Белки. Обмен белков характеризуется преобладанием протеолиза над процессами протеосинтеза. Главные причины • Прямое патогенное действие флогогенного агента, в том числе ферментативный протеолиз. • Массированное выделение из повреждённых паренхиматозных и стро-мальных клеток, а также из лейкоцитов протеолитических ферментов. • Активация свободнорадикальных и перекисных реакций, сопровождающихся деструкцией ЛП и высвобождением из них белковых соединений, которые разрушаются и/или денатурируются. Проявления • Активация процессов протеолиза и накопление продуктов протеолиза. • Торможение реакций протеосинтеза. • Денатурация молекул белка (образование аутоантигенов). Ионы и вода. Для ионов и воды характерны трансмембранный дисбаланс ионов, увеличение внутриклеточного содержания Na+ и Са2+ и внеклеточного содержания К+ и Mg2+, гипергидратация клеток и отёк ткани в очаге воспаления. Главные причины • Прямое повреждающее действие флогогенного агента на мембраны клеток. • Нарушения энергетического обеспечения селективного переноса катионов. • Расстройства работы ионообменных механизмов (Н+-Са2+, Na+-Ca2+, Н+-К+). • Снижение кинетической активности катионзависимых мембранных АТФаз (Na+, K+-ATOa3bi, Ca2+, Mg2+-ATOa3bi). • Нарушения физико-химического состояния и микроструктуры клеточных мембран. • Нарушения соотношения между отдельными ионами как в клетке, так и вне клетки в результате расстройства механизмов трансмембранного переноса ионов. • Гипергидратация ткани в очаге воспаления в связи с высокой гидро-фильностью накапливающихся в нём Na+ и Са2+, а также продуктов гидролиза органических соединений. • Высвобождение дополнительного количества катионов (К+, Na+, Ca2+, железа, цинка) при гидролизе солей, распаде гликогена, белков и других органических соединений, а также клеточных мембран. • Выход большого количества Са2+ из повреждённых внутриклеточных депо. ФИЗИКО-ХИМИЧЕСКИЕ ИЗМЕНЕНИЯ Ацидоз. Воспалительная реакция характеризуется увеличением [Н+] и, соответственно, снижением рН в клетках и межклеточной жидкости — развитием ацидоза. Причина. Причина метаболического ацидоза — накопление в очаге воспаления избытка недоокисленных соединений. Механизмы развития метаболического ацидоза • Образование большого количества «кислых» продуктов изменённого метаболизма вследствие: • Нарушение оттока из очага воспаления продуктов как нормального, так и нарушенного обмена веществ. • Истощение щелочных буферных систем (бикарбонатной, фосфатной, белковой и др. ) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений. Гиперосмия. В очаге воспаления в большей или меньшей мере повышается осмотическое давление. Причины • Повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и др. ). • Усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества. • Поступление осмотически активных соединений из повреждённых и разрушенных клеток. Гиперонкия. Увеличение онкотического давления в воспалённой ткани — закономерный феномен. Причины • Увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов. • Повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействии с ионами. • Выход белков (в основном альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов. Заряд и электрические потенциалы Альтерация тканей при воспалении ведёт к нарушениям электрофизиологических процессов в клетках: изменению (как правило, снижению) поверхностного их заряда, а также к расстройствам электрогенеза в возбудимых клетках. Причины • Повреждение клеточных мембран. • Нарушение энергообеспечения трансмембранного переноса ионов. • Нарушения ионного баланса во внеклеточной жидкости. Поверхностное натяжение биомембран Уменьшение поверхностного натяжения клеточных мембран характерно для очага воспаления. Основная причина. Значительное увеличение концентрации в очаге воспаления поверхностно-активных веществ (фосфолипидов, ВЖК, К+, Са2+ и некоторых других). Коллоидное состояние цитозоля и межклеточного вещества Изменения коллоидного состояния цитозоля и межклеточного вещества выявляются уже на начальном этапе воспаления. Причины. Избыток Н+, К+, Na+, жирных кислот, пептидов, аминокислот, других метаболитов и БАВ — наряду с изменением степени гидратации цитоплазмы — приводит к облегчению переходов «гель < -> золь». Основные механизмы • Изменение степени полимеризации макромолекул • Фазовые переходы микрофиламентов | № 23 Медиаторы воспаления: виды, происхождение и значение в развитии воспалительного процесса.
МЕДИАТОРЫ ВОСПАЛЕНИЯ - БАВ, образующиеся при воспалении, обеспечивающие закономерный характер его развития и исходов, формирование его местных и общих признаков.
Все медиаторы воспаления или их неактивные предшественники образуются в различных клетках организма. Тем не менее их подразделяют на клеточные и плазменные.
Клеточные медиаторывысвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторыобразуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но не в активном состоянии, а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
Чёткую границу между клеточными и плазменными медиаторами воспаления удаётся провести далеко не всегда. Предложено множество классификаций медиаторов воспаления. Все они содержат в качестве классифицирующих несколько критериев.
КЛЕТОЧНЫЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ
К клеточным медиаторам воспаления относят биогенные амины, нейромедиаторы, нейропептиды, цитокины, множество секретируемых лейкоцитами агентов — лейкокины, а также оксид азота, производные ВЖК и липидов (липидные медиаторы), нуклеотиды и нуклеозиды.
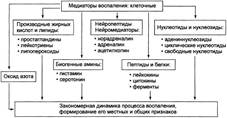 Липидные МЕДИАТОРЫ ВОСПАЛЕНИЯ
Липидными медиаторами воспаления называют производные арахидоновой кислоты — простагландины, тромбоксаны и лейкотриены, обладающие вазо-и бронхоактивными свойствами. Из мембранных фосфолипидов образуется также фактор активации тромбоцитов (PAF) — наиболее сильный спазмоген. К этой же группе относят продукты перекисного окисления липидов — липо-пероксиды.
Арахидоновая и линолевая кислоты входят в состав фосфолипидов клеточных мембран, откуда и освобождаются под влиянием фосфолипаз. Дальнейшие превращения этих кислот происходят либо по циклооксигеназному, либо по липооксигеназному пути.
Плазменные МЕДИАТОРЫ ВОСПАЛЕНИЯ
К плазменным медиаторам воспаления относятся кинины, факторы системы комплемента и факторы гемостаза.
Липидные МЕДИАТОРЫ ВОСПАЛЕНИЯ
Липидными медиаторами воспаления называют производные арахидоновой кислоты — простагландины, тромбоксаны и лейкотриены, обладающие вазо-и бронхоактивными свойствами. Из мембранных фосфолипидов образуется также фактор активации тромбоцитов (PAF) — наиболее сильный спазмоген. К этой же группе относят продукты перекисного окисления липидов — липо-пероксиды.
Арахидоновая и линолевая кислоты входят в состав фосфолипидов клеточных мембран, откуда и освобождаются под влиянием фосфолипаз. Дальнейшие превращения этих кислот происходят либо по циклооксигеназному, либо по липооксигеназному пути.
Плазменные МЕДИАТОРЫ ВОСПАЛЕНИЯ
К плазменным медиаторам воспаления относятся кинины, факторы системы комплемента и факторы гемостаза.
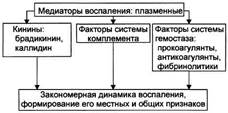 Значение. Таким образом, медиаторы воспаления обусловливают развитие и/или регуляцию как процессов альтерации (включая изменение обмена веществ, физико-химических параметров, структуры и функции), так и сосудистых реакций, экссудации жидкости и эмиграции клеток крови, фагоцитоза, пролиферации и репаративных процессов в очаге воспаления.
Значение. Таким образом, медиаторы воспаления обусловливают развитие и/или регуляцию как процессов альтерации (включая изменение обмена веществ, физико-химических параметров, структуры и функции), так и сосудистых реакций, экссудации жидкости и эмиграции клеток крови, фагоцитоза, пролиферации и репаративных процессов в очаге воспаления.
|
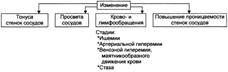
№ 24 Сосудистые реакции и изменения крово- и лимфообращения в очаге воспаления: стадии, механизмы, проявления и значение в развитии воспаления. Компонент воспаления «сосудистые реакции и изменения крово- и лимфообращения» является результатом альтерации ткани. Понятие «сосудистые реакции» подразумевает изменения тонуса стенок сосудов, их просвета, крово- и лимфообращения в них, проницаемости сосудистых стенок для клеток и жидкой части крови
При воспалении на разных стадиях сосудистых реакций происходят следующие важные и последовательные процессы. • Повышение тонуса стенок артериол и прекапилляров, сопровождающееся уменьшением их просвета и развитием ишемии. • Снижение тонуса стенок артериол, сочетающееся с увеличением их просвета, развитием артериальной гиперемии, усилением лимфообразования и лимфооттока. • Уменьшение просвета венул и лимфатических сосудов, нарушение оттока крови и лимфы по ним с развитием венозной гиперемии и застоя лимфы. • Дискоординированное изменение тонуса стенок артериол, венул, пре- и посткапилляров, лимфатических сосудов, сочетающееся с увеличением адгезии, агрегации и агглютинации форменных элементов крови, её сгущением и развитием стаза. Закономерный характер течения воспаления в значительной мере определяется именно стереотипной сменой тонуса стенок и просвета микрососудов, а также крово- и лимфотока в них. Сосудистые реакции подразделяют на последовательно развивающиеся в данном участке воспаления стадии ишемии, венозной гиперемии, артериальной гиперемии и стаза. ИШЕМИЯ. При воздействии на ткань флогогенного агента, как правило, развивается кратковременное (на несколько секунд) повышение тонуса ГМК стенок артериол и прекапилляров, т. е. локальная вазоконстрикция. Эта первая стадия сосудистых реакций в виде местной вазоконстрикции приводит к нарушению кровотока — ишемии. Значение. Значение ишемии состоит в локализации повреждающего влияния флогогенного агента и в препятствии его распространению за пределы очага непосредственного контакта с тканью. Проницаемость стенок микрососудов на этом этапе сосудистых реакций ещё не увеличена. АРТЕРИАЛЬНАЯ ГИПЕРЕМИЯ. Вторая стадия сосудистых реакций в виде расширения просвета артериол и прекапилляров приводит к артериальной гиперемии — увеличению притока артериальной крови и кровенаполнения ткани. Механизмы. Из механизмов, приводящих к развитию артериальной гиперемии, важное значение имеют нейрогенный, гуморальный и миопаралитический. Нейрогенный механизм . Нейрогенный механизм (холинергический по своему существу) развития артериальной гиперемии характеризуется: • увеличением высвобождения парасимпатическими нервными окончаниями ацетилхолина; • повышением чувствительности холинорецепторов к ацетилхолину, что, как правило, наблюдается в условиях избытка внеклеточного содержания К+ и Н+ (характерно для очага воспаления). Гуморальный механизм. Гуморальный компонент механизма развития артериальной гиперемии заключается в местном увеличении образования медиаторов с сосудорасширяющим действием: кининов, ПгЕ, Пг1, аденозина, оксида азота, гистамина. Миопаралитический механизм заключается в уменьшении базального тонуса артериол. Значение и последствия. При артериальной гиперемии к тканям увеличивается приток кислорода, субстратов метаболизма и в связи с этим возрастает фильтрационное давление. Последнее в регионе артериальной гиперемии ведёт к некоторому повышению объёма межклеточной жидкости с низким содержанием белка (транссудата). Одновременно происходят активация обмена веществ и синтеза новых клеточных и неклеточных структур взамен повреждённых или погибших. В то же время чрезмерная и/или затянувшаяся артериальная гиперемия может создать условия для оттока из очага воспаления токсичных соединений, микроорганизмов, БАВ и попаданию их в общий кровоток. Длительное расширение артериол и прекапилляров может сочетаться также с постепенно нарастающим повышением проницаемости стенок микрососудов под влиянием медиаторов воспаления, образующихся в очаге воспаления. Жидкость и содержащиеся в ней белки из просвета микрососудов выходят во внесосудистое пространство — начинает образовываться экссудат. ВЕНОЗНАЯ ГИПЕРЕМИЯ. Параллельно с вышеуказанными изменениями, как правило, появляются признаки венозной гиперемии в виде увеличения просвета посткапилляров и ве-нул и замедления в них тока крови. Предстаз. Через некоторое время появляются периодические маятникообразные движения крови «вперёд ↔ назад». Это является признаком перехода венозной гиперемии в состояние, предшествующее стазу (предстаз). Причина маятникообразного движения крови: в очаге воспаления возникает механическое препятствие оттоку крови по посткапиллярам, венулам и венам. Препятствие создают возникающие при замедлении тока крови и гемоконцентрации агрегаты форменных элементов крови в просвете сосуда и пристеночные микротромбы. Таким образом, во время систолы кровь движется от артериол к венулам, а во время диастолы — от венул к артериолам. СТАЗ. Четвёртая стадия сосудистых реакций — стаз — характеризуется дискоординированным изменением тонуса стенок микрососудов и как следствие — прекращением тока крови и лимфы в очаге воспаления. Длительный стаз ведёт к развитию дистрофических изменений в ткани и гибели отдельных её участков. ЗНАЧЕНИЕ И ПОСЛЕДСТВИЯ ВЕНОЗНОЙ ГИПЕРЕМИИ И СТАЗА Значение венозной гиперемии и стаза в очаге воспаления состоит в изоляции очага повреждения (благодаря препятствию оттоку крови и лимфы из него и тем самым содержащихся в них микробов, токсинов, продуктов метаболизма, ионов, БАВ и других агентов, способных повредить другие ткани и органы организма). | |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|