- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
МЕТОДЫ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ 8 страница
|
№ 61 Гипоксия экзогенного и дыхательного типов: разновидности, этиология, патогенез, характеристика изменений газового состава и pH артериальной и венозной крови. Понятие о высотной, горной и декомпрессионной болезнях. ЭКЗОГЕННЫЙ ТИП ГИПОКСИИ К экзогенным типам гипоксии относят нормо- и гипобарическую гипоксию. Причина их развития: уменьшение парциального давления кислорода (р02) в воздухе, поступающем в организм. • При нормальном барометрическом давлении говорят о нормобарической экзогенной гипоксии. • При снижении барометрического давления экзогенную гипоксию называют гипобарической. Нормобарическая экзогенная гипоксия Причины нормобарической экзогенной гипоксии: ограничение поступления в организм кислорода с воздухом при нормальном барометрическом давлении. Гипобарическая экзогенная гипоксия Причины гипобарической экзогенной гипоксии: снижение барометрического давления при подъёме на высоту (более 3 000—3 500 м, где р02 воздуха снижено примерно до 100 мм рт. ст. ) или в барокамере. В этих условиях возможно развитие либо горной, либо высотной, либо декомпрессионной болезни. • Горная болезнь наблюдается при подъёме в горы, где организм подвергается воздействию не только пониженного содержания кислорода в воздухе и пониженного барометрического давления, но также более или менее выраженной физической нагрузки, охлаждения, повышенной инсоляции и других факторов средне- и высокогорья. • Высотная болезнь развивается у людей, поднятых на большую высоту в открытых летательных аппаратах, на креслах-подъёмниках, а также при снижении давления в барокамере. В этих случаях на организм действуют в основном сниженные р02 во вдыхаемом воздухе и барометрическое давление. • Декомпрессионная болезнь наблюдается при резком снижении барометрического давления (например, в результате разгерметизации летательных аппаратов на высоте более 10 000 —11 000 м). При этом формируется опасное для жизни состояние, отличающееся от горной и высотной болезни острым или даже молниеносным течением. Патогенез экзогенных гипоксии К основным звеньям патогенеза экзогенной гипоксии (независимо от её причины) относятся артериальная гипоксемия, гипокапния, газовый алкалоз, сменяющийся ацидозом; артериальная гипотензия, сочетающаяся с гипоперфузи-ей органов и тканей. • Снижение напряжения кислорода в плазме артериальной крови (артериальная гипоксемия) — инициальное и главное звено экзогенной гипоксии. Гипоксемия ведёт к уменьшению насыщения кислородом НЬ, общего содержания кислорода в крови и как следствие — к нарушениям газообмена и метаболизма в тканях. • Снижение напряжения в крови углекислого газа (гипокапния). Она возникает в результате компенсаторной гипервентиляции лёгких (в связи с гипоксемией). • Газовый алкалоз является результатом гипокапнии. • Снижение системного АД (артериальная гипотензия), сочетающееся с гипоперфузией тканей, в значительной мере является следствием гипокапнии. С02 относится к числу основных факторов регуляции тонуса сосудов мозга. Значительное снижение РаС02 является сигналом к сужению просвета артериол мозга, сердца и уменьшения их кровоснабжения. Эти изменения служат причиной существенных расстройств жизнедеятельности организма, включая развитие обморока и коронарной недостаточности (проявляющейся стенокардией, а иногда — инфарктом миокарда). • Параллельно с указанными отклонениями выявляются нарушения ионного баланса как в клетках, так и в биологических жидкостях: межклеточной, плазме крови (гипернатриемия, гипокалиемия и гипокальциемия), лимфе, ликворе. Описанные выше отклонения могут быть уменьшены или устранены путём добавления к вдыхаемому воздуху необходимого (расчётного) количества углекислого газа. ЭНДОГЕННЫЕ ТИПЫ ГИПОКСИИ Эндогенные гипоксические состояния в большинстве случаев являются результатом патологических процессов и болезней, приводящих к недостаточному транспорту к органам кислорода, субстратов обмена веществ и/или использования их тканями. Гипоксия различной выраженности и длительности может также развиться в результате резкого увеличения потребности организма в энергии в связи со значительно возросшими нагрузками. При этом даже максимальная активация кислородтранспортных и энергопродуцирующих систем не способна ликвидировать энергодефицита (перегрузочная гипоксия). Дыхательная гипоксия Причина дыхательной (респираторной) гипоксии — недостаточность газообмена в лёгких — дыхательная недостаточность. Патогенез Развитие дыхательной недостаточности может быть обусловлено альвеолярной гиповентиляцией, сниженной перфузией кровью лёгких, нарушением диффузии кислорода через аэрогематический барьер, диссоциацией вентиляционно-перфузионного соотношения. Независимо от происхождения дыхательной гипоксии инициальным патогенетическим звеном является артериальная гипок-семия, обычно сочетающаяся с гиперкапнией и ацидозом. • Альвеолярная гиповентиляция характеризуется тем, что объём вентиляции лёгких за единицу времени ниже потребности организма в газообмене за то же самое время. Такое состояние является результатом нарушения биомеханических свойств дыхательного аппарата и расстройства регуляции вентиляции лёгких. • Снижение перфузии лёгких кровью Причины: Уменьшение ОЦК (гиповолемия); Недостаточность сократительной функции сердца; Увеличение сопротивления току крови в сосудистом русле лёгких (пре- и/или посткапиллярная гипертензия); Повышение давления воздуха в альвеолах и/или дыхательных путях; Открытие артериовенозных анастомозов и сброс крови по внутри- и внелё-гочным шунтам справа налево, минуя капилляры альвеол. • Нарушение диффузии кислорода через аэрогематический барьер Причины: Утолщение и/или уплотнение компонентов альвеолокапиллярной мембраны. Это ведёт к более или менее выраженному альвеолокапиллярному разобщению газовой среды альвеол и крови капилляров • Диссоциация вентиляционно-перфузионного соотношения Причины: Нарушение проходимости бронхов и/или бронхиол; Снижение растяжимости альвеол; Локальное снижение кровотока в лёгких. |
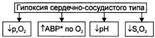
№ 62 Гипоксия циркуляторного типа: разновидности, этиология, патогенез, характеристика изменений газового состава и рН артериальной и венозной крови. Причина сердечно-сосудистой (циркуляторной, гемодинамической) гипоксии: недостаточность кровоснабжения тканей и органов. Патогенез. Недостаточность кровоснабжения формируется на основе гипово-лемии, сердечной недостаточности, снижения тонуса стенок сосудов, расстройств микроциркуляции, нарушений диффузии кислорода из капиллярной крови к клеткам. • Гиповолемия — уменьшение общего объёма крови в сосудистом русле и полостях сердца. Это один из важных механизмов развития недостаточности кровообращения и циркуляторной гипоксии. Причины гиповолемии: Большая кровопотеря; Гипогидратация организма. • Сердечная недостаточность проявляется снижением выброса крови из желудочков сердца и как следствие — уменьшением ОЦК. Причины: Прямое повреждение миокарда; Перегрузка миокарда; Нарушение диастолического расслабления сердца • Снижение тонуса стенок сосудов Снижение тонуса стенок сосудов (как артериальных, так и венозных). Это приводит к увеличению ёмкости сосудистого русла и уменьшению ОЦК. Причины: Снижение адренергических влияний на стенки сосудов; Доминирование холинергических; Дефицит минералокортикоидов в организме. Гипотония стенок сосудов любого происхождения обусловливает снижение артериального и перфузионного давления, а также объёма кровотока в сосудах тканей и органов. • Нарушение диффузии кислорода через стенку микрососудов, в межклеточной жидкости, через плазмолемму и цитозоль к митохондриям. В конечном счёте это приводит к дефициту кислорода в матриксе митохондрий и, следовательно, к снижению интенсивности тканевого дыхания. Причины: Уплотнение стенок микрососудов; Мембранопатии клеток. Циркуляторная гипоксия часто является результатом комбинации указанных выше механизмов Виды циркуляторной гипоксии Важной особенностью гипоксии циркуляторного типа является возможность развития локальной и системной её форм. • Локальная гипоксия Причины: Местные расстройства кровообращения (венозная гиперемия, ишемия, стаз); Регионарные нарушения диффузии кислорода из крови к клеткам и их митохондриям. • Системная гипоксия Причины: Гиповолемия; Сердечная недостаточность; Генерализованные формы снижения тонуса сосудов. Изменения газового состава и рН крови • Снижение pv02 (венозная гипоксемия). • Нормальное (как правило) ра02. • Увеличение артериовенозной разницы по кислороду (за исключением вариантов с масштабным сбросом крови по артериовенозным шунтам, минуя капиллярную сеть). • Негазовый ацидоз. • Снижение Sv02 (исключение — гипоксия при артериовенозном шунтировании).
| № 63 Гипоксия гемического типа: разновидности, этиология, патогенез, характеристика изменений газового состава и рН артериальной и венозной крови.
Причинакровяной (гемической) гипоксии: снижение эффективной кислородной ёмкости крови и, следовательно, её транспортирующей кислород функции.
Нb является оптимальным переносчиком кислорода. Транспорт кислорода от лёгких к тканям почти полностью осуществляется при участии Нb. Наибольшее количество кислорода, которое способен переносить Нb, равно 1, 39 мл газообразного 02 на 1 г НЬ. Реально транспортная способность НЬ определяется количеством кислорода, связанного с НЬ, и количеством кислорода, отданного тканям. При насыщении Нb кислородом в среднем на 96% кислородная ёмкость артериальной крови (Va02) достигает примерно 20% (объёмных). В венозной крови этот показатель приближается к 14 % (объёмным). Следовательно, артериовенозная разница по кислороду составляет 6%.
Патогенез. Главными звеньями механизма снижения кислородной ёмкости крови являются уменьшение содержания Нb в единице объёма крови (и, как правило, в организме в целом) и нарушения транспортных свойств НЬ. В целом гемический тип гипоксии характеризуется снижением способности Нb эритроцитов связывать кислород (в капиллярах лёгких), транспортировать и отдавать оптимальное количество его в тканях. При этом реальная кислородная ёмкость крови может снижаться до 5—10 % (объёмных).
• Уменьшение содержания Нb в единице объёма крови
Ведущее к гипоксии уменьшение содержания НЬ в единице объёма крови и в организме в целом наблюдается при весьма существенном уменьшении числа эритроцитов и/или снижении содержания НЬ (иногда до 40-60 г/л), т. е. при выраженных анемиях.
• Нарушения транспортных свойств НЬ
Нарушения транспортных свойств НЬ обусловлены изменением его способности к оксигенации в крови капилляров альвеол и дезоксигенации в капиллярах тканей. Эти изменения (гемоглобинопатии) могут быть наследуемыми или приобретёнными.
Наследуемые гемоглобинопатии. Причиной наследуемого снижения свойства Нb транспортировать кислород к тканям чаще всего являются мутации генов, сопровождающиеся нарушением аминокислотного состава глобинов. Существует множество наследственных гемоглобинопатии.
Приобретённые гемоглобинопатии. Причиной приобретённых гемоглобинопатии чаще всего является повышенное содержание в крови метгемоглобинообразователей, окиси углерода, карбиламингемоглобина, нит-роксигемоглобина.
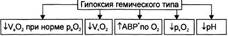
Изменения газового состава и рН крови
• Снижение объёмного содержания кислорода в артериальной крови (Va02 в норме равно 19, 5—21 объёмных %).
• Нормальное (! ) парциальное напряжение кислорода в артериальной крови.
• Снижение pv02 (венозная гипоксемия).
• Уменьшение Vv02.
• Негазовый ацидоз.
• Снижение артериовенозной разницы по кислороду.
| |
№ 64 Гипоксия тканевого типа: этиология, патогенез, характеристика изменений газового состава и рН артериальной и венозной крови.
Причинытканевой гипоксии: факторы, снижающие эффективность утилизации кислорода клетками тканей и/или сопряжения окисления и фосфорилирования.
Патогенез
• Снижение эффективности усвоения кислорода клеткаминаиболее часто является результатом ингибирования активности ферментов биологического окисления, значительного изменения физико-химических параметров в тканях, торможения синтеза ферментов биологического окисления и повреждения мембран клеток.
Подавление активности ферментов биологического окисления наблюдается при: Специфическом ингибировании ферментов; Неспецифическом ингибировании ферментов биологического окисления ионами металлов (Ag2+, Hg2+, Cu2+); Конкурентном ингибировании ферментов биологического окисления.
Изменения физико-химических параметров в тканях (температуры, электролитного состава, рН, фазового состояния мембранных компонентов) в более или менее выраженной мере снижают эффективность биологического окисления. Отклонение от нормы указанных и других параметров наблюдается при многих болезнях и патологических состояниях: гипертермиях и гипотермиях, недостаточности различных органов (сердца, почек, печени), анемиях и ряде других.
Торможение синтеза ферментов биологического окисления может наблюдаться при общем или частичном (особенно белковом) голодании; при большинстве гипо- и дисвитаминозов; нарушении обмена минеральных веществ, необходимых для синтеза ферментов.
Повреждение мембран. В наибольшей мере это относится к мембранам митохондрий. Повреждение и деструкция мембран являются результатом:
• Снижение степени сопряжения окисления и фосфорилированиямакроэргических соединений в дыхательной цепи.
В этих условиях увеличиваются расход кислорода тканями и интенсивность функционирования компонентов дыхательной цепи. Однако большая часть энергии транспорта электронов трансформируется в тепло и не используется для ресинтеза макроэргов. Эффективность биологического окисления снижается. Клетки не получают энергетического обеспечения. В связи с этим нарушаются их функции и жизнедеятельность организма в целом.
Выраженной способностью разобщать процессы окисления и фосфорилирования обладают многие эндогенные агенты (например, избыток Са2+, Н+, ВЖК, йодсодержащие гормоны щитовидной железы), а также экзогенные вещества (2, 4-динитрофенол, дикумарин, пентахлорфенол, грамицидин и др. ).
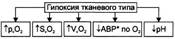
Изменения газового состава и рН крови
• Увеличение парциального напряжения кислорода в венозной крови.
• Повышение сатурации НЬ кислородом в венозной крови.
• Увеличение объёмного содержания кислорода в венозной крови.
• Нормальный диапазон р02, S02 и V02 в артериальной крови (в типичных случаях).
• Уменьшение артериовенозной разницы по кислороду (исключение — тканевая гипоксия, развившаяся при действии разобщителей окисления и фосфорилирования).
• Негазовый ацидоз.
|
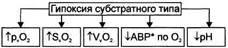
№ 65 Гипоксия субстратного и перегрузочного типов: этиология, патогенез, характеристика изменений газового состава и рН артериальной и венозной крови. Субстратный тип гипоксии Причина: дефицит в клетках субстратов биологического окисления. В клинической практике речь чаще всего идёт о глюкозе. При этом доставка к клеткам кислорода существенно не нарушена. Патогенез субстратной гипоксии заключается в прогрессирующем торможении биологического окисления. В связи с этим в клетках быстро снижаются уровень АТФ и креатинфосфата, величина МП. Изменяются и другие электрофизиологические показатели, нарушаются различные пути метаболизма и пластические процессы. Изменения газового состава и рН крови • Увеличение парциального напряжения кислорода в венозной крови. • Повышение сатурации кислородом НЬ эритроцитов венозной крови. • Возрастание объёмного содержания кислорода в венозной крови. • Уменьшение артерио-венозной разницы по кислороду. • Нормальные значения ра02, Sa02, Va02. • Ацидоз, развивающийся в результате нарушений обмена веществ, гемодинамики, внешнего дыхания и других изменений, обусловленных болезнью или патологическим процессом, вызвавшим гипоксию субстратного типа. Например, при СД — дефицит глюкозы в клетках, в организме накапливаются КТ, лактат, пируват (в связи с нарушением липидного и углеводного обмена), что приводит к метаболическому ацидозу.
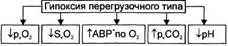
Перегрузочный тип гипоксии Причина перегрузочной гипоксии: значительное и/или длительное увеличение функции тканей, органов или их систем. При этом интенсификация доставки к ним кислорода и субстратов метаболизма, обмена веществ, реакций сопряжения окисления и фосфорилирования не способны устранить дефицит мак-роэргических соединений, развившийся в результате гиперфункции клетки. Наиболее часто речь идёт о ситуациях, вызывающих повышенное и/или продолжительное функционирование скелетных мышц и миокарда. Патогенез. Чрезмерная по уровню и/или длительности нагрузка на мышцу (скелетную или сердца) обусловливает: • Относительную (по сравнению с требуемым при данном уровне функции) недостаточность кровоснабжения мышцы. • Дефицит кислорода в миоцитах. Последний вызывает недостаточность процессов биологического окисления в них. Изменения газового состава и рН крови • Снижение парциального напряжения кислорода в венозной крови (венозная гипоксемия), оттекающей от гиперфункционирующей мышцы. • Уменьшение степени сатурации НЬ эритроцитов в венозной крови. • Увеличение артериовенозной разницы по кислороду. • Увеличение парциального напряжения углекислого газа (гиперкапния) в венозной крови, что является результатом активированного метаболизма в ткани мышцы. • Ацидоз в пробах крови, взятой из вены гиперфункционирующей мышцы.
|
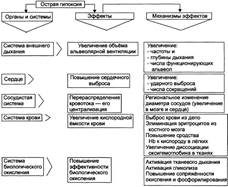
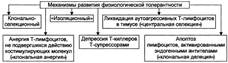
№ 66 Адаптивные реакции при гипоксии: экстренная и долговременная адаптация организма; условия формирования и механизмы развития. Принципы устранения и профилактики гипоксии. Условно адаптивные реакции подразделены на две группы: экстренной адаптации и долговременной адаптации. ЭКСТРЕННАЯ АДАПТАЦИЯ Механизмы
ДОЛГОВРЕМЕННАЯ АДАПТАЦИЯ Причина включения механизмов долговременной адаптации к гипоксии: повторная или продолжающаяся недостаточность биологического окисления умеренной выраженности. Условия включения механизмов долговременной адаптации к гипоксии • Повторное или длительно продолжающееся воздействие умеренной гипоксии, вызывающее многократную активацию срочных механизмов адаптации. • Выраженность умеренной гипоксии. • Оптимальное состояние жизнедеятельности организма. Механизмы долговременной адаптации
Принципы устранения и профилактики гипоксии
| |
№ 67 Типовые нарушения иммуногенной реактивности организма. Общая этиология и патогенез основных форм иммунопатологических состояний и реакций.
Расстройства механизмов ИБН за индивидуальным и однородным составом организма проявляются разнообразными иммунопатологическими состояниями и реакциями.
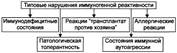 Иммунодефицитные состояния, патологическая толерантность, реакции «трансплантат против хозяина» являются следствием дефекта или нарушения деятельности одного или нескольких звеньев системы ИБН, обеспечивающих в норме эффективный иммунный ответ.
Этиология. Иммунопатологические состояния могут быть первичными или вторичными.
• Причиной первичных нарушений является наследуемый или врождённый дефект генетической программы иммунокомпетентных клеток, а также клеток, обеспечивающих неспецифическую защиту организма.
• Причиной вторичных нарушений являются расстройства, возникающие после рождения на разных этапах онтогенеза индивида. Они развиваются в результате повреждения клеток системы ИБН, имевших нормальную генетическую программу, под влиянием факторов различной природы.
Патогенез. Патогенез иммунопатологических состояний сложен и имеет несколько вариантов развития.
• Гипорегенераторный. Этот вариант патогенеза заключается в торможении пролиферации стволовых гемопоэтических и/или полипотентных, а также других пролиферирующих предшественников клеток иммунной системы. В результате в организме наблюдается делеция (удаление) какого-либо клона клеток системы ИБН, а также выраженное в большей или меньшей мере уменьшение общего числа иммуноцитов и других факторов системы ИБН.
• Дисрегуляторный. Данный механизм нарушений иммунитета обусловлен расстройствами дифференцировки антигенпредставляющих клеток и/или Т- и/или В-лимфоцитов, а также кооперации этих клеток.
• Деструктивный(цитолитический). Этот вариант патогенеза состоит в массированном разрушении иммуноцитов.
Иммунодефицитные состояния, патологическая толерантность, реакции «трансплантат против хозяина» являются следствием дефекта или нарушения деятельности одного или нескольких звеньев системы ИБН, обеспечивающих в норме эффективный иммунный ответ.
Этиология. Иммунопатологические состояния могут быть первичными или вторичными.
• Причиной первичных нарушений является наследуемый или врождённый дефект генетической программы иммунокомпетентных клеток, а также клеток, обеспечивающих неспецифическую защиту организма.
• Причиной вторичных нарушений являются расстройства, возникающие после рождения на разных этапах онтогенеза индивида. Они развиваются в результате повреждения клеток системы ИБН, имевших нормальную генетическую программу, под влиянием факторов различной природы.
Патогенез. Патогенез иммунопатологических состояний сложен и имеет несколько вариантов развития.
• Гипорегенераторный. Этот вариант патогенеза заключается в торможении пролиферации стволовых гемопоэтических и/или полипотентных, а также других пролиферирующих предшественников клеток иммунной системы. В результате в организме наблюдается делеция (удаление) какого-либо клона клеток системы ИБН, а также выраженное в большей или меньшей мере уменьшение общего числа иммуноцитов и других факторов системы ИБН.
• Дисрегуляторный. Данный механизм нарушений иммунитета обусловлен расстройствами дифференцировки антигенпредставляющих клеток и/или Т- и/или В-лимфоцитов, а также кооперации этих клеток.
• Деструктивный(цитолитический). Этот вариант патогенеза состоит в массированном разрушении иммуноцитов.
|
№ 68 Иммунодефициты и иммунодефицитные состояния (ИДС): характеристика понятий, виды. Этиология, патогенез, проявления, последствия, принципы терапии наиболее часто встречающихся иммунодефицитов (синдромы ретикулярной дисгенезии, Шедьяка-Хигаси, Луи-Бар, Ди Джорджи; агаммаглобулинемия (болезнь) Брутона; комбинированный иммунодефицит швейцарского типа. Иммунодефицитные состояния и иммунодефициты — типовые формы патологии системы ИБН, характеризующиеся снижением эффективности или неспособностью иммунной системы организма к осуществлению реакций деструкции и элиминации чужеродного Аг. Иммунодефициты — самостоятельные заболевания (нозологические формы) и сопутствующие синдромы, характеризующиеся недостаточностью иммунной системы. Виды Первичные — наследуемые и врождённые (генетические) дефекты иммунной системы. Вторичные — иммунная недостаточность развивается вследствие эндо- и экзогенных воздействий на нормальную иммунную Избирательные — вызваны селективным поражением различных популяций иммунокомпетентных клеток. Неспецифические — дефект(ы) механизмов неспецифической резистентности организма (неспецифического иммунитета), фагоцитов и комплемента. Комбинированные — сочетанное поражение клеточных и гуморальных механизмов иммунитета (например, В- и Т-лимфоцитов). В зависимости от преобладания дефекта иммуноцитов того или иного класса, иммунодефициты и иммунодефицитные состояния подразделяют на В-, Т-, А-зависимые (относящиеся к антигенпредставляющим клеткам) и смешанные. Этиология Первичные иммунодефициты проявляются развитием инфекционных поражений организма вскоре после рождения, но могут не иметь клинических проявлений и до более позднего возраста. Причина: Генные и хромосомные дефекты (многочисленные иммунодефициты разных классов). Вторичные иммунодефициты, или иммунодефицитные состояния Причины иммунодефицитных состояний многообразны, к ним отнесены: Иммуносупрессивные препараты (включая фенитоин [дифенин], пени-цилламин, глюкокортикоиды); Недостаточность питания, полостного и мембранного пищеварения, а также кишечного всасывания; Наркотики и токсические вещества; Лучевые воздействия, химиопрепараты; Рост злокачественных опухолей; Вирусы (например, ВИЧ); Состояния, приводящие к потере белка (например, нефротический синдром); Гипоксия.; Гипотиреоз; Уремия; Аспления. Синдром ретикулярной дисгенезии. При врождённой алейкии врождённый агранулоцитоз и лейкопения приводят к развитию тяжёлого иммунодефицита, часто сочетающегося с гипоплазией вилочковой железы. Синдром ретикулярной дисгенезии характеризуется значительным уменьшением в костном мозге количества стволовых кроветворных клеток, блоком созревания из них миело-, лимфо- и моноцитов с развитием комбинированного дефицита А-, В- и Т-клеток, а также нейтрофилов. Синдром Шедьяка-Хигаси. При аномалии Шедьяка-Штайнбринка-Хигаси блокада пролиферации миелостволовой клетки, что приводит к многочисленным последствиям: дефектам фагоцитоза, гипогаммаглобулинемии, нейтропении, тромбоцитопении. Тяжёлый комбинированный иммунодефицит. В классическом варианте отсутствует как гуморальный (нет AT), так и клеточный иммунитет (нет Т-клеток и естественных киллеров — NK-клеток); алимфоплазия или лимфопения (относится как к В-лимфоцитам, так и к Т-лимфоцитам). Вариабельный общий иммунодефицит. Вариабельный общий иммунодефицит — иммунодефицит полифакторной этиологии; Синдром Незелофа. Незелофа синдром — группа спорадических заболеваний, как правило, неизвестной этиологии, характеризующаяся повторными бактериальными, грибковыми, протозойными и вирусными инфекциями. Наблюдается гипоплазия вил очковой железы, угнетение клеточного (Т-лимфоци-тарного) и гуморального (В-лимфоцитарного) иммунитета. Синдром Иова. При синдроме Иова наблюдается высокий уровень IgE, низкое содержание IgA, кожная гиперчувствительность к Аг Staphylococcus aureus и Candida albicans, эозинофилия, дефекты хемотаксиса лейкоцитов, постоянные стафилококковые инфекции кожи, кандидоз кожи и слизистых оболочек, другие инфекции. ПРИНЦИПЫ ТЕРАПИИ ИММУНОДЕФИЦИТОВ Общая тактика • Лечение определяется типом иммунодефицита. • При тяжёлой патологии Т-клеток показана трансплантация костного мозга. • При недостаточности IgG — внутривенное введение растворов, содержащих Ig. • Не следует вводить живые вакцины больным с иммунодефицитом и членам их семей. Лекарственная терапия • Практически при всех формах необходимо назначение: Антибиотиков, Иммуностимуляторов. • При гуморальных и комбинированных иммунодефицитах — заместительная терапия Ig. • При недостаточности аденозиндезаминазы — заместительная терапия ферментом, конъюгированным с полиэтиленгликолем (Адаген). Проводится также генная терапия (корригированные Т-лимфоциты пациента). |
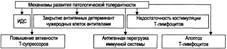
№ 69 Патологическая иммунная толерантность: причины, механизмы формирования, последствия. Понятие об индуцированной (медицинской) толерантности. Иммунологическая толерантность — состояние, характеризующееся «терпимостью» иммунной системы по отношению к чужеродным для неё Аг. Иммунологическую толерантность подразделяют на физиологическую, патологическую и искусственную. Физиологическая толерантность. Физиологическая толерантность подразумевает «терпимость» системы ИБН к собственным Аг. Основные механизмы развития.
• Элиминация в антенатальном периоде (когда иммунная система ещё недостаточно созрела) тех клонов лимфоцитов, которые подверглись антигенной перегрузке — массированному воздействию собственных Аг. • Изоляция Аг ряда органов от контакта с иммуноцитами структурно-физиологическими барьерами. К таким органам относятся мозг, глаза, семенники, щитовидная железа, которые отделены от внутренней среды организма гемато-тканевыми барьерами (гемато-энцефалическим, гемато-офтальмическим, гемато-тиреоидным). Эту разновидность толерантности называют изоляционной. • Подавление пролиферации и дифференцировки аутоагрессивных (действующих против собственных клеток) Т-лимфоцитов в центральном органе иммунной системы — тимусе. Этот феномен называют центральной селекцией и ликвидацией аутоцитотоксических лимфоцитов. • Гибель (апоптоз) клонов лимфоцитов, активирующихся аутоантигенами. В такой ситуации Т-лимфоциты, реагирующие на Аг собственного организма, экспрессируют Fas-рецепторы, на которые действуют Fas-лиганды нормальных клеток, что активирует программу апоптоза. • Депрессия цитотоксических лимфоцитов Т-супрессорами. • Анергия Т-лимфоцитов, не активированных костимуляторами. Патологическая толерантность. В этом случае речь идет о «терпимости» системой ИБН чужеродных Аг, чаще всего — бактерий, вирусов, паразитов, клеток злокачественных опухолей или трансплантата. Основные механизмы
• Иммунодефицитные состояния и иммунодефициты. • Чрезмерное повышение активности Т-супрессоров. Последнее характеризуется торможением созревания эффекторных клеток иммунной системы: Т-киллеров, естественных киллеров, плазматических клеток. • Ингибирование или блокада цитотоксических реакций клеточного иммунитета на соответствующий Аг (чаще всего клеток опухоли, трансплантата или ви-руссодержащих клеток) в результате «экранирования» антигенов антителами. • Перегрузка иммуноцитов избытком образующихся в организме или вводимых в него извне чужеродных Аг. • Гибель цитотоксических Т-лимфоцитов с развитием Т-клеточного иммунодефицита. Искусственная толерантность. Индуцированную (искусственную, медицинскую) толерантность воспроизводят при помощи воздействий, подавляющих активность иммунной системы. Обычно с этой целью применяют ионизирующее излучение, высокие дозы цитостатиков и иммунодепресантов. Для создания состояния искусственной толерантности применяют также специальные (непроницаемые для иммуноцитов) камеры, имплантируемые под кожу, слизистую оболочку, в мышцы или полости тела. В камеру помещают гомогенат или фрагменты чужеродной ткани. Такую разновидность толерантности называют изоляционной. Состояние индуцированной толерантности применяют для повышения успеха трансплантации органов и тканей, лечения аллергии, болезней иммунной ауто-агрессии, эндокринной недостаточности и некоторых других состояний. | |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|