- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
МЕТОДЫ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ 2 страница
| № 7 Реактивность организма; основные факторы, определяющие реактивность; типовые формы нарушения реактивности организма. Роль реактивности в возникновении и развитии патологии. Методы направленного изменения реактивности. Врачебный опыт показывает, что воздействие на организм экзо- и эндогенных факторов приводит к различным эффектам: от развития болезни или патологического процесса до отсутствия такого эффекта и даже развития заболевания при воздействии на организм индифферентных факторов. Эти и многие другие факты послужили основанием для двух важных выводов: • развитие болезни или патологического процесса — результат взаимодействия организма и причинного фактора, а не только воздействия лишь одного патогенного фактора. • Возможность возникновения, особенности развития и исходы болезней и патологических процессов определяются, с одной стороны, свойствами патогенного агента, с другой — свойствами организма, его реактивностью, с третьей — условиями, в которых происходит взаимодействие организма и причинного фактора. По мере развития общества диапазон патогенных факторов, потенциально или реально способных вызывать болезни и патологические процессы, сужается. На этом фоне возрастает роль состояния организма человека — его реактивности. Реактивность свойственна всем организмам. Это основное, существенное их качество наряду с такими, как размножение, развитие, рост, наследственность, обмен веществ. РЕАКТИВНОСТЬ - свойство целостного организма, обладающего нервной системой, дифференцированно (т. е. качественно и количественно определённым образом) реагировать изменением жизнедеятельности на воздействие факторов внешней и внутренней среды. Генез реактивности. Формирование реактивности произошло по мере сочетанного усложнения следующих кардинальных характеристик живых существ: реакция — ответ организма или его части на внешнее или внутреннее воздействие; чувствительность — способность воспринимать и определять характер (качество), силу, локализацию и периодичность воздействующего на организм агента; раздражимость — свойство организма воспринимать воздействие факторов внешней и внутренней среды и отвечать на них, как правило, генерализованной, малодифференцированной реакцией, например изменением обмена веществ, формы, размеров и др.; резистентность — сопротивление, противодействие: устойчивость организма или его части к воздействию определённых факторов внешней и внутренней среды. Категории реактивности. Реактивность определяется многими факторами и проявляется разнообразными формами изменений жизнедеятельности индивида. В связи с этим различают несколько категорий реактивности. Критериями выделения разновидностей реактивности являются основные биологические свойства организма, степень специфичности ответа организма, выраженность реакции организма на воздействие, природа агента, вызывающего ответ организма, биологическая значимость ответа организма. Биологические свойства организма. В зависимости от основных биологических свойств организма выделены видовая, групповая и индивидуальная категории (виды) реактивности. Степень специфичности, дифференцированности ответа организмапозволяет выделить реактивность специфическую и неспецифическую. Выраженность реакции организма на воздействиеопределяет реактивность нормергическую, гиперергическую, гипергическую и анергию. Природа агента. В зависимости от природы агента, вызывающего ответ организма, выделяют иммуногенную и неиммуногенную реактивность. Биологическая значимость ответаорганизма определяет физиологическую и патологическую реактивность. Таким образом, реактивность— динамичное, постоянно меняющееся свойство организма. С позиции врача важно, что это свойство можно изменять целенаправленно с целью повышения устойчивости организма к действию различных патогенных факторов. |
№ 8 Общий патогенез как раздел патофизиологии. Характеристика понятий: пусковой механизм; основное звено болезни или патологического процесса; динамичность и цепной характер патогенеза; порочный круг; специфические и неспецифические звенья патогенеза; патогенные и адаптивные реакции при развитии болезней и патологических процессов. Методы патогенетической терапии и профилактики. Термином «общий патогенез» обозначают раздел общей нозологии, посвященный разработке представлений об общих закономерностях возникновения и развития болезней и патологических процессов (включая механизмы выздоровления и умирания), а также формулированию и обоснованию принципов и методов их патогенетического лечения и профилактики. Термин «патогенез» (или частный патогенез) применяют для обозначения механизма развития конкретной болезни (нозологической формы) или конкретного патологического процесса. Патогенез — комплекс взаимосвязанных процессов повреждения и адаптации организма, лежащих в основе возникновения, развития и исходов конкретных болезней и патологических процессов. Положения общего учения о закономерностях развития болезней и представления о частном патогенезе отдельных нозологии и патологических процессов тесно связаны и дополняют друг друга. Данные о механизмах возникновения, становления и исходов конкретных болезней обобщаются и на этой основе выявляются общие закономерности их развития, формулируются заключения и теоретические представления общего учения о патогенезе болезней, а также о принципах их терапии и профилактики. Пусковой механизм. В патогенезе болезней и патологических процессов имеется стартовый, инициальный, пусковой механизм. Этот механизм во многом определяет специфику болезненного состояния независимо от того, работает ли он на протяжении всего заболевания или лишь запускает его. Основное звено. Патогенез болезней имеет основное (главное, ведущее, ключевое, организующее) звено или несколько звеньев. Как правило, оно (они) выявляется от начала до завершения процесса. Выявление ключевого звена или звеньев патогенеза лежит в основе проведения эффективной патогенетической терапии и профилактики болезней и патологических процессов. Вместе с тем при ряде болезней в настоящее время трудно выявить такое главное звено. Цепной процесс. Патогенез болезней и патологических процессов — динамичный цепной процесс. Это определяется тем, что пусковой патогенетический фактор вызывает более или менее разветвлённую цепь других процессов — вторичных, третичных и последующих патогенных изменений. Порочный круг. Для патогенеза ряда болезней и патологических процессов характерно формирование порочного круга. Это явление заключается в том, что одно из звеньев патогенеза является причиной расстройств, поддерживающих и/или потенцирующих действие данного звена. Специфические и неспецифические звенья / Среди звеньев патогенеза болезни или патологического процесса наряду со специфическими выявляются и неспецифические звенья. Своеобразная комбинация различной степени выраженности специфических и неспецифических патогенетических звеньев болезней в значительной мере определяет характерную клиническую манифестацию каждой из них. Патогенные и адаптивные реакции / Патогенез всех болезней и патологических процессов закономерно включает как патогенные, так и адаптивные (компенсаторные, защитные, репаративные) реакции и процессы. Конкретная их комбинация, выраженность и значимость реакций и процессов широко варьируют у различных пациентов не только с разными формами патологии, но даже с одной и той же. ПРИНЦИПЫ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ И ПРОФИЛАКТИКИ Целью патогенетического лечения больного является прерывание и/или снижение эффективности механизмов повреждения и одновременно — активация адаптивных (саногенетических) реакций и процессов. Иногда эти группы мероприятий называют патогенетической и саногенетической терапией соответственно. Патогенетическая терапия. В качестве примера лечебного воздействия, направленного на прерывание патогенетических реакций повреждения, можно назвать применение антигистаминных препаратов при развитии воспаления или аллергических болезней. При указанных патологических процессах образуется избыток гистамина, играющего одну из ключевых ролей в их патогенезе. Торможение синтеза и/или эффектов гистамина даёт существенный терапевтический эффект. Одновременно достижение этого эффекта предупреждает развитие и других последствий: отёка, расстройств крово- и лимфообращения, чувства боли и др. Саногенетическая терапия. Примером терапевтических мероприятий, направленных на активацию адаптивных процессов в организме, может быть применение комплекса иммуномо-дулирующих и иммуностимулирующих препаратов. Последние тормозят или предупреждают формирование иммунопатологических состояний, например, у пациентов с воспалительным или аллергическим компонентом патогенеза различных болезней. Заместительная терапия. Важным методом реализации патогенетического принципа лечения является заместительная терапия. Она предусматривает использование агентов, ликвидарующих дефицит или отсутствие в организме какого-либо фактора или факторов. Именно с этой целью применяют препараты гормонов, ферментов, витаминов. Эффективность лечения значительно повышается при сочетании (в тех случаях, когда для этого есть основания) этиотропного и патогенетического лечения (например, при воспалении, иммунопатологических процессах, лихорадке, ги-поксиях и др. ). | № 9 Наследственная и врождённая патология: характеристика понятий. Мутагены как причина изменений в геноме. Мутации - инициальное звено патогенеза наследственных форм патологии. Виды мутаций.
Наследственность — свойство организмов сохранять и обеспечивать передачу признаков потомкам, а также программировать особенности их индивидуального развития в конкретных условиях среды. Отсюда следует, что состояние здоровья и нездоровья (болезнь) являются результатом взаимодействия наследственных и средовых факторов.
Наследование— процесс передачи генетической информации о признаках — осуществляется через гаметы (в случае полового размножения) и через соматические клетки (при бесполом).
Наследуемость— доля фенотипической изменчивости, обусловленная генетическими различиями между особями, а показатель наследуемости — доля участия генетических факторов в общей (фенотипической) изменчивости признака.
Изменчивость — свойство организма приобретать новые признаки и особенности индивидуального развития, отличающиеся от родительских. Выделяют фенотипическую (или ненаследственную) и генотипическую (или наследственную) изменчивость.
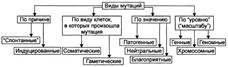
Мутации. Стартовое звено патогенеза наследственных заболеваний — мутации — нарушения структуры генов, хромосом или изменение их числа. В зависимости от уровня организации генетического материала (ген, хромосома, геном) говорят о мутациях генных, хромосомных и геномных.
Причинами мутаций могут быть различные факторы. Их обозначают как мутагены, а изменения, приводящие к возникновению мутаций, называют мутационным процессом. В результате мутационного процесса возникают разные виды мутаций. Изменения генетического материала разнообразны (делеции, вставки и т. д. ), что позволяет подразделить мутации по механизму дефекта генетического материала (типы мутаций).
Мутагены (равно и вызываемые ими мутации) классифицируют по происхождению (источнику) на эндогенные и экзогенные, а по природе на физические, химические и биологические.
Экзогенные мутагены. Их большинство, к ним относятся различные и многочисленные факторы внешней среды (например, радиационное излучение, алкилирующие агенты, окислители, многие вирусы).
Эндогенные мутагеныобразуются в процессе жизнедеятельности организма (например, мутации могут возникать под влиянием свободных радикалов, продуктов липопероксидации).
Физические мутагены— ионизирующее излучение и температурный фактор.
Химические мутагены— самая многочисленная группа мутагенов. К химическим мутагенам относятся: сильные окислители или восстановители (например, нитраты, нитриты, активные формы кислорода); алкилирующие агенты (например, йодацетамид); пестициды (например, гербициды, фунгициды); некоторые пищевые добавки (например, ароматические углеводороды, цикламаты); продукты переработки нефти; органические растворители; JIC (например, цитостатики, содержащие ртуть средства, иммунодеп-рессанты); другие химические соединения.
Биологические мутагены:
вирусы (например, кори, краснухи, гриппа); Аг некоторых микроорганизмов.
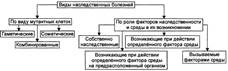
Виды мутаций.
|
|
№ 10 Генные мутации, хромосомные абберации, изменения генома: виды, механизмы, последствия. Виды наследственных форм патологии. По характеру изменений в составе гена различают следующие типы мутаций: Делеции— утрата сегмента ДНК размером от одного нуклеотида до гена. Дупликации— удвоение или повторное дублирование сегмента ДНК от одного нуклеотида до целых генов. Инверсии— поворот на 180° сегмента ДНК размером от двух нуклеотидов до фрагмента, включающего несколько генов. Инсерции— вставка фрагментов ДНК размером от одного нуклеотида до целого гена. Трансверсии— замена пуринового основания на пиримидиновое или наоборот в одном из кодонов. Транзиции— замена одного пуринового основания на другое пуриновое или одного пиримидинового на другое в структуре кодона. По последствиям генных мутаций их классифицируют на нейтральные, регуляторные и динамические, а также на миссенс- и нонсенс-мутации. Нейтральная мутации(молчащая мутация) — мутация не имеет стенотипического выражения (например, в результате вырожденности генетического кода). Миссенс-мутация— замена нуклеотида в кодирующей части гена — приводит к замене аминокислоты в полипептиде. Нонсенс-мутация— замена нуклеотида в кодирующей части гена — приводит к образованию кодона-терминатора (стоп-кодона) и прекращению трансляции. Регуляторная мутация— мутация в 5'- или З'-нетранслируемых областях гена, такая мутация нарушает экспрессию гена. Динамические мутации— мутации, обусловленные увеличением числа три-нуклеотидных повторов в функционально значимых частях гена. Такие мутации могут привести к торможению или блокаде транскрипции, приобретению белковыми молекулами свойств, нарушающих их нормальный метаболизм. Хромосомные мутации (аберрации) характеризуются изменением структуры отдельных хромосом. При них последовательность нуклеотидов в генах обычно не меняется, но изменение числа или положения генов при аберрациях может привести к генетическому дисбалансу, что пагубно сказывается на нормальном развитии организма. Различают внутрихромосомные, межхромосомные и изохромосомные аберрации. Внутрихромосомные аберрации— аберрации в пределах одной хромосомы. К ним относятся делеции, инверсии и дупликации. Межхромосомные аберрации— обмен фрагментами между негомологичными хромосомами. Они получили название транслокаций. Различают три варианта транслокаций: реципрокные (обмен фрагментами двух хромосом), нереципрокные (перенос фрагмента одной хромосомы на другую), роберт-соновские (соединение двух акроцентрических хромосом в районе их центромер с потерей коротких плеч, в результате образуется одна метацентри-ческая хромосома вместо двух акроцентрических). Изохромосомные аберрации— образование одинаковых, но зеркальных фрагментов двух разных хромосом, содержащих одни и те же наборы генов. Это происходит в результате поперечного разрыва хроматид через центромеры (отсюда другое название — центрическое соединение). Геномные мутации характеризуются изменением числа хромосом. У человека известны полиплоидия (в том числе тетраплоидия и триплоидия) и анеуплоидия. Полиплоидия — увеличение числа наборов хромосом, кратное гаплоидному. У человека полиплоидия, а также большинство анеуплоидий приводят к формированию леталей. Анеуплоидия — изменение (уменьшение — моносомия, увеличение — три-сомия) числа хромосом в диплоидном наборе, т. е. не кратное гаплоидному. Механизмы возникновения: нерасхождение хромосом (хромосомы в анафазе отходят к одному полюсу, при этом на каждую гамету с одной лишней хромосомой приходится другая — без одной хромосомы) и «анафазное отставание» (в анафазе одна из передвигаемых хромосом отстаёт от всех других). Классификация наследственных болезней. Основные критерии классификации наследственных болезней: вид мутантных клеток и вклад наследственных факторов и среды.
|
№ 11 Генные болезни: характеристика понятия; типы наследования и их основные признаки; примеры болезней. Генные болезни – это разнородная по клиническим проявлениям группа заболеваний, которые вызываются генными мутациями Для любого моногенного заболевания существенной характеристикой является тип наследования: аутосомно-доминантный, аутосомно-рецессивный, сцепленный с хромосомой X (доминантный и рецессивный), голандрический (сцепленный с хромосомой Y) и митохондриальный. АУТОСОМНО-ДОМИНАНТНЫЙ ТИП НАСЛЕДОВАНИЯ Примеры заболеваний: синдром Марфана, гемоглобинопатия М, хорея Хантингтона, полипоз толстой кишки, семейная гиперхолестеринемия, нейрофиб-роматоз, полидактилия. Признаки заболевания. Одинаковая частота патологии у лиц мужского и женского пола. Наличие больных в каждом поколении родословной, т. е. регулярная передача болезни из поколения в поколение (так называемый вертикальный характер распределения болезни). Вероятность рождения больного ребёнка равна 50% (независимо от пола ребёнка и количества родов). Непоражённые члены семьи, как правило, имеют здоровых потомков (поскольку не имеют мутантного гена). Перечисленные признаки реализуются при условии полного доминирования (наличие одного доминантного гена достаточно для развития специфической клинической картины заболевания). АУТОСОМНО-РЕЦЕССИВНЫЙ ТИП НАСЛЕДОВАНИЯ Примеры заболеваний: фенилкетонурия, адреногенитальный синдром, кожно-глазной альбинизм, галактоземия, гликогенозы, гиперлипопротеинемии, му-ковисцидоз. Признаки заболевания. Равная частота патологии у лиц мужского и женского пола. Проявление патологии в родословной «по горизонтали», часто у сибсов. Отсутствие заболевания у единокровных (дети одного отца от разных матерей) и единоутробных (дети одной матери от разных отцов) братьев и сестёр. Родители больного, как правило, здоровы. Это же заболевание может обнаруживаться у других родственников, например у двоюродных или троюродных братьев (сестёр) больного. Появление аутосомно-рецессивной патологии более вероятно при кровнородственных браках за счёт большей вероятности встречи двух супругов, гетерозиготных по одному и тому же патологическому аллелю, полученному от их общего предка. Чем больше степень родства супругов, тем эта вероятность выше. СЦЕПЛЕННОЕ С ХРОМОСОМОЙ Х-ДОМИНАНТНОЕ НАСЛЕДОВАНИЕ Примеры заболеваний: одна из форм гипофосфатемии — витамин D-резистентный рахит, болезнь Шарко—Мари-Тута Х-сцепленная доминантная, ро-то-лице-пальцевой синдром типа I. Признаки заболевания. Поражены лица мужского и женского пола, но женщины в 2 раза чаще. Передача больным мужчиной патологического аллеля всем дочерям и только дочерям, но не сыновьям. Сыновья получают от отца хромосому Y. Передача больной женщиной заболевания и сыновьям, и дочерям с равной вероятностью. Более тяжёлое течение заболевания у мужчин, чем у женщин. СЦЕПЛЕННОЕ С ХРОМОСОМОЙ Х-РЕЦЕССИВНОЕ НАСЛЕДОВАНИЕ Примеры заболеваний: гемофилия А, гемофилия В, Х-сцепленная рецессивная болезнь Шарко—Мари—Тута, дальтонизм, мышечная дистрофия Дюшенна—Бек-кера, синдром Калльмана, болезнь Хантера (мукополисахаридоз типа II), гипо-гаммаглобулинемия брутоновского типа. Признаки заболевания Больные рождаются в браке фенотипически здоровых родителей. Заболевание наблюдается почти исключительно у лиц мужского пола. Матери больных — облигатные носительницы патологического гена. Сын никогда не наследует заболевание от отца. У носительницы мутантного гена вероятность рождения больного ребёнка равна 25% (независимо от пола новорождённого), вероятность рождения больного мальчика равна 50%. ГОЛАНДРИЧЕСКИЙ, ИЛИ СЦЕПЛЕННЫЙ С ХРОМОСОМОЙ Y, ТИП НАСЛЕДОВАНИЯ Гены, ответственные за развитие патологического признака, локализованы в хромосоме Y. Примеры признаков: гипертрихоз ушных раковин, избыточный рост волос на средних фалангах пальцев кистей, азооспермия. Признаки. Передача признака от отца всем сыновьям и только сыновьям. Дочери никогда не наследуют признак от отца. «Вертикальный» характер наследования признака. Вероятность наследования для лиц мужского пола равна 100%. МИТОХОНДРИАЛЬНОЕ НАСЛЕДОВАНИЕ Примеры заболеваний (митохондриальные болезни): атрофия зрительного нерва Лебера, синдромы Лея (митохондриальная миоэнцефалопатия), MERRF (миоклоническая эпилепсия), кардиомиопатия дилатационная семейная. Признаки заболевания. Наличие патологии у всех детей больной матери. Рождение здоровых детей у больного отца и здоровой матери. Указанные особенности объясняются тем, что митохондрии наследуются от матери. | № 12 Хромосомные болезни: характеристика понятия; виды в зависимости от изменений структуры хромосом, их числа и вида клеток организма.
Хромосомные болезни - наследственные заболевания, обусловленные изменениями числа или конфигурации хромосом, чаще отсутствием в кариотипе одной хромосомы из какой-либо пары гомологов (моносомия) или наличием добавочной 3-й хромосомы к паре гомологов
Начальное звено патогенеза — геномная или хромосомная мутация. Хромосомный дисбаланс приводит к остановке либо нарушению эмбрионального развития, в том числе ранних этапов органогенеза. В результате формируются множественные ВПР. Тяжесть нарушений обычно коррелирует со степенью хромосомного дисбаланса: чем больше хромосомного материала вовлечено в аберрацию, тем раньше проявляется хромосомный дисбаланс в онтогенезе, тем значительнее нарушения физического и психического развития индивида.
Хромосомные болезни классифицируют по критериям изменения структуры и числа хромосом, а также в зависимости от типа клеток (половые или соматические).
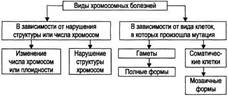 Большинство геномных мутаций (полиплоидии, трисомии по крупным хромосомам, моносомии по аутосомам) летальны.
Насчитываются сотни болезней, вызванных нарушением структуры хромосом в результате делеции, дупликации, инверсии или транслокации их отдельных участков. Их клиническая картина и тяжесть определяются характером перестройки, величиной вовлеченных фрагментов и их функциональной значимостью.
Мутации в гаметах приводят к развитию так называемых полных форм хромосомных болезней, когда изменения кариотипа выявляются во всех клетках организма.
Мутации в соматических клетках на ранних этапах эмбриогенеза приводят к развитию мозаицизма: часть клеток организма имеет нормальный кариотип, а другая часть — аномальный. Это вызывает так называемые мозаичные формы хромосомных болезней. Варианты мозаичных организмов могут быть самыми разнообразными: не только из двух, но из трёх и более клонов клеток с разными их количественными соотношениями. Фенотипические отклонения от нормы зависят от доли клеток различных типов, т. е. от стадии развития, на которой произошла мутация.
Большинство геномных мутаций (полиплоидии, трисомии по крупным хромосомам, моносомии по аутосомам) летальны.
Насчитываются сотни болезней, вызванных нарушением структуры хромосом в результате делеции, дупликации, инверсии или транслокации их отдельных участков. Их клиническая картина и тяжесть определяются характером перестройки, величиной вовлеченных фрагментов и их функциональной значимостью.
Мутации в гаметах приводят к развитию так называемых полных форм хромосомных болезней, когда изменения кариотипа выявляются во всех клетках организма.
Мутации в соматических клетках на ранних этапах эмбриогенеза приводят к развитию мозаицизма: часть клеток организма имеет нормальный кариотип, а другая часть — аномальный. Это вызывает так называемые мозаичные формы хромосомных болезней. Варианты мозаичных организмов могут быть самыми разнообразными: не только из двух, но из трёх и более клонов клеток с разными их количественными соотношениями. Фенотипические отклонения от нормы зависят от доли клеток различных типов, т. е. от стадии развития, на которой произошла мутация.
| |
| № 13 Болезни с наследственной предрасположенностью (многофакторные): виды, роль наследуемых и средовых факторов в их происхождении, особенности возникновения и проявления. Болезни с наследственным предрасположением называют также многофакторными, так как их возникновение определяется взаимодействием наследственных факторов и разнообразных факторов внешней среды. В основе предрасположенности к болезням находится генетическое разнообразие (генетический полиморфизм) популяций по ферментам, структурным, транспортным белкам, антигенным системам и т. д. Частотаболезней с наследственным предрасположением — более 90% всех неинфекционных форм патологий. К болезням с наследственным предрасположением относятся ИБС, гипертоническая болезнь, бронхиальная астма, психические заболевания, СД, ревматические болезни, язвенная болезнь желудка, ВПР и многие другие. Болезни с наследственным предрасположением классифицируют — в зависимости от числа генов, определяющих предрасположенность, — на моногенные и полигенные. Моногенные болезни с наследственным предрасположением детерминируются одним мутантным геном и возникают при действии конкретного (часто специфического) и обязательного фактора внешней среды. К таким разрешающим факторам относятся загрязнение среды (химическими соединениями, пылевыми частицами), пищевые вещества и добавки, ЛС. Полигенные болезни. Предрасположенность к развитию полигенных болезней детерминируется многими генами, точнее, состоит во взаимодействии нормальных и/или изменённых (мутировавших) генов, каждый из которых по отдельности не приводит к развитию заболевания. Индивид с такой комбинацией генов достигает «порога возникновения» болезни и заболевает. Этот порог может быть прёодолён под действием определённого фактора окружающей среды. ХАРАКТЕРИСТИКА МНОГОФАКТОРНЫХ БОЛЕЗНЕЙ • Наследование многофакторных болезней не соответствует менделевским закономерностям. • Патогенез болезней с наследственным предрасположением зависит от «удельного вклада» генетических и средовых факторов. Эта зависимость различна как для разных заболеваний, так и для каждого человека. Именно полиморфизм создаёт основу для предрасположенности организма к той или иной патологии. • Многофакторные болезни возникают в результате взаимодействия предрасположенного организма с комплексом неблагоприятных факторов внешней среды. Чем выше генетическая предрасположенность организма (т. е. чем ближе к «порогу возникновения» болезни он находится), тем менее интенсивным и длительным должно быть воздействие средового фактора для запуска патологического процесса, заболевания или состояния. • Для многофакторных болезней характерно наличие большого числа клинических вариантов. Они образуют ряд переходных состояний: от минимальных, клинически стёртых форм до тяжёлых проявлений. • При болезнях с наследственным предрасположением наблюдается более высокая конкордантность по заболеванию у монозиготных близнецов в сравнении с дизиготными. |
№ 14 Понятие о врождённых пороках развития: виды, причины возникновения, механизмы развития, проявления. Врождённые пороки развития (ВПР), включая аномалии развития, дисплазии и стигмы дизэмбриогенеза, а также причины их появления изучает тератология. Механизм формирования ВПР в ходе внутриутробного развития обозначается как тератогенез, а термин «тератоген» подразумевает фактор, вызвавший ВПР. Большинство ВПР обусловлено воздействием факторов внешней среды, генетическими дефектами или их сочетанием. ПРИЧИНЫ ВПР Тератогенные воздействия. Тератогенные факторы — те средовые факторы, которые нарушают развитие эмбриона и/или плода, воздействуя на эмбрион и/или плод в течение беременности. По крайней мере 10% всех ВПР обусловлено воздействием факторов внешней среды. Эффект тератогенов обусловлен влиянием на гисто- и органогенез, рост и развитие плода. Генетические нарушения. Генетические факторы могут приводить как к единичным ВПР, так и к развитию многообразных синдромов. Спорадические заболевания. Спорадические заболевания часто бывают следствием нарушения эмбрионального развития или патологического течения беременности (например, при окклюзии кровеносных сосудов). Некоторые врождённые аномалии могут возникать в результате спонтанной доминантной мутации (SR) соматических клеток, либо приводящей к летальному исходу, либо оказывающей воздействие на репродуктивную функцию и не передающейся потомству. ТИПЫ ВПР В зависимости от срока беременности при воздействии повреждающих факторов выделяют гаметопатии, бластопатии, эмбриопатии и фетопатии. Гаметопатии — результат воздействия на половые клетки (например, все ВПР, в основе которых находятся мутации в половых клетках). Бластопатии — следствие поражения бластоцисты — зародыша первых 15 сут после оплодотворения (до завершения формирования зародышевых листков). Результатом бластопатии являются, например, двойниковые пороки (сросшиеся близнецы), циклопия (наличие одного или двух слившихся глазных яблок в единственной орбите по срединной линии лица). Эмбриопатии — результат воздействия тератогенного фактора на эмбрион в период с 16-го дня до 8—9-й недели беременности. К этой группе относятся талидомидные, диабетические, алкогольные и некоторые медикаментозные эмбриопатии, а также ВПР, развившиеся под влиянием вируса краснухи. Фетопатии — следствие повреждения плода от 9-й недели до момента рождения. К фетопатиям относятся, например, крипторхизм, открытый боталлов проток или пренатальная гипоплазия какого-либо органа или плода в целом. МЕХАНИЗМЫ РАЗВИТИЯ Механизмы развития ВПР могут быть охарактеризованы в рамках искажения межмолекулярных и межклеточных взаимодействий и нарушений морфогене-тических процессов. Расстройства межмолекулярных и межклеточных взаимодействий приводят к нарушениям синтеза биологически активных веществ, структуры белков и жизненно важных процессов, искажающих дифференцировку и функции клеток, тканей и органов. Нарушения морфогенетических процессов (пролиферация, миграция, дифференцировка и гибель клеток) приводят к аплазии или гипоплазии органа или его части, задержке слияния эмбриональных структур, персистированию эмбриональных структур, к атрезии и гетеротопии и т. д. Категории ВПР. Агенезия— полное отсутствие органа (например, тимуса, почки, глаз). Аплазия и гипоплазия— отсутствие или значительное уменьшение органа при наличии его сосудистой ножки и нервов (например, одной почки, селезёнки, лёгкого, конечности, кишечника). Атрезия— полное отсутствие канала или естественного отверстия (например, атрезия наружного слухового прохода, пищевода, ануса). Гетеротопия— перемещение клеток, тканей или части органа в другую ткань или орган (например, клеток поджелудочной железы в дивертикул Меккеля, хромаффинных клеток в ткань лёгких). Персистирование— сохранение эмбриональных структур, исчезающих в норме к определённому этапу развития (например, открытый артериальный проток у годовалого ребёнка, крипторхизм). Стеноз— сужение просвета отверстия или канала (например, клапанного отверстия сердца, привратника желудка, фрагмента кишечника). Удвоение(утроение) — увеличение числа органов или его части (например, удвоение матки, мочеточников). Эктопия— необычное расположение органа (например, почки в малом тазу, сердца — вне грудной клетки). |
№ 15 Основные методы выявления, лечения и профилактики наследственных и врождённых форм патологии. Методы выявления. Клинико-синдромологический метод позволяет выявлять морфологические, биохимические и функциональные признаки наследственных форм патологии. Клинико-генеалогический метод выявляет патологические признаки и прослеживает особенности их передачи в поколениях при составлении родословной. Цель — установление закономерностей наследования признака: определение типа наследования (доминантного, рецессивного, ауто- или гоносомного); выявление носителей гена, определяющего развитие исследуемого признака (болезни); оценка пенетрантности (частоты проявления) гена — «носителя» патогенного признака; определение генетического риска (вероятности рождения больного ребёнка). Близнецовый метод базируется на сравнительном анализе частоты определённого признака в разных группах близнецов, а также в сопоставлении с партнёрами монозиготных пар между собой и общей популяцией. Идентичность близнецов по анализируемому признаку обозначают как конкордантность, а отличие — как дискордантность. Роль наследственности и факторов среды в возникновении патологии у близнецов оценивают по специальным формулам. Цитогенетическая диагностика основана на микроскопическом изучении хромосом с целью выявления структурных нарушений в хромосомном наборе (кариотипирование). В качестве материала используют тканевые культуры с большим числом делящихся клеток, чаще лимфоциты периферической крови. Хромосомы на стадии метафазы изучают при помощи специальнызх методов окрашивания и составляют идиограммы (систематизированные кариотипы с расположением хромосом от наибольшей к наименьшей), что позволяет выявлять геномные и хромосомные мутации. Биохимическая диагностика базируется на изучении биохимических показателей, отражающих сущность болезни (например, активность ферментов, наличие патологических метаболитов, концентрация компонентов ферментативной реакции). Молекулярная диагностика. При помощи методов ДНК-диагностики устанавливают последовательность расположения отдельных нуклеотидов, выделяют гены и их фрагменты, устанавливают их наличие в изучаемых клетках. К числу наиболее эффективных методов относятся гибридизация ДНК (блоттинг, in situ и т. д. ), клонирование ДНК, полимеразная цепная реакция (ПЦР). Биологическое моделирование проводят для анализа возможных генетических дефектов человека с использованием в качестве объекта исследования животных (здоровых или мутантных), а также для изучения возможных мутагенных и тератогенных эффектов ЛС и других агентов, для разработки методов генной инженерии. Принципы лечения. При лечении наследственных болезней (при соблюдении индивидуального характера помощи) применяют три основных подхода: этиотропный, патогенетический и симптоматический. Этиотропный подход направлен на устранение причины заболевания. С этой целью разрабатываются, апробируются и частично могут быть применены методы коррекции генетических дефектов, называемые генной терапией. В общем виде целью генной терапии является внесение в клеточный геном поражённых органов нормально экспрессируемого «здорового» гена, выполняющего функцию мутантного («больного») гена. Цель патогенетической терапии — разрыв звеньев патогенеза. Для достижения этой цели применяют несколько методов. Заместительная терапия — введение в организм дефицитного вещества (не синтезирующегося в связи с аномалией гена, который контролирует продукцию данного вещества; например, инсулина при СД, соответствующих ферментов при гликогенозах и агликогенозах, антигемофильного глобулина человека при гемофилии). Коррекция метаболизма путём ограничения попадания в организм веществ, метаболически не усваивающихся; выведения из организма метаболитов, накапливающихся в нём в избытке; регуляции активности ферментов. Хирургическая коррекция дефектов. Симптоматическая терапия направлена на устранение симптомов, усугубляющих состояние пациента. Методы профилактики. Медико-генетическое консультирование является основным видом профилактики врождённой и наследственной патологии. Задача консультирования: сформулировать прогноз для потомства, течения заболевания, качества жизни и здоровья. Пренатальная диагностика осуществляется в I и II триместрах беременности (в периоды, когда возможно прерывание беременности при обнаружении патологии плода). Методы диагностики: Ультразвуковое исследование, Биохимическое исследование сыворотки крови матери, Фетоскопия, Цитогенетические, биохимические и молекулярно-генетические методы. Преклиническая диагностика — скрининг с целью ранней диагностика наследственных болезней обмена веществ у новорождённых. Диспансеризация семей с наследственной патологией проводится с целью предупреждения рождения больного ребёнка или зачатия аномального плода (первичная профилактика). Контроль мутагенной опасности факторов окружающей среды реализуется путём предотвращения образования, снижения содержания, длительности и/или силы действия на организм химических, физических и биологических мутагенных агентов. Достигается комплексом организационных и гигиенических мер на производстве, в учреждениях и быту (например, возведением очистных сооружений; применением спецодежды, очисткой воздуха, воды и продуктов питания; использованием средств противорадиационной защиты). | |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|