
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
эффекты. Кроме того, гидрокортизон измен»» ■' иммунный ответ организма Гидрокортизон > рошо всасывается из ЖКТ. 9 страница
В случае сиалоаденита снижение дозы может привести к уменьшению указанного побочного эффекта, а вот в остальных случаях — нет, поэтому иногда побочные эффекты становятся причиной отмены ЛС.
Очень редко развиваются различные аллергические реакции (эозинофшшя, отек Квинке и т.д).
При наличии у пациента ТТГ-независимой стимуляции щитовидной железы (функциональная автономия щитовидной железы либо антитела к рецептору ТТГ в плазме крови) употребление даже небольшого количества йода может спровоцировать развитие так называемого феномена йод-баэедов (или йодиндуциро- ванного тиреотоксикоза). Данный факт следует учитывать при рассмотрении вопроса о назначении индивидуальной йод-
ней профилактики пациенту старшей возрастной группы.
При передозировке препаратов йода возможно развитие йодизма — характерного симптомокомплекса, включающего чувство жжения во рту и горле, металлический вкус во рту, болевые ощущения в зубах и деснах, геморрагии на коже и слизистых, головную боль
При передозировке йодидом калия также возможно развитие симптомов гипер- калисмии: нарушение сердечного ритма, мышечная слабость и т.д.
бождение тиреоидных гормонов, поэтому при совместном назначении вероятность развития гипотиреоза увеличива-
При совместном назначении с йодидом калия таких JIC, как калийсберегающие диуретики (спиролактон и др.), ингибиторы АПФ, а также различные JIC, в состав которых входит калий, необходимо контролировать уровень калия плазмы крови во избежание развития нарушений сердечного ритма.
 Противопоказания
Противопоказания
Противопоказаниями к назначению препаратов йода являются повышенная чувствительность к йодидам (наличие в анамнезе подобных эпизодов), хроническая почечная недостаточность и другие состояния, сопровождающиеся гиперкалиемией, острый бронхит, легочный туберкулез и отек легких (из-за возможного усиления се1феции желез дыхательных путей). Все перечисленное в основном касается препаратов йода в фармакологических дозах.
Препараты йода в физиологических дозах противопоказаны при гипертиреозе, поскольку способствуют процессам синтеза тиреоидных гормонов.
Взаимодействие
В литературе описано несколько JIC, которые взаимодействуют с препаратами йода. Среди них можно выделить препараты лития, которые также обладают ингибирующим действием на высво
1. Герасимов Г.А., Фадеев В.В., Свириден- ко Н.Ю., Мельниченко ГЛ. и др. Йододефицитные заболевания в России — простое решение сложной проблемы. М., 2002.
2. Davies T.F., Larsen P.R. Thyrotoxicosis. In: Larsen P.R., Ed. Williams Textbook of Endocrinology, 10th ed. Philadelphia: WB Saunders, 2003; 374—421.
3. Delange F. Iodine deficiency m Europe and its consequences: an update. Eur J. Nucl. Med. 2002; 29 (2): S404—S416.
4. FDA’s Guidance on Protection of Children and Adults Against Thyroid Cancer in Case of Nuclear Accident, 2002.
5. Gortner R., Haen E. Endokrinpharma- kologie. Pharmakotherapie nut Hormonen. In: Forth W., Ed. Allgememe und spezielle Pharmakologie und Toxikologie, 8. Aufl. Munchen: Urban & Fischer, 2001; 671— 737.
6. Hebei S.K. Drug Facts and Comparisons. PocketVersion. 8th ed. Wolters KLuwer, 2003.
7. Lacy C.F., Armstrong L.L., Goldman M.P., Lance L.L. Drug Information Handbook. 11th ed. Lexi-Comp 2003; 1761 p.
Глава 6. Гонадотропины
 Гонадотропины являются основными гормонами, регулирующими функцию половых желез. В настоящее время группа представлена целым рядом ЛС В 1960 г Lunenfeld впервые сообщил об использовании препаратов фолликулостимулирующего гормона (ФСГ) иЛГ, полученных из мочи женщин, находящихся в постменопаузе, для индукции овуляции: В течение последующих 35 лет терапия человеческим менопаузальным гонадотропином (ч-МГ), содержащим в эквивалентных по активности количествах ЛГ и ФСГ, стала стандартом стимуляции яичников экзогенными гонадотропинами. С начала 80-х гг. XX века фармакоиндустрия направила свои усилия на создание новых вы- сокоочищенных гонадотропинов. Первое такое средство, содержащее очищенный ФСГ с малым количеством ЛГ, было получено в 1986 г., а первый высокоочжценный препарат ФСГ — в 1996 г. С развитием современных молекулярно-биологических технологий появилась возможность получения новых рекомбинантных гонадотропинов, синтезируемых методами генной инженерии на основе клеток яичника китайского хомячка. Новые ЛС не содержат мочевых белков и других примесей и обладают постоянной активностью Возможность п/к введения позволяет пациентам вводить ЛС самостоятельно. Рекомбинантные гона дотропины открыли новый этап в лечении экзогенными гонадотропинами-
Гонадотропины являются основными гормонами, регулирующими функцию половых желез. В настоящее время группа представлена целым рядом ЛС В 1960 г Lunenfeld впервые сообщил об использовании препаратов фолликулостимулирующего гормона (ФСГ) иЛГ, полученных из мочи женщин, находящихся в постменопаузе, для индукции овуляции: В течение последующих 35 лет терапия человеческим менопаузальным гонадотропином (ч-МГ), содержащим в эквивалентных по активности количествах ЛГ и ФСГ, стала стандартом стимуляции яичников экзогенными гонадотропинами. С начала 80-х гг. XX века фармакоиндустрия направила свои усилия на создание новых вы- сокоочищенных гонадотропинов. Первое такое средство, содержащее очищенный ФСГ с малым количеством ЛГ, было получено в 1986 г., а первый высокоочжценный препарат ФСГ — в 1996 г. С развитием современных молекулярно-биологических технологий появилась возможность получения новых рекомбинантных гонадотропинов, синтезируемых методами генной инженерии на основе клеток яичника китайского хомячка. Новые ЛС не содержат мочевых белков и других примесей и обладают постоянной активностью Возможность п/к введения позволяет пациентам вводить ЛС самостоятельно. Рекомбинантные гона дотропины открыли новый этап в лечении экзогенными гонадотропинами-
Гонадотропины можно классифицировать по составу и методам получения:
■ препараты ФСГ.
— мочевой ФСГ (урофоллитропин),
— рекомбинантный ФСГ (фоллитропин альфа, фол- литропин бета);
- препараты ЛГ:
— рекомбинантный ЛГ (лутропин альфа);
■ комбинированные препараты ФСГ и ЛГ:
— человеческий менопаузальный гонадотропин (ме- нотропины);
■ препараты человеческого хорионического гонадотропина (ч-ХГ):
— мочевой ч-ХГ (гонадотропин хорионический);
— рекомбинантный ч-ХГ (хориогонадотропин альфа). Урофоллитропин представляет собой высокоочищен- ный ФСГ, полученный из мочи женщин, находящихся в постменопаузе. Фоллитропин альфа и фоллитропин бета являются рекомбинантными препаратами ФСГ, полученными методами генной инженерии.
Менотропины представляют собой смесь ЛГ и ФСГ в эквивалентных по активности количествах (75 ME
ФСГ и 75 ME JIГ). Препарат получают из мочи женщин, находящихся в постменопаузе.
Существуют два различных препарата человеческого хорионического гонадотропина: ч-ХГ, полученный из мочи беременных женщин, и рекомбинантный ч-ХГ, полученный методами генной инженерии.
Механизм действия и фармакологические эффекты
Гонадотропины представляют собой гликопротеины, состоящие из о.- и Р-субъеди- ниц, соединенных нековалентной связью. ФСГ, ЛГ и ч-ХГ (а также ТТГ) имеют одинаковую а-субъединицу, состоящую из 89 аминокислот, и различные Р-субъеди- ницы, которые обусловливают различия в биологических свойствах этих веществ.
Эндогенные ФСГ и ЛГ синтезируются в передней доле гипофиза. Их действие осуществляется через соответствующие мембранные рецепторы ФСГ и ЛГ. При связывании гонадотропинов со своими рецепторами за счет G^-белка происходит активация аденилатциклазной системы, которая запускает эффекты ФСГ и ЛГ на уровне клеток.
У женщин ФСГ стимулирует рост и созревание фолликулов яичника (от первичного до доминантного), а также образование рецепторов ЛГ на поверхности те- ка-клеток и клеток гранулезы. ФСГ также регулирует активность ароматазы а клетках гранулезы, стимулируя таким образом синтез эстрогенов. ЛГ способствует синтезу андрогенов в тека-клетках, которые затем под действием ФСГ превращаются в эстрогены в клетках гранулезы. В больших дозах ЛГ стимулирует разрыв доминантного фолликула, т.е. непосредственно овуляцию. После овуляции ЛГ способствует развитию и поддержанию функции желтого тела и стимулирует синтез прогестерона в лютеинизиро- ванных клетках гранулезы.
У мужчин ФСГ стимулирует эпителий канальцев яичка и активно влияет на сперматогенез Он действует на клетки Сертоли и стимулирует продукцию ими белков и питательных субстратов, необходимых для созревания сперматозоидов. ЛГ инициирует развитие и созревание интерстициальных клеток (клеток Лейдига) и стимулирует биосинтез ими андрогенов.
Ч'МГ, являясь смесью ЛГ и ФСГ, стимулирует рост и созревание фолликулов и синтез ими эстрогенов. Таким образом, он способен обеспечить полноценную подготовку яичников к овуляции. У мужчин ч-МГ стимулирует сперматогенез.
Хорионический гонадотропин синтезируется в организме во время беременности фетальным трофобластом и способствует развитию и поддержанию функции желтого тела беременности, тем самым стимулируя синтез прогестерона. Поскольку хорионический гонадотропин обладает способностью стимулировать рецепторы ЛГ на клетках гранулезы, его действие в организме подобно действию ЛГ, поэтому в больших дозах он может имитировать предовуляторный выброс ЛГ у женщин. У мужчин ч-ХГ стимулирует дифферен- цировку интерстициальных клеток (клеток Лейдига) и синтез ими андрогенов.
Фармакокинетика
Вследствие своей полипептидной структуры гонадотропины разрушаются в ЖКТ, поэтому применяются только парентерально. Рекомбинантные гонадотропины имеют низкую иммуногенность (tjc. лишены мочевых белков), поэтому вводятся п/к, в отличие от мочевых гонадотропинов, вводимых в/м.
При в/м введении ч-ХГ повышение концентрации ЛС в сыворотке крови наблюдается уже через 2 ч Максимальная концентрация достигается после б ч и сохраняется в течение 36 ч Снижение концентрации в сыворотке крови наблюдается после 48 ч и достигает базального (неопределяемого в сыворотке крови) уровня через 72 ч. Биодоступность фоллитропи- нов составляет от 66 до 82%, а ч-ХГ — лишь 40%. Биотрансформация гонадотропинов не изучена.
После в/м введения ч-ХГ распределяется главным образом в ткани яичек
у мужчин и яичников у женщин, небольшие количества ЛС могут также распределяться в проксимальных канальцах почек. Распределение фоллитропинов по органам и тканям не изучено.
Снижение концентрации ч-ХГ происходит двухфазно. Т1/2 в первую фазу составляет 11 ч, а в терминальную — около 23 ч. Т1/2 ч-ХГ превышает таковой у Л Г, и именно поэтому ему отдается предпочтение перед экзогенным ЛГ для индукции овуляции. При в/м введении ч-ХГ за сутки в неизмененном виде с мочой выделяется около 10—12% терапевтической дозы ч-ХГ может определяться в моче 3—4 дня после введения. При в/м введении ч-МГ приблизительно 8% терапевтической дозы выделяется с мочой в неизмененном виде.
Концентрация ФСГ и ЛГ в плазме крови также снижается двухфазно, причем Т1/2 в первую фазу составляет 4 ч и 20 мин соответственно, а в терминальную — 70 и 4 ч соответственна Т1/2 фоллитропинов примерно одинаков (фоллитропин альфа — 24—32 ч, фоллитропин бета — 30 ч, урофоллитропин — 32—37 ч). Из-за относительно короткого Т1/2 ЛС необходимо вводить ежедневно.
Место в терапии
Как мочевые, так и рекомбинантные гонадотропины успешно используются в клинической практике. Однако вопрос об абсолютном превосходстве тех или иных ЛС остается спорным. Тем не менее преимуществами рекомбинантных гонадотропинов перед мочевыми являются отсутствие мочевых белков, возможных примесей других ЛС, содержащихся в моче, отсутствие инфекционных агентов, постоянная активность, низкая иммуногенность. Эти характеристики обеспечивают меньшую частоту побочных эффектов. Наконец, применение методов генной инженерии позволяет производить ЛС в неограниченном количестве и удовлетворить все возрастающую потребность в гонадотропных ЛС.
Недостатком рекомбинантных гонадотропинов, ограничивающим их широкое применение, является высокая стоимость этих ЛС.
Гонадотропины применяются для лечения бесплодия при гипогонадотропном гипогонадизме как у женщин, так и у мужчин.
У женщин с гипогонадотропным гипого- надизмом (I тип ановуляции по Всемирной организации здравоохранения — ВОЗ) определяется низкая концентрация как ФСГ, так и ЛГ. Поэтому для восстановления фертильности, в отличие от нормогонадотропных форм эндокринного бесплодия (где уровень ЛГ находится в пределах нормы или даже повышен и для созревания фолликула достаточно назначения одного ФСГ), необходима заместительная терапия как ФСГ, так и ЛГ. Подготовка фолликула к овуляции проводится менопаузальным гонадотропином, в случае неэффективности данного лечения применяется комбинированная терапия рекомбинантными ФСГ и ЛГ, при необходимости доза ЛГ унеличивается (максимальный уровень —• 225 МЕ/сут). Для индукции овуляции на следующий день после последней дозы гонадотропинов назначают 5000—10 000 ЕД ч-ХГ.
У мужчин с гипогонадотропным гипо- гонадизмом без повреждения яичек при помощи гонадотропинов возможно восстановление фертильности. Сначала проводится лечение ч-ХГ для нормализации уровня тестостерона, а затем для индукции сперматогенеза назначают препараты ФСГ или ч-МГ совместно с ч-ХГ до появления сперматозоидов в эякуляте. Длительность лечения должна составлять не менее 4 месяцев, т.к. для перехода зародышевых клеток в стадию сперматозоидов требуется 70—80 дней. Если после 4 месяцев терапии сперматогенез не повышается, дозу ч-МГ увеличивают.
Если до трехмесячного возраста у мальчиков яичко не опускается в мошонку (крипторхизм), ребенку показана терапия препаратами ч-ХГ. У мужчин с крип- торхизмом наблюдается бесплодие, а также повышается риск образования герминативных опухолей, поэтому чем раньше начато лечение, тем лучше. Использование ч-ХГ за счет стимуляции синтеза андрогенов способствует опусканию яичек в мошонку (при отсутствии анатомической обструкции). В случае отсутствия эффекта через два курса приема ч-ХГ показано хирургическое лечение.
Другие показания
■ Индукция овуляции у больных с синдромом поликистозных яичников (II класс ановуляции по ВОЗ), резистентных к лечению кломифеном. Предпочтительна стимуляция фоллитропинами в низких дозах в течение 9—12 дней с последующим назначением ч-ХГ в дозе 5000 ЕД.
■ Индукция овуляции перед инсеминацией спермой при мужском или неясном бесплодии. Стимуляция проводится ч-МГ/фоллитропинами с постоянным ультразвуковым контролем роста фолликула, уровня эстрогенов и ЛГ. При диаметре фолликула более 18 мм вводят 5000—10 000 ЕД ч-ХГ для индукции овуляции. Через 36—39 ч проводят инсеминацию спермой.
■ Проведение контролируемой гиперстимуляции в рамках вспомогательных репродуктивных технологий (экстракорпорального оплодотворения). Используются различные протоколы лечения. Предварительно проводится десенсибилизация аналогами гонадотропин- рилизинг-гормона (ГнРГ) для предотвращения преждевременной овуляции, а затем стимуляция высокими дозами
ч-МГ/фоллитропинами с последующей коррекцией дозировки в зависимости от темпа роста, числа фолликулов и уровня эстрогенов Затем вводят 5000—
10 000 ЕД ч-ХГ, и через 33—34 ч проводится пункция фолликулов.
Переносимость и побочные эффекты
При использовании гонадотропинов серьезным осложнением, которое может привести к летальному исходу, является синдром гиперстимуляции яичников (СГЯ). Признаками СГЯ являются тошнота, рвота, диарея, боли в животе, олигурия, периферические отеки. Повышение сосудистой проницаемости приводит к развитию асцита, гидроторакса, гидроперикарда Впоследствии присоединяются гиповоле- мия, гемоконцентрация, нарушение электролитного баланса, развиваются респираторный дистресс-синдром или тромбоэмболические осложнения. При индукции овуляции гонадотропинами для предотвращения СГЯ при созревании трех и более фолликулов диаметром более 16 мм стимуляцию прекращают и ч-ХГ не назначают. В тяжелых случаях требуется лечение в условиях стационара.
При лечении гонадотропинами возможно возникновение овариальных кист или унеличение размеров уже существующих кист яичников с их последующим разрывом и образованием гемоперитонеума.
Доказательства, свидетельствующие о повышении риска развития врожденных пороков у детей, рожденных от беременности, наступившей после стимуляции овуляции гонадотропинами, в настоящее время отсутствуют, и частота пороков развития соответствует таковой при спонтанно наступившей беременности.
Данные о повышении риска развития рака яичников на фоне терапии гонадотропинами противоречивы, и канцерогенный эффект этих ЛС не доказан.
У мальчиков при лечении крипторхиз- ма возможно появление признаков преждевременного полового созревания (увеличение полового члена и/или яичек, лобковое оволосение, агрессивное поведение). В этом случае лечение ч-ХГ необходимо прекратить.
Мочевые гонадотропины в отличие от рекомбинантных после введения могут вызывать выраженные местные реакции.
Противопоказания
Противопоказания к терапии гонадотропинами включают наличие у пациента индивидуальной гиперчунствительноети к ФСГ, ЛГ, ч-МГ, ч-ХГ или к другим составляющим компонентам ЛС.
Перед началом лечения определяют базальный уровень ЛГ и ФСГ, т.к. обнару
жение их высокого уровня свидетельствует о первичном гипогонадизме, т.е. поражении самих гонад, что делает лечение гонадотропинами неэффективным. Также перед началом стимуляции яичников необходимо исключить аномалии строения матки и трубный фактор бесплодия
При лечении гонадотропинами за счет повышения синтеза эстрогенов у женщин и андрогенов у мужчин повышается риск активации и роста эстрогено- и андрогенозависимых опухолей соответственно. Поэтому при опухолях яичников, матки, молочной железы, гипоталамуса, гипофиза, яичек, предстательной железы применение гонадотропинов противопоказано. По этой же причине не рекомендуется стимуляция яичников у женщин с овариальными кистами. Кровотечение из половых путей неясной этиологии также является противопоказанием к назначению гонадотропинов, т.к. одной из причин кровотечения может являться рак эндометрия.
При активных тромбофлебитах вследствие повышения уровня эстрогенов в крови возрастает риск артериальной тромбоэмболии, поэтому в этих случаях лечение гонадотропинами также не рекомендуется.
Беременность также является противопоказанием к лечению гонадотропинами, хотя однозначные данные о тератогенном влиянии гонадотропинов в настоящее время отсутствуют. Перед началом лечения проводят тест на беременность, а при ее наступлении гонадотропины отменяют.
Предостережения
При индукции овуляции гонадотропинами примерно в 10—20% случаев наблюдается многоплодная беременность.
Исследования по изучению концентрации гонадотропинов в грудном молоке не проводились, поэтому их назначение кормящим женщинам не рекомендовано.
Повышение секреции андрогенов под действием ч-ХГ может привести к задержке жидкости в организме, что необходимо учитывать у больных с бронхиальной астмой, заболеваниями почек, сердца, у пациентов с мигренью. У больных с эпилепсией повышение уровня эстрогенов на фоне лечения гонадотропинами может привести к ухудшению течения заболевания.
Лечение гонадотропинами должно проводиться только специалистами, имеющими опыт лечения бесплодия, знакомыми с критериями отбора пациентов для лечения, разбирающимися в показаниях и противопоказаниях к терапии гонадотропинами. При этом необходимо проводить постоянный мониторинг состояния больного и осуществлять тщательный контроль над лечением.
Взаимодействие
Специфические взаимодействия гонадотропинов с другими ЛС не изучены.
Литература
1. Fnese К. Melchert Arzneimzttel-therapie in der Frauenheilkunde. Wissenschaft- liche Verlagagesellschaft rnbH Stuttgart, 2002; B. 15.
2. Gortner R., Haen E. Endokrmpharmako- logie. Pharmakotherapie mit Hormonen. In: Forth W., Ed. Allgemeine und spezielle Pharmakologie und Toxikologie, 8. Aufl. Munchen: Urban & Fischer, 2001; 679— 683.
3. Lacy C.F., Armstrong L.L., Goldman M.P., Lance L.L. Drug Information Handbook 11th ed. Lexi-Comp 2003.
4. McClamrock H.D. Recombinant gonadotropins. Clinical Obstetrics and Gynecology 2003; 46 (2): 298—317.
5. Parker K.L., Schimmer B.P. Pituitary hormones and their hypothalamic > eleasing factors. In: Hardman J.G., Limbvrd L.E., Eds. Goodman & Gtfman’s The Pharmacologic Basis of Therapeutics, 10th ed. New York: McGraw-Hill, 2001; 1541—1562.
Глава 7. Средства, влияющие на продукцию гормонов гипофиза
Агонисты дофаминовых рецепторов ... 90
Аналоги
соматостатина......... S5
Бурное развитие нейроэндокринологии в конце XX века во многом связано с разработкой новых высокоэффективных ЛС, оказывающих влияние на продукцию гормонов гипофиза.
В данной главе подробно рассматриваются агонисты дофаминовых рецепторов, которые широко используются для лечения гиперпролактинемии и акромегалии, а также аналоги соматостатина—ЛС первой линии для лечения акромегалии и эндокринных опухолей ЖКТ и поджелудочной железы.
Агонисты дофаминовых рецепторов
 Первым ЛС из этой группы, специально j ным для уменьшения секреции пролактина в начале 1970-х гг., стал бромокриптин, который, несмотря i появление впоследствии многих других ЛС, до сих пор применяется наиболее часто. Бромокриптин представляет собой полусинтетический алкалоид спорыньи Производные алкалоидов спорыньи неизбирательного действия (к которым относятся бромокриптин, абергин, перголид, лиэурид, метерголин) можно назвать первым поколением данной группы ЛС Среди них лишь бромокриптин широко применяется в настоящее время. Ко второму поколению относятся не- эрголиновые ЛС, избирательно стимулирующие дофа- минергические О2~рецепторы (хинаголид из группы октабензохинолонов). Наконец, представителем третьего поколения является каберголин, который также является производным алкалоида спорыньи, однако обладает практически полной селективностью i ношению к D2- дофаминовым рецепторам.
Первым ЛС из этой группы, специально j ным для уменьшения секреции пролактина в начале 1970-х гг., стал бромокриптин, который, несмотря i появление впоследствии многих других ЛС, до сих пор применяется наиболее часто. Бромокриптин представляет собой полусинтетический алкалоид спорыньи Производные алкалоидов спорыньи неизбирательного действия (к которым относятся бромокриптин, абергин, перголид, лиэурид, метерголин) можно назвать первым поколением данной группы ЛС Среди них лишь бромокриптин широко применяется в настоящее время. Ко второму поколению относятся не- эрголиновые ЛС, избирательно стимулирующие дофа- минергические О2~рецепторы (хинаголид из группы октабензохинолонов). Наконец, представителем третьего поколения является каберголин, который также является производным алкалоида спорыньи, однако обладает практически полной селективностью i ношению к D2- дофаминовым рецепторам.
Таким образом, агонисты дофаминовых рецепторов классифицируются по селективности действия : подкласс дофаммнергических 02-рецепторов:
■ неселективные'.
— бромокриптин;
— абергин;
■ селективные:
— хинаголид;
— каберголин.
Механизм действия и фармакологические эффекты
Применение агонистов дофаминовых рецепторов для подавления продукции пролактина основано на их взаимодействии со специфическими дофаминергиче- скими Ц^-рецепторами на поверхности пролактин-се- кретирующих клеток (лактотрофов) передней доли гипофиза. Это приводит к снижению уровня цАМФ и внутриклеточного кальция, в результате чего уже через несколько часов происходит торможение секреции пролактина (быстрый эффект), а через несколько дней еще и снижение транскрипции гена пролактина, что приводит к уменьшению синтеза пролактина (медленный эффект). Следует отметить, что уменьшается не только базальная продукция пролактина, но и продукция пролактина в ответ на стимуляцию тиреотро- пин-рилизинг-гормона (ТРГ) или определенными ЛС
(например, метоклопрамидом) В результате происходит снижение уровня про- лактина в крови, при этом восстанавливается нормальная репродуктивная функция женского или мужского организма.
Благодаря высокой антимитотической активности дофаминомиметиков наблюдается уменьшение в размерах аденом гипофиза (при их наличии), причем как микро-, так и макропролактином, за счет чего может происходить ослабление неврологической симптоматики, вызванной пролактиномой.
Хотя у здоровых людей введение агонистов дофаминовых рецепторов вызывает повышение секреции гормона роста, у некоторых пациентов с акромегалией в ответ наблюдается парадоксальное снижение его секреции. Именно на этом основано применение агонистов дофаминовых рецепторов для лечения акромегалии.
Фармакокинетика
В ЖКТ всасывается значительная часть дозы дофаминомиметиков (одновременный прием пищи не снижает скорость абсорбции), однако за счет эффекта первого прохождения через печень (first-pass effect) системного кровотока достигает лишь небольшая часть дозы Абергин представляет собой смесь двух изомеров 2-бром-эргокриптина (альфа и бета) в соотношении, близком к 1 : 1. Так как бета- изомер более лилофильный, чем альфа- изомер (бромокриптин), он всасывается из кишечника более длительно, поэтому абергин отличается от бромокриптина несколько большей продолжительностью действия. Хинаголид и каберголин выгодно отличаются от бромокриптина тем, что благодаря большим Т1/2 их можно назначать соответственно 1 раз в сутки и 2 раза в неделю. ЛС метаболизируются в печени с образованием неактивных метаболитов и выводятся с желчью через кишечник (табл. 7.1).
Место в терапии
Терапия агонистами дофаминовых рецепторов является методом выбора для лечения синдрома гиперпролактинемическо- го гипогонадизма, обусловленного пролактиномой гипофиза или идиопатичес- кой гиперсекрецией пролактина. При этом наблюдается восстановление циклической активности гипоталамуса, нормализация продукции гонадотропных гормонов гипофиза. У женщин прекращается га- лакторея, восстанавливаются нормальный двухфазный менструальный цикл и фертильность. У мужчин восстанавливается способность к оплодотворению, а также либидо и потенция:
Лечение дофаминомиметиками продолжается длительное время Во время лечения необходимо периодически осуществлять оценку полей зрения (периметрию) и магнитно-резонансную томографию головного мозга для исключения роста аденомы.
Наибольшей эффективностью среди дофаминомиметиков обладает каберголин, поэтому он считается ЛС выбора для стартовой терапии гиперпролактинемии Частота ремиссий после отмены каберголина составляет до 60%, тогда как после отмены бромокриптина ремиссия наблюдается приблизительно у 37% пациентов. К тому
Таблица 7.1. Некоторые фармакокинетические параметры агонистов дофаминовых рецепторов
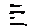 Период Продолжи- с белками полувыве- тельность
Период Продолжи- с белками полувыве- тельность
плазмы, % дения, ч действия.
же каберголин реже вызывает побочные эффекты, чем бромокриптин, и принимается всего 2 раза в неделю.
Каберголин и хинаголид являются ЛС выбора в случае резистентности к бромо- криптину или его непереносимости (10% пациентов). Наиболее часто предпочтение отдается каберголину, т.к. он эффективен у 70% пациентов, резистентных к действию бромокриптина.
Если уровень пролактина остается в норме на протяжении двух лет, можно постепенно снижать дозу под контролем уровня пролактина. Возможным объяснением того, что после отмены дофаминоми- метиков уровень пролактина у достаточно большой части пациентов остается в норме, может служить лактотрофоцидный эффект ЛС данной группы.
При неэффективности или непереносимости всех дофаминомиметиков показано хирургическое лечение.
Если женщина с гиперпролактинемией планирует беременность, то в этом случае предпочтение следует отдать бромокрип- тину как наиболее изученному ЛС в отношении безопасности для плода. Длительный период использования бромокриптина позволяет с уверенностью сказать, что он не обладает абортивным или тератогенным действием.
Обычно перед зачатием проводится годичный курс лечения бромокриптином, во время которого женшина должна использовать барьерные методы контрацепции. Бромокриптин можно при необходимости комбинировать с Л С, индуцирующими овуляцию (кломифен, гонадотропины). Использование селективных агонистов дофаминовых рецепторов (каберголина и хинаголида) при планировании беременности допускается при резистентности или непереносимости бромокриптина. Данных о неблагоприятном воздействии каберголина и хинаголида на течение беременности не было получено. Резистентность ко всем дофаминомиметикам — основание для хирургического вмешательства при планируемой беременности.
На фоне беременности, как правило, рост микроаденомы не происходит (вероятность составляет менее 1%), однако следует соблюдать осторожность при наличии микроаденом размером 7-—10 мм. Тем не менее обычно при наличии микропро- лактиномы дрфаминомиметики отменяют на период беременности. Риск унеличения макроаденом во время беременности значительно выше и составляет от 15 до 35%, поэтому таким пациенткам рекомендуется продолжать прием дофаминомиметиков во время беременности.
При появлении у беременных женщин с пролактиномой хиазмального синдрома рекомендуется лечение дофаминомиме- тиками до родоразрешения, за счет чего можно добиться регрессии хиазмального синдрома, поскольку риск применения ЛС меньше риска хирургического вмешательства во время беременности.
После беременности у некоторых женщин наблюдается полная ремиссия, в т.ч. и при наличии макропролактиномы. При лактации вероятность роста пролактино- мы не повышается, поэтому женщины могут кормить грудью, а терапия дофамино- миметиками не проводится
Как уже было сказано, фармакологические свойства дофаминомиметиков позволяют использовать их для лечения акромегалии. Наибольшая эффективность агонистов дофаминовых рецепторов в терапии акромегалии имеет место при сочетанной гиперсекреции пролактина и относительно невысокой активности акромегалии (уровень ИФР-1 не более 750 нг/мл), тем не менее в большинстве случаев агонисты дофаминовых рецепторов выступают в качестве дополнения к хирургическому и/или лучевому методам лечения.
Другие показания
Агонисты дофаминовых рецепторов широко используются в лечении болезни Паркинсона. Кроме того, их назначают для подавления или предотвращения послеродовой лактации.
Побочные эффекты и предостережения
В ЦНС находится несколько подтипов до- фаминергических рецепторов. Среди них именно к Dt- и D2-рецепторам в той или иной степени имеют сродство все дофами- номиметики, применяемые для снижения продукции пролактина Если стимуляция Ю2-рецепторов обладает при этом лечебным действием, то стимуляция D,-рецепторов, напротив, приводит к возникновению различных побочных эффектов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|