- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СИз-C-Cl + 2 H-NH2 —*• CH3-C-N(CH3)2 + HCl 3 страница
Нуклеопротеиды содержат в качестве простетических групп нуклеиновые кислоты. Фосфопротеиды содержат в качестве простетических групп фосфорную кислоту.
Простетическую группу ферментов называют коферментом.
Лекция 8
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Широкое распространение гетероциклических соединений в природе (витамины, алкалоиды, пигменты и т.д.), их важная роль в биологических процессах и в промышленности красителей и лекарственных веществ, а также возможность получения из отходов сельского хозяйства и летучей части продуктов коксования угля обуславливают необходимость обстоятельного изучения этого класса соединений.
Некоторые гетероциклические соединения, по свойствам близки к соединениям жирного ряда, уже были нами рассмотрены ранее, например, окись этилена, лактоны, ангидриды двухосновных кислот и др.
Рассматриваемые в лекции гетероциклические соединения в большей или меньшей степени обнаруживают ароматический характер, т.е. по свойствам сходны с бензолом. Эти гетероциклы, как и бензол, более склонны к реакциям замещения, чем к реакциям присоединения. Кроме обычных для ароматических систем реакций замещения и присоединения для гетероциклов характерны также реакции обмена гетероатома и реакции раскрытия цикла. Подобные превращения для бензола и его производных неизвестны.
Строение, номенклатура, ароматичность
Гетероциклическими соединениями называют органические соединения циклического строения, содержащие в кольцах /циклах/ не только атомы углерода, но и атомы других элементов. Такие неуглеродные атомы называют гетероатомами /от греч. "гетерос" - иной. различный/, а содержащие кольца /циклы/ - гетероциклами.
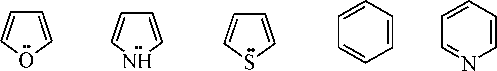
В образовании гетероциклов могут участвовать атомы почти всех элементов, если валентность у них равна не менее двух. Но наиболее важны и чаще всего встречаются гетероциклические соединения, в которых гетероатомы являются атомы O, S, N.
Гетероциклические соединения могут иметь 3,4,5,6 и более атомов в цикле. Они делятся на моноциклические соединения и соединения с конденсированными циклами.
Моноциклические соединения могут быть классифицированы по признаку входящих в них гетероатомов: O,S,N и по числу гетероатомов в цикле, например:
NH NH NH
пиррол пиразол триазол
Номенклатура
Для большинства часто встречающихся гетероциклических соединений употребляя- ются тривиальные названия. Ниже приведены названия по тривиальной номенклатуре.
В систематической номенклатуре природа гетероатома обозначается приставками: окса /О/-тиа, /SZ-аза /N/, размер цикла основами - ОЛ /5/, -ин /6/. Предлагаемые систематические названия основаны на системе Ганга-Видмана, в которой каждое из названий состоит из двух частей: одного или нескольких префексов, обозначающих гетероатомы, за которыми следует основа названия, указывающая число атомов в кольце и зависящая от того, есть ли в кольце атом азота, является ли кольцо насыщенным или нет. Эта система используются для моноциклов систем с числом звеньев от 3 до 10.
| Гетероатом | N | O | S | ||||
| Префикс | аза | окса | тиа | ||||
| число атомов | |||||||
|
| ненасыщенные | ол | ин | ол | ин | ол | ин |
| насыщенные | олидин | идин | олан | ан | олан | ан | |
| Если есть заместители, то в гетероциклах с одним гетероатомом нумерацию начинают с этого гетероатома. Когда в цикле имеется несколько гетероциклов, то их нумеруют в порядке: О^,^ В пятичленных гетероциклах положения 2 и 5 часто обозначают |
| а, а', а 3 и 4- в, в'. В шестичленных гетероциклах 4-ое положение - у. Для соединений с конденсированными циклами обычно пользуются специальными названиями. Эти соединения могут быть названы и по циклу, из которых построены их молекулы. Для этого перед названием гетероцикла ставятся приставки бензо-, нафто- и т. д. |
| Кроме того, электротрицательность гетероатомов изменяется в следующем ряду: O>N>S. Поэтому резонансные структуры I-V вносят меньший вклад в случае фурана по сравнению с пирролом и тиофеном (кислород менее склонен отдавать свою электронную пару) и, следовательно, фуран является наименее ароматичным из этих трех гетероциклов. Было установлено, что ароматичность изменяется в ряду: бензол >тиофен>пиррол > фуран. |
| ||||||||||||||||||||||
| "O' O 'N' хинолин бензопиридин АРОМАТИЧНОСТЬ Гетероциклические соединения можно условно разбить на два основных типа. К первому принадлежат системы, содержащие наряду с гетероатомом метиленовые группы и представляющие собой гетероциклические аналоги ациклических соединений. Такого рода насыщенные соединения с атомами O,S,N в цикле в значительной степени близки к аналогичным соединениям жирного ряда /простым эфирам, аминам, сульфидам/. Ко второму типу относятся Г.С., содержащие двойные связи в цикле и обладающие "ароматическим характером", объясняемым сопряжением двойных связей С=С с непредельными электронными парами гетероатома. Ароматический характер бензола в основном определяется наличием секстета п-электронов и выравненностью всех связей. В случае пятичленных ненасыщенных г.с. /фурана, пиррола, тиофена/ возможно образование секстета п-электронов за счет 4 п-электронов от 4-х атомов углерода и 2-х электронов неподеленной пары гетероатома. Шесть п-электронов образуют как в бензоле общее электронное облако. В результате Р- п-сопряжения кольцо становится плоским, простые связи укорачиваются. Так значения значения межатомных расстояний в молекуле фурана равны: |
| АютА 1 35 0 a |
| Сокращение расстояния С-С /против 1,54 А/ подтверждает наличие сопряжения связей в цикле. Наличие общего электронного облака приводит к сходству фурана, тиофена, пиррола и их производных с бензолом. Согласно методу валентных схем, эти молекулы рассматриваются как резонансные гибриды: |
| Структур а 1 вносит о с но вн ой вклад, т.к. н е включ ает разделения зарядов. Особенно важно то, что для фурана, пиррола, тиофена возможна только одна валентная структура без разделения зарядов. Это ограничение отражается в теплотах сгорания, согласно которым энергия стабилизации гетероциклов примерно вдвое меньше энергии стабилизации бензола. |
| кумарон бензофуран |
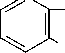
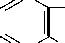
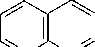
Пятичленные гетероциклические соединения широко представлены в продуктах питания и лекарственных препаратах (в основном в виде конденсированных систем.
Способы получения Одним из наиболее общих методов синтеза является реакция циклизации 1,4-ди- оксосоединений, на которые для получения фурана и его гомологов действуют водоотнимающим средством (Р2О5, NH3, P2S5 и др.
| O |
Получение пятичленных гетероциклов из слизевой кислоты и других дикарбоновых кислот - продуктов окисления сахаров.
| гидрированных над дегидратирующим катализатором (Al2 O3) при 4000 С в токе H2S, |
Фуран часто получают из его альдегида - фурфурола, пропусканием его с парами воды над катализатором (окись хрома, цинка, марганца) при температуре 400-4500С. Фурфурол и его производные часто получают из соответствующих углеводов.
Фурфурол может быть превращен в 2-фуранкарбоновую (пирослизевую) кислоту по реакции Канницаро или окислением воздухом в присутствии щелочных солей меди и серебра. Кислоту затем можно термически декарбоксилировать в фуран:
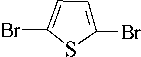
В промышленности тиофен получают из бутана и паров сер ы :
СИз-СИ2-СИ2-СИз + 4 S 650 С> ( \ + 3 H2S
S
Пиррол в промышленности пиррол получают из фурана и аммиака (реакция Юрьева).
Химические свойства Г.с. в реакциях электрофильного замещения по активности близки к ароматическим фенолам и аминам. Замещение как правило идет во второе положение гетероцикла, если оно занято - в пятое положение. По активности к реакциям электрофильного
замещения (сульфирования, нитрования, ацилирования, галогенирования) г.с. могут быть расположены в следующий ряд
|
| Реакции электрофильного замещ ения Присутствие в цикле гетероатома накладывает свои особенности на проведение реакции электрофильного замещения. Условия этих реакций резко отличаются от условий их протекания в случае бензола. Например: при действии на г.с. нитрующей смеси идет осмоление, но их можно пронитровать ацетилнитратом в присутствии пиридина. Реакцию ацилирования по Фриделю-Крафтсу проводят в присутствии более мягких катализаторов (ZnCl2, SnCl4, HgCl2) вместо AlCl3, либо совсем без них (в случае пиррола). Сульфирование фурана и пиррола осуществляют пиридинсульфотриоксидом вместо концентрированной серной кислоты. |
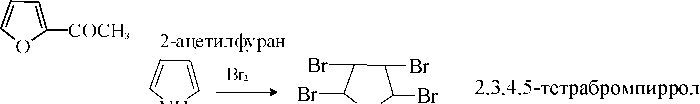
Реакции галогенирования.
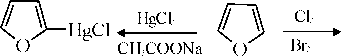
|
CH3COCI
 NH CH3COOH NH
NH CH3COOH NH
|
| Реакции диенового синтеза ( Дильса-Альдера). Наличие двух двойных сопряженных связей приводит к бнало гии г. с . с диеновыми углеводородами. Эта аналогия больше всего проявляется у фурана и меньше у пиррола и особенно у тиофена. |
| Q^SO.H |
| 2-пирролсульфокислота |
| ---- жшоду ___ —1 (^S°3H |
| NH или 95% H2SO4 на |
| 2-тиофенсульфокислота |
| { NSO3 (SO3, C5H5N) |
| 2-фурансульфокислота |
| е |
| 2-хлормеркуро- фуран |
| прямое галогенирование не поддается контролю |
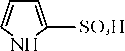
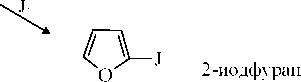
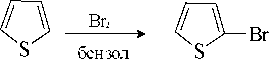
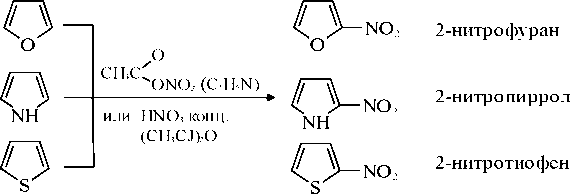
Реакции, идущие с участием гетероатома
1) . Раскрытие кольца фурана под действием концентрированной кислоты - ацидофоб- ность фурана. Фуран при взаимодействии с раствором НС1 в метаноле дает ацеталь:
|
изб. СН O H |
2) . Кислотно-основные свойства пиррола. Пиррол является очень слабой кислотой, он реагирует с металлами, образуя соли.
Основные свойства, которые можно было бы предложить у пиррола, как вторичного амина, очень ослаблены за счет сопряжения электронной пары с кольцом и маскируются быстрой полимеризацией под влиянием кислот.
3) . Свойства гетероатома "S". Тиофен более устойчив к кислотам, чем фуран и пиррол. Сера в тиофене не аналогична сульфидной. Сам тиофен не дает соединений, окисленных по гетероатому.
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ
Среди производных пиридина обнаружено большое число физиологически активных веществ, обладающих широким спектром действия. Амид в-пиридинкарбоновой кислоты - витамин РР. Диэтиламид никотиновой кислоты применяется как возбуждающее сердечную деятельность под названием кордиамина. Производные изоникотиновой кислоты применяются как противотуберкулезные препараты. 4-Амино-3,5,6- трихлорпиридин-2-карбоновая кислота является одним из сильнейших гербицидов: 2 г этой кислоты способны уничтожить растительность на площади в 1 га. Витамины группы В6 входят в структуру ферментов, регулирующих обмен и катализирующих, в частности, реакции переаминирования аминокислот и их декарбоксилирования.
Строение шестичленных гетероциклических соединений. АроматичностЬ.
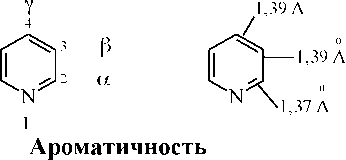
| а |
| в |
Важнейшим шестичленным гетероциклом с одним гетероатомом является пиридин.
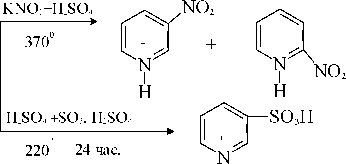
Пиридин можно рассматривать как бензол, в котором трехвалентная группа СН - замещена атомом азота:
Структура пиридина напоминает структуру бензола. Все углерод-углеродные связи плоского шестиугольника, состоящего из пяти углеродных атомов и одного атома азота, имеют одинаковую длину /1,39 А/, среднюю между длиной простой С-С /1,54 А/ и двойной С-С /1,34 А/ связей. Две связи С-N также имеют одинаковую длину /1.37 А/,
меньшую, чем длина простой связи С-N /1,47 А/ и большую, чем длина двойной связи C=N /1,28 А/. Такие параметры молекулы пиридина и его ароматичность обусловлена делокализацией шести п-электронов, по одному от каждого из пяти атомов углерода и одного от атома азота. Таким образом, пиридин является типичным ароматическим соединением, имеющим секстет л-электронов, образующих единую замкнутую электронную систему, аналогичную бензолу. Распределение электронной плотности в пиридине напоминает распределение электронной плотности в нитробензоле. Это
сходство согласуется с вычисленными плотностями л-электронов в пиридине:
Реакции электрофильного замещения идут в пиридине труднее, чем в бензоле, и направляются в положения 3 и 5, а нуклеофильное замещение идет легче, чем в бензоле и направляется в положения 2,4,6. Согласно методу валентных схем, пиридин может рассматриваться как резонансный гибрид структур.
Способы получения
Пиридин впервые извлечен из костяного масла (1851 г.), а затем из каменноугольного дегтя (1854 г.). До 1950 года каменноугольная смола была единственным промышленным источником получения пиридина, хотя содержание его в смоле менее 0,1%.
Для синтеза пиридина и его гомологов предложено ряд реакций.
Акролеин при конденсации с аммиаком образует в-пиколин (Байер, 1870 г.).
Синтез Ганча представляет собой общий метод получения производных пиридина конденсацией в-кетоэфиров, альдегидов и аммиака с образованием дигидропиридинов, которые затем окисляют до соответствующих производных пиридина.
Пиридиновые основания образуются (А.Е.Чичибабин и др.) при пропускании смеси альдегида R-CH2-CHO с аммиаком над оксидом алюминия при 4000 С.
Нагревание смеси акролеина и уксусного альдегида с аммиаком приводит к образованию пиридина.
Одним из простых способов синтеза пиридина является дегидрогенизация пиперидина, который может быть получен либо нагреванием гидрохлорида 1,5- пентаметилендиамина, либо действием щелочи на 5-бромамиламин.
Б.М. Михайлов наблюдал образование пиридина, пропуская через бензол азот, возбужденный электромагнитным полем высокой частоты. Атом азота в этом случае заместил группу СН.
Химические свойства
Для пиридина, подобно другим ароматическим гетероциклам, характерны реакции электрофильного, нуклеофильного и радикального замещения. Реакции электрофильно- го замещения в пиридине идут труднее, чем в нитробензоле и направляются в 3 и 5 положение (мета-положение). В этом сказывается дезактивирующее влияние атома азота. Кроме того, эти реакции, как правило, проводят в кислой среде, в которой пиридин, реагируя в виде соответствующей соли, несет на атоме азота положительный заряд, еще более дезактивирующий кольцо к электрофильной атаке.
Наиболее важны реакции замещения в ядре пиридина, происходящие при действии нуклеофильных агентов. Нуклеофильное замещение идет в 2,4,6-положениях и легче, чем в бензоле. Так, пиридин можно аминировать амидом натрия при нагревании, гидроксилировать действием едкого натра, а также алкилировать алкил- и ариллитием.
Наличие неподеленной пары электронов на атоме азота в пиридине обуславливает его основные свойства. (К осн.=2,3х10-9). Основные свойства у пиридина более слабо выражены, чем у аминов жирного ряда, что связано с сопряжением неподеленной электронной пары атома азота пиридина с л-электронами ядра (наличие р-л - сопряжения), и поэтому образуются соли только с сильными кислотами.
Для гомологов пиридина характерны реакции боковых цепей. К ним относятся реакции окисления и реакции а- и у- метильных групп метилпиридинов.
Реакции электрофильного замещения. При увеличении температуры до 500 С основными продуктами реакции являяются 2-бром и 2,6-дибромпиридин. Изменение ориентации при повышении температуры объясняется тем, что в этих условиях процесс принимает радикальный характер.
| Br |
| N I H |
| N |
| Br |
| ВГ2 |
| N Br Br |
| + |
| 200 - 300 |
| Br |
| + |
| Br |
| H2SO4 |
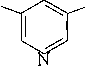
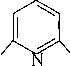
К реакциям радикального замещения в пиридине относится арилирование при действии фенилдиазогидрата. Образуется смесь, содержащая 55% 2-фенил, 30% 3- фенил, 15% 4-фенилпиридина.
| C6H5 0 + N2 + H2O N |
| О* |
| + H |
| KOH тв. |
| + |
| |C6H5 |
| + |
| C6H5 |
| N 'N ~'°“2 'N' Реакции нуклеофильного замещения. Na NH2 (NH3) 100 |
| C6H5-N=N-OH |
| + NH2 |
| О |
| Механизм реакции О |
| II |H "N NH2 О-комплекс |
| +H2 |
| (реакция А.Е.Чичибабина) |
| H2 2-аминопиридин |



Эта р-ция аналогична р-ции нитробензрола с H пиридон-2
При нагревании галогеналкилов алкильные радикалы переходят от атомов азота к углероду ядра в положение 2 или 4. Так, иодэтилат пиридина изомеризуется в иодистый 2-этилпиридиний
|
|
| Атомы водорода а- и у-метиленовых групп обладают повышенной протонизирующей способностью и похожи на водороды метильных групп о- и п-нитротолуола. Так, метилпиридины вступают в конденсацию кротонового типа с альдегидами. Конденсируя а-метилпиридин с формальдегидом и дегидратируя образующийся в-а- пиридин-этанол, получают а-винилпиридин, применяемый для сополимеризации с бутадиеном при промышленном производстве специальных видов каучуков. |
| N CH3 N CH2Li Пиперидин обладает свойствами алифатического амина. Он значительно более сильное основание, чем пиридин. Основность его такая же, как у диэтиламина. Подобно алифатическим вторичным аминам замещает иминный атом водорода остатками (алкилы, ацилы, нитрозогруппа). Может быть дегидрирован в пиридин нагреванием с серной кислотой или с помощью никелевых или палладиевых катализаторов. Устойчив к окислителям. Пуриновые и пиримидиновые основания. Нуклеиновые кислоты В состав нуклеиновых кислот входят 5 гетероциклических оснований: производные пурина (аденин и гуанин) и производные пиримидина (тимин и цитозин). Пиримидин Пурин Следует отметить, что большинство гетероциклических оснований, входящих в состав нуклеиновых кислот, могут существовать в виде двух таутомерных форм. Урацил ( U ) Аденин ( A ) |
| + C4H |
| + C4H9Li |
| N СНз Водород а-метилпиридина при действии алкиллития легко замещается на литий с образованием а-литийметилпиридина, который может быть использован для металлорганических синтезов. В толуоле водород метильной группы замещается лишь при метилировании алкилнатрием, но не алкиллитием. |
| H / С—H |
| + |
| -H2O |
| ■СН=СН2 |
| N |
| NN |
| NH, |
| NN |
| N - NH, |
| Тимин(T ) |
| O |
| Гуанин ( G) |
| OH |
| N , NH,. N N |
| Цитозин ( C ) |
Нуклеиновые кислоты
Нуклеиновые кислоты как один из компонентов живой материи были открыты в 1869 г. швейцарским врачом Иоганом Миллером. Однако бурное развитие химии и биологии нуклеиновых кислот началось в конце 40-х - начале 50-х годов ХХ века, когда было установлено, что один из двух главных типов нуклеиновых кислот - дезоксирибонуклеиновая кислота (ДНК) является носителем наследственной информации. На протяжении второй полвины ХХ века нуклеиновые кислоты были важнейшим объектом исследований химии и биологии. Химики создали методы установления детальной химической структуры нуклеиновых кислот, их искусственного синтеза, изучили их поведение при разных химических воздействиях. Биохимики выяснили биологические функции нуклеиновых кислот в живом организме.
Состав и строение нуклеиновых кислот
Подобно белкам нуклеиновые кислоты также являются высокомолекулярными соединениями, но в отличие от белков построены они не из аминокислот, а из других мономеров- нуклеотидов. Нуклеиновые кислоты представляют собой полимерные вещества с молекулярным весом 2,5*104 _ 2,0*109 , состоящие из гетероциклических оснований, углевода и фосфорной кислоты. При действии специфических ферментов кислот щелочей и других химических агентов нуклеиновые кислоты расщепляются на более простые компоненты. Например, при мягком гидролизе щелочами или водным раствором аммиака рибонуклеиновые кислоты распадаются на мононуклеотиды, которые в свою очередь отщепляют остаток фосфорной кислоты при нагревании до 1450С. с водным аммиаком. Образующиеся при этом нуклеозиды в условиях кислотного гидролиза разлагаются на простейшие компоненты - пуриновые и пиримидиновые основания и сахара.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|