
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СИз-C-Cl + 2 H-NH2 —*• CH3-C-N(CH3)2 + HCl 4 страница
ристой меди выпадает осадок нерастворимых ацетиленидов серебра AgC^CAg (белый цвет) и CuC^CCu ацетилениды меди - вишнево-бурого цвета.
CH=CH + 2 [ Cu(NH3)2] +OH" ►CNC =CNC + 4NH3+ H2O
вишнево- бурого цвета
Ацителеновые углеводороды легко окисляются при действии окислителей. Раствор KMnO4 обесцвечивается при прохождении в него ацетилена.
Алкины способны полимеризоваться в нескольких направлениях.
а) при нагревании в присутствии активированного угля ( Н. Д. Зелинский) или лучше в присутствии Ni(CO)4, [(C6H5)3 P]2 ацетилен образует бензол: (В. Реппе.)
б) под действием комплексных солей меди происходит линейная полимеризация с
образованием винилацетилена (I) и дивинилацетилена (2).
HC=CH не—CH
HC=CHCuC1 > hc^c—ch=cH2 -CH2=CH-C=C—CH=CH2
2 1 2
: диметилацетиленил карбинол.
в) при действии на ацетилен комплексным соединением никеля образуются циклические соединения с большим числом углеродных атомов, чем в бензоле. (B. Реппе.)
HC^CH /HC=CH\
CH CH CH/ Xc,H
CH CH
HC-CH Xh^ch/
циклооктатетраен
Реакции конденсации.
H-c' H-C^
H^=CH----------- *-H HC=C—CH3 -H CH2-C=C-CH2
OH бутиндиол-1,4
Реакция Фаворского - конденсация ацетилена с ацетоном в абсолютном эфире, в присутствии сухого порошкообразного KOH:
ОН2
HC=CH + CH3—C^^b^HC^C-C—CH3
диметилацетиленил карбинол
АРЕНЫ
Название „ароматические“ соединения сложилось исторически в связи с тем, что первые ароматические соединения были выделены из бальзамов, смол и эссенций и обладали хорактерным приятным запахом.
Состав ,строение , понятие ароматичности , изомерия наменклатура Циклические соединения содержащие замкнутук систему сопряженных двойных связей подразделяющиеся по термодинамическому признаку на три группы: а)ароматические; б)антиароматические; в) неароматические Если энергия открытой системы Ei» энергии замкнутой системы Е2, то такая сис-
тема является ароматической CH2=CH-CH=CH-CH=CH2 E1>>E2
Если энергия открытой системы Е1«энергии замкнутой системы Е2, то такая
система является антиароматической. CH2=CH-CH=CH2 E1<<E2
Если энергия открытой системы Е1= энергии замкнутой системы Е2, то такая
система является неароматической CH2=CH-CH=CH-CH=CH-CH=CH2 k='
Все ароматические соединения обладают определенными химическими и физическими признаками.
| Химические признаки: реакции электрофильного и радиального присоединения, а так же окисления с разрывом п-связи идут в жестких условиях. Основной тип реакции - электрофильного замещения. Для того, чтобы быть ароматическим, соединение должно обладать следующими физическими признаками: 1. Замкнутый плоский цикл. Это возможно в том случае , если все атомы С находятся в Бр2-гибридизации. 2. Все п-связи сопряжены , т.е. разделяются одной сигма - связью (= — = — =). 3. Выполняется правило Хюккеля. Э. Хюккель определил что число сопряженных п-электронов составляет: N=4n+2, где N-число делокализованных электронов, n- натуральное число 0,1,2,3, тогда N=2,6,10,14,18. При гидрировании одной двойной связи в циклогексане выделяется 28,8 ккал./моль. Тогда при гидрировании трёх двойных связей должно выделиться 86,4ккал./моль, но экспериментально было определено лишь 49,8. 86,4 (теор) + 49,8 (экспер) 36,6 ккал./моль - эмпирическая энергия резонанса которая свидетельствует о термодинамической устойчивости ароматических систем. Нулевому уровню энергии, т. е. системе из изолированных атомов, точнее р- орбиталей соответствует горизонтальная прямая, проведённая через центр окружности. Каждому из углов вписанного n-угольника соответствует МО. Методом рентгено-структурного анализа установлено, что бензол представляет собой молекулу, в которой шесть атомов С объединены в правильный шести угольный цикл с одинаковой длиной С-С связи 1,4 А0. Каждый атом угерода связан с одним атомом водорода С-Н связью =1,09А0. Каждый атом С находиться в Бр2-гибридном состоянии и образует 3 о связи под углом 1200(угол ССС = углу НСС = 1200). Номенклатура, изомерия Ароматические углеводороды называют аренами, радикал С6Н5 арил (Аг) или по тривиальной номенклатуре фенил. Монозамещенные бензолы изомеров не имеют, поэтому кольцо не нумеруется. Название заместителя обозначается приставной перед словом бензол. Дизамещенные бензола существуют в виде трёх изомеров. X |
| X |
| X |
| X |
| Х орто- мета- 1,2 дизамещенные 1,3 дизамещенные 1,4 дизамещенные Для запоминания полезно правило: орто - "около", мета -"между", двумя заместителями один атом углерода, пара - "против". Способы получения Ароматические углеводороды и некоторые их производные получают из каменноугольной смолы, отдельных видов нефти путем фракционной разгонки, ароматизацией нефти, а также синтетическими способами. Присухой перегонке каменного угля получается коксовый газ, каменноугольная смола и кокс. Выход каменноугольной смолы не велик- всего около 3%. Каменноугольная смола разделяется перегонкой на пять фракций в интервалах температур. 1)До 170 - лёгкое масло. ( углеводороды , бензол, толуол , ксилолы). 2) 170 -230 - среднее масло, содержит в больших количествах фенолы. 3)230°-270° - тяжелое масло - выделяет нафталин. 4)2700—3400 -антраценовое масло. 5) остаток -пек. Перегонка углеводородов нефти. В результате перегонки получают несколько фракций, содержащих смесь алканов и циклоалканов с различной длиной углеводородной |
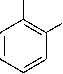
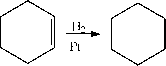

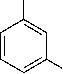
цепи. В настоящее время промышленное значение в синтезе бензола и его производных имеет две реакции, основанные на использовании фракции нефти: ароматизация парафинов и дегидрогенизация циклоалканов.
Ароматизация парафинов. Реакция открыта одновременно и независимо в трёх лабораториях СССР и носит название реакции Зелинского - Казанского - Плате. Дегидрирование алканов, имеющих не менее шести атомов углерода.
CH3-CH2-CH2-CH2-CH2-CH3 || | + 4H2
300 C '
„CH3
Pt (Г 3
CH,-(CH2)5-CH3 ------------ »- + 4h2
300 C 11 -1 2
Дегидрогенизация циклоалканов. Зелинский доказал, что в аналогичных условиях реагирует циклоалкан:
Декарбоксилирование солей бензойной кислоты.
Г омологи бензола легко получаются реакцией Вюрца - Фиттига действием металлического натрия на смесь галогенпроизводных ароматических и алифатических углеводородов.
• C6H6-C6H5 дифенил
| C6H5Br+ ArC2H5 + 2Na |
• C2H5-C2H5 бутан
Гомологи бензола получаются реакцией Фриделя-Крафтса-Густавсона алкилирова- нием сухих ароматических углеводородов галогеналкилами в присутствии катализаторов ( безводные кислоты Льюиса -AlCl3,FeCl3,SnCl4,BF3,ZnCl2).
Востановление ароматических кетонов (р-ция Клеменса)
Востановление ведут в присутствии амальгамы Zn в соляной кислоте.
Реакция Зелинского (1922г.). При пропускании ацетилена через нагретый активированный уголь обращается в бензол.
ch^ch 400-500C ► II
Химические свойства аренов
Ароматические углеводороды вступают преимущественно в реакции замещения, что характерно для насыщенных предельных соединений. В отличие от алкенов ароматические углеводороды с трудом вступают в реакции присоединения и окисления.
Наличие повышенной плотности отрицательного заряда по обе стороны от плоскости кольца, образуемого атомами С, является отличной особенностью молекулы бензола. Подобное экранированием электронами атомов С кольца будет защищать их от атаки нуклеофильными реагентами и, наоборот, облегчать возможность атаки электро- фильными реагентами. Таким образом, для ароматических углеводородов наиболее хорактерными являются реакции замещения. Кроме того, они могут вступать в реакции присоединения и окисления, а также могут происходить реакции за счет групп, связанных с ядром. Основной тип реакций в ароматическом ряду - реакции электрофильного замещения. В общем виде реакции SE представляет собой замещение протона (Н+) в бензольном кольце на электрофильную частицу (Е+). Необходимо иметь в виду, что, электрофильная частица образуется из реагента под действием катализаторов - кислот Льюиса или протонных кислот.
Механизм реакции электрофильного замещения. Все реакции электрофильного замещения (SE) в ароматическом ряду протекают по одному и тому же пути и начинаются с образования электрофильной частицы Е+.
1 стадия: образование электрофильной частицы Е+: А^Е + AlCl3 ^ Е+ + [AlCl4 - А] "
2 стадия: Образование п-комплекса. Арен-донор электронов, т.к. имеет легкополяри- зуемые п -электроны Е+- акцептор т.к. имеет вакантную орбиталь . п -комплекс образуется за счёт сил кулоновского взаимодействия.
3 стадия: Образование сигма-комплекса. На этой стадии Е+ вытягивает из кольца пару электронов и за счет неё образует сигма связь с одним из атомов С кольца этот атом из Sp2 -гибридизации переходит в Sp3 - гибридизацию и приобретает тетраэдрическое строение. Сигма комплекс сильная сопряженная кислота углеводорода , карбониевый ион, в котором 4Н электрона делокализованы на пяти атомах С. Его строение может быть представлено структурами:
Стадия образования сигма комплекса самая медленная, которая определяет суммарную скорость процесса. Сигма комплекс -неароматическая, неустойчивая система.
4 Стадия. Реароматизация, которая завершается выбросом Н+ от сигма комплекса и восстановлением ароматической структуры. Стадия протекает легко и быстро, так как энергетически выгодно.
5 Стадия. Регенерация катализатора. Н активная частица, присоединяется к [AlCl3 A] " и отщепляет от него А с парой электронов, образуя побочный продукт реакции НА и восстанавливая катализатор AlCl3. [AlCl4 - А] " + Н+ ^ AlCl3 + H-A
Правила ориентации в бензольном кольце. Заместители I и II рода Введение в бензольное ядро заместителей существенно меняет порядок связи и нарушает симметричность и равномерность распределения электронной плотности.
Если в бензольном ядре уже содержится какой-нибудь заместитель, то следующий заместитель замещает водород в строго определенном положении по отношению к первому, что зависит от природы и свойств первого заместителя.
Чрезвычайно важным типом влияния заместителей при ароматическом замещении является индуктивный эффект (-I,+I).
Помимо индуктивного влияния заместителей, при ориентации существенную и часто определяющую роль играют эффекты сопряжения. Это в особенности верно для заместителей, несущих на атоме, непосредственно связанным с ядром, одну или большее число неподеленных пар электронов. -ОН, -О-, -О-СН3, -ЫН2, -NH-C(O)-CH3 Все заместители, по своему ориентирующему действию делятся на две группы:
1) Заместители I-ого рода (электронодонорные заместители) - ориентанты 1 рода, ориентирующие вступающий заместитель в орто - и пара-положение. Эти атомы и группы атомов, обладающими электронодонорными свойствами, для них характерно в основном наличие о-связей.
В зависимости от силы индуктивного эффекта и эффекта сопряжения заместителя бензольное ядро может быть активировано или дезактивировано им, то есть его реакционная способность будет повышена или понижена. Так, галогены, обладающие большой электроотрицательностью дезактивируют все положения кольца: однако в момент реакции под влиянием реагента усиливается эффект сопряжения с участием электронов атома галогена в результате чего и наблюдается орто - и пара - ориентация. Очевидно, что -J индуктивный эффект галогенов достаточно силен для того, чтобы понизить реакционную способность ядра в целом, но недостаточен для того, чтобы определить ориентацию.
Остальные заместители I-ого рода являются электронноакцепторными, но в меньшей степени, чем галогены, и их индуктивный эффект полностью перекрывается эффектом сопряжения. Вследствие этого замещение при наличии таких заместителей ориентируется в орто - и пара - положение и сопровождается активацией бензольного ядра. Заместители (ориентанты 2-го рода, ориентирующие вступающий заместитель в мета - положение. Это группы атомов, обладающих электроноакцепторными свойствами. Эти заместители дезактивируют все положения ядра, причем дезактивация орто - и пара - положений больше чем мета - положения. Это происходит потому, что наиболее активными оказываются атомы углерода в мета - положении. Такое распределение электронной плотности затрудняет реакции замещения с электрофильными реагентами. Существуют пять основных типов заместителей в ароматическом ряду.
1) . Заместители, обладающие +I эф и не имеющие М эф., например алкильные заместители. Эти заместители направляют электрофильный агент в орто- и пара- положение и ускоряет реакцию Se. Положительный I эф. алкильных групп обусловлен различием электроотрицательности атомов С(2,5) и Н(2,1).
2) . Заместители, обладающие незначительным -I эф. и большим + М эф. Эти заместители сильно ускоряют реакции Se и ориентируют заместитель в орто - и пара- положение. -I эф. этих групп связан с большей электроотрицательностью атомов О и N по сравнению с атомом С. +М эф. групп ОН и NK2 обусловлен наличием неподелённых электронных пар у атомов О и N, они проявляют себя лишь тогда, когда они связаны с атомом С в Sp2 гибридизации.
3) . Заместители, обладающие большим -I эф. и небольшим + М эф. (F,Cl,Br,I) из за большого -I эф. затрудняют протекание реакции Se но направляют в о- и п- положения.
4) . +М эф. невелик, но он всё равно преобладает над -I эф. Заместители, обладающие - I эф. и -М эф. Эти заместители сильно затрудняют протекание реакций Se и направляют заместитель в М- положение. При введении групп с -I эф. и - М эф. наибольший дефицит электронной плотности возникает в о- и п- положениях, поэтому элект- рофильный реагент атакует М- положение.
5) . Заместители , обладающие - I эф., М эф. = 0. Эти заместители сильно затрудняют протекание реакции Se и направляют заместитель в М положение.
Кроме рассмотренных пяти типов заместителей имеются заместители смешанного действия, обладающие как +I эф., так и -I эф. (М эф.=0). К ним относятся: Эти заместители несколько затрудняют протекание реакции Se и образует смеси трёх изомеров.
Дизамещенные бензолы. В зависимости от типа заместителей и их взаимного расположения различают согласованную им не согласованную ориентацию.
Согласованная ориентация - такое расположение заместителей, когда они благоприятствуют введению третьего заместителя в одни и те же положения бензольного кольца.
1. Знаки Мэф. совпадают они находятся в м-положении по отношению друг другу. 2. Знаки М эф. противопорложны, но = 0, а заместители в о- и п- пположениях При несогласованной ориентации заместителей направление реакций определяет заместитель с +М эф.
Реакции присоединения. (Ade,Ad r) в жестких условиях. Образуется смесь галогенопроизводных, наиболее важным из которых является гексахлорциклогексан, используемый в качестве инсектицида.
Лекция 3
ГАЛОГЕНОПРОИЗВОДНЫЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ Галогенпроизводные углеводородов относятся к функциональным производным углеводородов, в которых один или несколько атомов водорода замещен атомами галогенов (F, CI, Br, J). Они являются реакционноспособными классами органических соединений, используя их, можно синтезировать спирты, тиоспирты, амины и др.
Классификация галогенпроизводных углеводородов В основе классификации галогенопроизводных углеводородов лежит атома углерода, с которым связан атом галогена. Т.е. в основу классификации положена гибридизация углеродного атома (Sp3, Sp2, Sp), связанного с галогеном. Таким образом, все галогенопроизводные углеводороды можно разделить на 3 группы:
1. Галогенпроизводные, в которых галоген связан с атомом углерода в Sp3 гибридизации.
2. Галогенпроизводные со связью Sp2 - галоген.
3. Галогенпроизводные со связью Sp - галоген.
Галогенпроизводные со связью sp - галоген:
Классификация, номенклатура, изомерия. К гим относятся:
А) галогеналканы. Они содержат один или несколько атомов галогена и могут отличаться природой галогена. Х= F, CI, Br, J
Б) пергалогеналканы, т.е. полностью галогенированы алканы СпХ2п+2 В зависимости от того, расположен ли галоген при первичном, вторичном или третичном углероде атоме, различают первичные, вторичные, третичные производные. Для некоторых галоген производных сохраняются тривиальные названия:
СНИ3- хлороформ CHJ3- иодоформ
CHBr3- бромоформ CH2=CH-CH2CI- аллилхлорид
Названия простейших моногалогенпроизводных часто производят от соответствующих одновалентных радикалов. Так, СН30 называется хлористым метилом или метил- хлоридом, С2Н^- йодистым этилом или этилиодидом. Название простых двухвалентных радикалов, получающихся отнятием двух атомов водорода от двух соседних атомов углерода, обычно производят от названий соответствующих алкилов, прибавляя к ним суффикс - ЕН: СН2CI-CH2CI - хлористый этилен. Названия радикалов, получающихся отнятием двух атомов водорода от одного крайнего атома углерода, имеют суффикс - иден: CH2-CHCI2 - хлористый этилиден.
Галогенпроизводные, у которых все имеющиеся в молекуле атомы водорода замещены на галоген, называются пергалогенпроизводными.
Для полностью фторированных соединений иногда используют вставку "фор", например: CF4 мет/фор/ан.
Изомерия
Для галогенпроизводных углеводородов характерны два вида изомерии: структурная изомерия, связанная с изомерией углеводородного скелета и различным положением галогена, и стереоизомерия (пространственная изомерия): оптическая и конформационная изомерия.
Оптическая и конформационная изомерия. Подобно алканам, галогеналканы могут содержать в молекуле ассиметрический атом углерода. Это возможно в случае различных галогенов или алкильных групп у одного атома углерода.
Для точного обозначения расположения заместителей у асимметрического атома углерода в пространстве (абсолютной конфигурации) применяется R, S - номенклатура, которая вошла в правила ИЮПАК. Для этой цели вводиться ряд старшинства атомов. В основе определения старшинства лежит атомный номер элемента. Таким образом, самым младшим атомом и заместителем является водород, затем идут Li, Be, B, C, N, O, F и т. д. В случае одинаковых атомов, связанных с асимметрическим центром, старшинство заместителя (группы) определяет "вторичная оболочка" атомов.
Для применения R, S, - номенклатуры молекула должна быть ориентирована в пространстве определенным образом. Глаз наблюдателя смотрит по оси углерод- младший заместитель, обычно это связь С-Н. После ориентации молекулы смотрят, как три заместителя располагаются в ряд в направлении от старшего к младшему. В случае R - конфигурации этот порядок соответствует направлению движения по часовой стрелке, в случае S - конфигурации - против часовой стрелки.
Способы получения
Галогенпроизводные углеводородов получают прямым галогенированием углеводородов, присоединением галогенов или галогенводородов к алкенам и алкинам, замещением кислородосодержащих или других групп на галоген.
Прямое галогенирование. Таким методом можно получить фтор-, хлор-, и бромуглеводороды. Прямое иодирование алканов неизвестно. Фтор с алканами реагирует очень энергично, даже специального оборудования взрывом, так как в реакции выделяется много теплоты (большая энергия связи С-Н). Поэтому для фторирования алканов, специальная конструкция реакторов с медными сетками для эффективного отвода теплоты реакции.
В качестве переносчиков фтора используют фториды металлов (CoF3, AgF2, MnF2), которые фторируют алканы. Так получают перфторалканы.
F2, C0F2
СПН2П+2 ------------- > CnF2n+2
Б) Хлорирование. Алканы реагируют с хлором под действмем УФ- облучения или температуры, которые инициируют образование свободных радикалов. Наиболее легко замещается водородный атом у третичного атома углерода, труднее - у вторичного атома. При хлорировании алкенов хлор обычно присоединяется к двойной связи. Только при 400-6000С осуществляется аллильное хлорирование.
r-ch2-ch=ch2 а„ ► R-CH-CH=CH + HCl 600 C Cl
В) Бромирование. Прямое бромирование для простейших алканов мало характерно. В принципе бромирование возможно при нагревании и облучении Уф-светом.
CnH2n+2СН2+В r+ HBr t hv
Реакции присоединения к алкенам и алкинам
Реакции идут легко, если X=CI2,Br2.Eora X=J2, то скорость реакции уменьшается. Присоединение фтора связано с выделением большого количества теплоты, поэтому процесс трудно управляем.
Реакции замещения кислородосодержащих или других групп на галоген
Используя различные галогенсодержащие реагенты, можно замещать галогеном атом кислорода в альдегидах, кетонах, группу-ОН в карбоновых кислотах и спиртах. Известны также реакции замещения одного атома галогена другим.
Замещение гидроксильной группы на атом галогена в спиртах происходит под действием галогеноводородов или галогенидов фосфора и серы. При получении хлоридов необходимо применение ZnCI2 в качестве катализатора.
R-CH2—OH + H-X . --R-CHrX + H2O
К эффективным реагентам относятся PCI3, PCI5, PBr3, PBr5, PJ3, SOCI2. Очень эффективным фторирующим реагентом является SF4 - тетрафторид серы.
Использование хлористого тионила имеет преимущество перед пентахлоридом фосфора, так как в качестве побочных продуктов образуются газы, они легко удаляются из сферы реакции.
Получение галогенпроизводных из альдегидов и кетонов. Эта реакция осуществляется при действии PCI5, PBr5 или SF4 при нагревании:
в) Получение галогенпроизводных из карбоновых кислот.
Карбоновые кислоты под действием PCI5 превращаются в хлорангидриды, которые только при нагревании под давлением дают трихлорпроизводные:
R-cf° PCl5 >■ R -ct° P?5 > R-CC1 OH Cl t
г) Взаимное замещение атомов галогена в галогенпроизводных. При взаимодействии галогенпроизводных с галогенидами металлов один атом галогена замещается на
другой. Реакция применяется для получения иод- и фторпроизводных, чаще всего
используются KJ и фториды сурьмы в смеси с пентахлоридом сурьмы SbF3+SbCl5.
KJ
R-CH2-CI + ------------ ► R-CH2-J + KCl
R-CH2-CI + SbFi+S b Cl5 > R-CH2-F Физические свойства Прочность связи С-Х (в кДж/моль) имеет следующие значения:
C-J C-Br C-Cl C-F
214 285 340 487
Прочность связи С-Н в алканах составляет 415-420 кДж/моль. Наиболее реакционноспособными являются иодпроизводные, а фторпроизводные - самые прочные соединения этого класса.
Химические свойства и применение отдельных представителей Для галогенпроизводных характерна высокая реакционная способность.
Благодаря электроотрицательности атома галогена они легко вступают в реакции с металлами (М) и различными нуклеофильными реагентами, что ведет к реакциям замещения атома галогена, отщепления галогенводорода. Известны реакции замещения атома галогена водородом.
'
| R-CH2-CH2-*X |
| алканы или HJ |
CH=CH R- CHrCHrNu: + X
Рассмотрим более подробно приведенные выше реакции.
Замещение галогена атомом металла Галогенпроизводные углеводородов реагируют с металлами, в результате чего получаются металлорганические соединения или продукты их дальнейшего превращения. Так при взаимодействии с металлическим натрием протекает реакция Вюрца. В качестве промежуточных соединений возникают свободные радикалы и натрийорганические соединения.
Взаимодействие галогенпроизводных с магнием в растворе диалкиловых эфиров ведет к образованию магнийорганических соединений (реактивов Гриньяра).
- +
Замещение галогена при взаимодействии с нуклеофильными реагентами Воздействие нуклеофильных реагентов (анионов и нейтральных молекул с неподеленными парами электронов) на галогенпроизводные углеводородов ведет к замещению атома галогена. Эту реакцию называют реакцией нуклеофильного замещения у насыщенного углеродного атома и обозначают символом Sn (S от англ. substitition - замещение, N - нуклеофильное).
Оказалось, что существуют реакции Sn, скорость которых не зависит от концентрации нуклеофильного реагента (реакции первого порядка). В то же время скорость многих реакций Sn зависит от концентрации как нуклеофильного реагента, так и галогенпроизводного (реакции второго порядка). Таким образом, было обнаружено, что возможны два механизма Sn SN 1 - реакция первого порядка - мономолекулярное нуклеофильное замещение - протекает асинхронно в две стадии. Первая - ионизация галогенпроизводного - является медленной стадией. В результате ионизации могут оброзоваться ионрые пары (тесные или сольваторазделенные:
R—CH2—»Х; - w r-ch2 = X
" карбкатион
Вторая стадия - взаимодействие с нуклеофильным реагентом протекает быстро:
R-CH X + :NU быстро » R—CH2—Nu! + ! X Общую скорость реакции S" лимитирует медленная стадия - ионизация. Поэтому скорость реакции не зависит от концентрации и типа нуклеофильного реагента. Такие реакции называют мономолекулярными и обозначают символом SN1, скорость реакции прямо пропорциональна концентрации субстрата V=K. (субстрата, т. е. R-X)
Реакция второго порядка является более общим случаем. Оба компонента - галогенпроизводное и нуклеофильный реагент - вступают в реакцию одновременно.
| 1. Диссоциацуия, ионизация |
| 2.Н уклеофильная атака |
| Скорость реакции определяется как концентрацией и типом нуклеофильного реагента, так и концентрацией галогенпроизводного. Такие реакции называют бимолекулярными и обозначают символом SN2. Скорость реакции прямо пропорциональна концентрации субстрата и реагента V=K (субстрата, R-X) [реагента]. Образование переходного состояния возможно при атаке нуклеофилов положительно заряженного атома углерода субстрата со стороны противоположной уходящей группе. Весь процесс замещения осуществляется в одну стадию. Течение реакции по механизму SN2 облегчается с увеличением частичного положительного заряда на атакуемом атоме углерода, а также если подход реагента к углеродному атому пространственно не затруднен. Это наблюдается в случае первичных (и вторичных) галогеналкилов. Подход реагента к углеродному атому у третичных галогеналкилов пространственно затруднен (из-за объемных заместителей) и реакция нуклеофильного замещения будет протекать по SN1-механизму, т. е. в две стадии. Для установления механизма реакции SN, кроме исследования кинетики, т.е. изучение зависимости константы скорости реакции от концентрации реагирующих веществ, часто используется стереохимический результат реакции. Реакция SN2 принадлежит к стереоспецифическим реакциям. Реакция называется стереоспецифической, если исходные вещества превращаются стереоизомерно разные продукты, т. е. R- изомер превращается в S-изомер и наоборот. Так, если взять в реакцию оптически активный 2-хлорбутан (R-изомер), то после его гидролиза происходит "обращение конфигурации" и образуется S-изомер спирта. н I -C \ |
| V=K RHal] [OH ] Способность алкилгалогенидов (R-X) вступать в реакции SN2 зависит от R и от природы галогена (X) . Для одного и того же "х" скорость реакции в ряду уменьшаетс Rперв. > Rвтор. > Rтрет. Мономолекулярное нуклеофильное замещение (асинхронное) SN1 - идет в две стадии. Стереохимический результат реакции - рацемизация. |
| н О C...C1 |
| О HO. / c2hs ch, c2hs переходное состояние S или L-изомер |
| не |
| ch. |
| не' * |
| н,е е2н, R- или D-изомер |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|