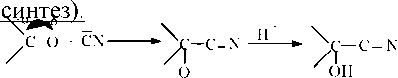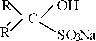- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СИз-C-Cl + 2 H-NH2 —*• CH3-C-N(CH3)2 + HCl 5 страница
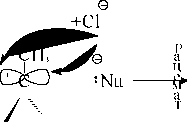
| Н С2Н5 плоский карбкатион |
| СНз I 3 |
| С*С1 |
| / |
| Н С2Н5 R,D- изомер |
| СзН |
| НзС |
| "1 |
| С2Н5 Н I |
| Ы^С / С2Н5 |
| 50% S,L-изомер |
| 50% R,D -изомер |
V=K[ R-На^
Тенденция R-X вступать в реакцию SN1 зависит от природы R и от уходящей группы Х. Для одного и того же "Х" скорость уменьшается в ряду: аллил > бензил> R трет.> R втор.> R перв.
В каждой конкретной реакции нуклеофильное замещение осуществляется по обоим механизмам, только сравнительные скорости реакций могут сильно отличаться. В
отдельных случаях получается не первый и не второй порядок реакции, а какой-то дробный, из которого можно вычислить отдельно скорости по SN1 и SN2.
В протонном растворителе нуклеофильность аниона тем больше, чем больше размер аниона. Объясняют это различием энергии сольватации галоген - ионов.
Общий порядок реакционной способности нуклеофилов в протонных растворителях следующий.
©©©о е©
HS , RS > J > Br > RO > Cl > CH3-cCs > O-N'
меркаптид иодид бромид алкоксид хлорид ацетат O нитрат ^О
Если протонный растворитель заменить биполярным апротонным (ДМСО, ДМФА), то и порядок нуклеофильности изменится. Например, в диметилформамиде (ДМФА) порядок нуклеофильности для галогенов становится следующим:
0 0 0 Cl > Br > J
Объясняют это тем, что апротонный растворитель не способен сольватировать анионы за счет образования водородных с ним. Благодаря этим обстоятельствам небольшой анион богаче энергией, чем большой, и является более сильным нуклеофилом.
На скорость реакции нуклеофильного замещения, кроме силы нуклеофила, природы растворителя, оказывает влияние и природа уходящей группы.
Необходимо учитывать, что сильные основания обычно бывают плохими уходящими группами. К их числу относятся, например,
OH NH? RO0 R2N Ch3 H
Существует обратное отношение между основностью частицы и ее способностью быть уходящей группой. Если соединение является сильной кислотой (например, НА), то отвечающий ей анион (например, А) будет слабым основанием. Например, NH3 - слабая кислота, ее анион NH2 - сильное основание. В органическом синтезе реакции нуклеофильного замещения используются очень широко.
Реакции отщепления, элиминирования /Е/
Отщепление представляет собой процесс, обратный присоединению к двойным связям алкенов. В результате реакции отщепления образуется алкен и две более мелкие молекулы. Один из способов классификации реакций отщепления состоит в использовании греческого алфавита для обозначения атомов скелета, связанных с уходящими группами. Например, в 1 - хлорбутане, атом углерода, связанный с хлорм обозначают "а" соседний сним в, у, 6 и т. д. Если наряду с хлором отщепляется атом водорода, связанный с "а" углеродом, то говорят об а - элиминировании (отщеплении), если "Н" отщепляется в в -положении, то в - элиминирование и т. д.
Реакции в - элиминирования являются конкурирующими для реакций нуклеофильного замещения. Аналогично реакциям SN могут протекать по двум различным механизмам: Е№2 - бимолекулярное элиминирование (отщепление) и Е№1 - мономо- лекулярное отщепление. Реакция отщепления, как правило, идет при действии сильных оснований, т. е. нуклеофильных реагентов, поэтому буква "N" часто опускается.
Механизм этой реакции заключается в том, что атакующее основание ОН отрывает протон от в-углерода однрвременно с образованием двойной связи и уходом хлорид- иона от а-углеродного атома.
Для R-X с данной группой R скорость отщепления изменяется в зависимости от Х в следующем порядке:
J > Br > Cl > J
При одном и том же "Х" скорость отщепления изменяется: третичный R > D вторичный R > первичный R. Пространственные препятствия оказывают на Е2-реакции слабое влияние по сравнению с реакциями SN2 и отщепление в случае третичных галогеналкилов проходит легко.
Для проведения Е2 реакций обычно требуются сильные основания. В ряду оснований эффективность изменяется параллельно их силе.
СПИРТЫ И ФЕНОЛЫ. СТРОЕНИЕ, ИЗОМЕРИЯ, НОМЕНКЛАТУРА
Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами (ОН) называют спиртами или алкоголями.
Подобно предельным углеводородам, одноатомные спирты образуют гомологические ряды. Общая формула предельных спиртов - СпНгп+iOH.
В зависимости от характера углеродного атома, при котором находится гидроксил, различают первичные, вторичные и третичные спирты.
Изомерия. Номенклатура
Изомерия спиртов зависит от строения углеводородной цепи и положения гидроксила в цепи.
В основе названия спирта лежит наименование углеводорода, наличие же гидроксильной группы указывается окончанием -ол, с цифрой за ним, указывающей номер атома углерода, при котором стоит гидроксил. При этом углеродная цепь нумеруются таким образом, чтобы гидроксил имел самый малый номер.
При наличии в соединении более старших заместителей (функций) гидроксильная группа обозначается префиксом гидрокси-. Наличие в соединении двух или более гидроксильных групп обозначается соответственно окончаниями -диол, -триол и т.д.
Способы получения
Одним из общих способов введения гидроксильной группы в молекулы органических соединений является гидролиз галогенпроизводных углеводородов в присутствии водных растворов щелочей. Щелочи ускоряют процесс и, нейтрализуя образующуюся кислоту, делают его необратимым.
Способность галогенуглеводородов к гидролизу зависит от природы галоида и от того, с каким углеводородным атомом он связан. По легкости замещения галоиды располагаются в следующий ряд:1>Бг>С1>Е , т.е. легче всего гидролизуются иодиды.
Синтез спиртов осуществляется действием металлорганических соединений на альдегиды и кетоны.
 A J
A J
CR (1)
R R
Полученное соединение (1) магнийбромалкоголят легко подвергается гидролизу с образованием соответствующего спирта.
R \ hoh R ^
R— С — OMgBr------- ► R С—OH + HOMgBr
r' R^
в) При взаимодействии реактивов Гринъяра со сложными эфирами образуются третичные спирты.
СНз-C -OMgBr HOH CH3—C —OH + HO -MgBr
C2H5 C2H5 C2H5 C2H5
г) Рациональным способом получения ароматических спиртов является реакция метал-
лорганических соединений с ароматическими радикалами с органическими окисями.
HOH
C6 H5 MgBr + CH2-CH2--------------- ► C H-CH2-CH2-OMgBr—►
----- ► C6H5-CH2-CH2-OH + Mg (OH )Br
д) В промышленности 2-фенилэтанол-1 выгоднее получать взаимодействием бензола с окисью этилена в присутствии кислоты Льюиса в качестве катализатора ^ AlCl3 /CH2CH2OH
Спирты также получают гидратацией (присоединением воды) этиленовых соединений. Реакция протекает в присутствии катализаторов: серная или фосфорная кислоты.
Восстановлением альдегидов, кетонов и сложных эфиров водородом в присутствии катализаторов: Ni, Co, Pt, и др. При восстановлении альдегидов и сложных эфиров - первичные спирты, из кетонов - вторичные спирты.
Альдегиды в промышленности получают оксосинтезом, то есть гидрированием
оксида углерода и карбонильных соединений на катализаторах.
Этерификация
Спирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:
СН3+-СН2oH-t-Ho|-NO2^СН3- СН2"^ -N02
СН3 - СН2~ O^ SO3 H—- СН3- СН2- O- so3h -i-ho - с -СН3—-
СН3 - СН2 O - с- СН^ H2SO4
этилацетат
Скорость образования сложных эфиров, как показал Н.А. Меншуткин, при действии одной и той же кислоты для первичных спиртов в два раза больше, чем - для вторичных и в 20 раз больше, чем для третичных.
Реакции с участием С-О связи.
Замещение гидроксильной группы на галоген. Гидроксильная группа спиртов способна замещаться галогеном при взаимодействии спиртов: а) с галогеноводородными кислотами; б) с галогенидами фосфора; в) с тионилхлоридом.
Дегидратация
При действии на спирты водоотнимающих средств происходит межмолекулярное или внутримолекулярное отщепление воды. Водоотнимающими средствами являются кислоты (H2S04, Н3РО4, НСООН, щавелевая кислота и другие), окиси (А12Оз, Th203) и другие, некоторые соли (CuS04, ZnC12 и т.д.). При межмолекулярной дегидратации спиртов получаются простые эфиры: R-OH + HO-R' ^ R-O- R'
В случае внутримолекулярной дегидратации спиртов, на тех же катализаторах, но при более высокой температуре, образуются непредельные углеводороды. При этом водород отщепляется от менее гидрогенизированного атома углерода, находящегося по соседству с углеродом, несущим гидроксильную группу (правило Зайцева).
Реакции отщепления воды могут проходить по Е1 и Е2 механизмам в зависимости от строения спирта и условий реакции. Дегидратация третичных спиртов в присутствии кислот идет по Е1 механизму.
Окисление
Спирты окисляются кислородом воздуха в присутствии медных и других катализаторов при 300-500°С, такими окислителями как хромовая смесь, KMnO4 и другие, а также дегидрируются при 100-180°С над Си, Ag, Ni, Pt, Pd. Во всех случаях первичные спирты дают альдегиды, вторичные кетоны. Третичные спирты окисляются очень трудно с разрывом углеводородного скелета и образованием смеси кислот и кетонов.
Многоатомные спирты
Производные углеводородов, в которых два или несколько атомов водорода замещены на гидроксильные группы, называют двух или многоатомными спиртами. Двухатомные спирты называются гликолями.
Г ликоли могут быть получены аналогично одноатомным спиртам и другими способами. Здесь рассмотрим важнейшие из них.
Гидролиз дигалогенпроизводных предельных углеводородов или хлоргидринов:
Г идратация-окисей:
/°\ н + сн2-сн2 +Н2° --------- H°CH-CH2°H
Восстановлением эфиров дикарбоновых кислот:
CH2-COOC2h5 4H2 cH-CH-OH
I »- I 2 2
сн2 соос2н 5 LiAlH4 CH^CH^OH
В отличие от одноатомных спиртов гликоли образуют гликоляты и с некоторыми оксидами нещелочных металлов, например с гидроксисдом меди, что говорит о более кислом характере протона ОН группы:
CH^OH CH _O\ .. O-CH2
2 I [1]--------------------- + Cu (OH)_ - I 2 \х/ I 2
2 1 ' Cu ' I + H0°
CH-OH ch-o/ xo-ch2 2
Дегидратация гликолей может иметь внутримолекулярный и межмолекулярный характер. Направление отщепления воды зависит от условий реакции.
Образование глицератов меди.
CH2-OH
I
CH _ OH + Cu(ОН)2 ► CH — OH Cu CH—OH + H,O
I = I / \ I 2
CH-ОН CH^O O-CH2
то есть кислые свойства у глицерина выражены сильнее, чем у одноатомных спиртов.
При действии водоотнимающих средств, таких как KHSO4 MgSO4 (безводная) получается акролеин.
CH^OH MgSO4 CH2
CH-OH ► CH
I -2H2O I
CH^OH CH=O
АЛЬДЕГИДЫ И КЕТОНЫ. СТРОЕНИЕ, ИЗОМЕРИЯ, НОМЕНКЛАТУРА
АЛЬДЕГИДОВ И КЕТОНОВ Альдегиды и кетоны представляют собой производные алканов в молекулах которых два геминальных атома водорода, замещены на кислород (или оксо-группу). Часто альдегидлы и кетоны объединяеют под общим названием карбонильных соединений, в молекулах которых имеется одна и таже функция: кислород, связанный двойной связью с атомом углерода.
Различие между строением альдегидов и кетонов проявляется в характере связи карбонильной группы в молекуле. Альдегидами называют соединения с карбонильной группорй, в которых атом углерода этой группы связан по крайней мере с одним атомом водорода. Кетонами на зывается карбонилсодержащие соединения, в которых углерод карбонильной группы связан с двумя углеродными радикалами
Характерное для альдегидов сочетание карбонильной группы с водородом называют альдегидной группой, а карбонильную группу кетона называют кетогруппой.
Номенклатура ЮПАК.
По номенклатуре ЮПАК название ациклических альдегидов иобразуют путем добавления окончания АЛЬ или ДИАЛЬ (для диальдегидов) к названию углеводорода, соответствующего главной цепи. Нумерацию начинают от углеродного атома, принадлежащего альдегидной группе. В названии номер при альдегидной группе не ставится. Названия циклических альдегидов образуют, добавляя окончание КАРБАЛЬДЕГИД
Если в соединении имеется другая группа, имеющая преимущество по старшинству, то альдегидную группу ^называют ФОРМИЛ- или ОКСО-.
CH3-CH2-CH2-CH—CH2-COOH 3- формилгексановая кислота И_ C_ CH2_COOH 3- оксопропионовая кислота
O
Названия ациклических кетонов по ЮПАК образуют из названия соответствующих углеводородов, прибавляя окончание -ОН или -ДИОН (для дикетонов); цифрой указывают номер атома карбонильной группы. Нумерацию начинают от ближайшего к кетонной группе конца цепи.
Если в циклической системе группа -CH2 - замещена на группу >С=О , то к названию циклической системы добавляется окончание -ОН.
Изомерия
Альдегиды и кетоны изомерны друг другу.
Изомерия кетонов обусловлена изомерией радикалов и изомерией положения карбонильной группы и начинается с кетонов состава C5H10O.
Изомерия альдегидов зависит от изомерии радикалов, связанных с альдегидной группой и начинается с альдегида состава C3H7-CHO.
Способы получения
1. Окислением и каталитическим дегидрированием спиртов. При этом первичные спирты дают альдегиды, вторичные - кетоны.
+ 1/2 O2 Сг20з уО
R-C' + H2O
Cu, 3000 H
R-CH2-OH
H2 „О ■
—г R-c' + H2
Cu, 200 H
| R |
| 0 / Cu, 300 r/ |
| ,C=0 + H2O |
| +1/2 О2 |
| 0 / Cu, 200 r/ |
| c=o + H |
| - H |
| R |
| Ch-oh |
органических соединений. Реакционная способность карбонильных соединений определяется наличием карбонильной группы ( С=О ). Благодаря поляризации связи С=О, углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно, атом кислорода является нуклеофилом.
С другой стороны, поляризация связи С=О приводит к увеличению подвижности атомов водорода при атоме углерода, находящемся в a-положении к карбонильной группе. Следовательно, для карбонильных соединений характерны два типа химических превращений:
1) . Реакции нуклеофильного присоединения AdN с участием карбонильной группы.
2) . Реакции по a-водородному атому к карбонильной группе: галогенирование, конденсация.
Альдегиды и кетоны различаются по целому ряду свойств.
Например: альдегиды легче вступают в реакции:
1) Нуклеофильного присоединения.
2) В реакции окисления, которые протекают без изменения углеродной
цепи, в то время как кетоны окисляются с разрывом углеродной цепи.
3) Полимеризуются под влиянием кислот.
4) Дают окрашивание с фуксинсернистой кислотой.
Кетоны не способны к превращениям 3,4.
Различия в реакциях нуклеофильного присоединения (AdN) для альдегидов и кетонов, по-видимому, объясняются совместным действием электронных и пространственных факторов. Рассмотрим строение карбонильной группы.
Атом углерода карбонильной группы связан с тремя другими атомами - связями, используя sp2 гибридизацию. Таким образом, они расположены в одной плоскости под углом 1200 друг к другу. Оставшаяся р-орбиталь атома углерода перекрывается с р- орбиталью кислорода, образуя п- связь.
При нуклеофильном присоединении углеродный атом, связанный с кислородом, переходит из sp2 гибридизации (тригональной) в sp3 гибридизацию ( тетраэдрическую).
Кетоны, содержащие вторую алкильную группу, создают пространственные затруднения при нуклеофильной атаке и возникновению переходного состояния; с другой стороны, алкильные заместители, обладающие положительным индукционным эффектом, дестабилизируют переходное состояние.
Диальдегиды и дикетоны, содержащие в одной молекуле две карбонильные группы, обладают всеми свойствами альдегидов и кетонов и могут реагировать как с участием одной, так и двух карбонильных групп.
Присоединение синильной кислоты с образованием циангидринов (циангидринный
|
|
Синильная кислота малодиссоциирована, поэтому в качестве катализатора применяют основной катализатор, чтобы увеличить диссоциацию. При этом образуется циан-анион (сильный нуклеофил).
Присоединение бисульфита натрия.
|
|
+ » R CH—SONa
OH
|
|
| + S^^Na |
|
|
При присоединении бисульфита натрия к карбонильным соединениям образуются кристаллические вещества, называемые бисульфитными производными альдегидов и
кетонов. Данная реакция используется для качественного определения альдегидов и кетонов, для их выделения и очистки. Так, при нагревании с раствором соды бисуль- фитные производные разлагаются с выделением свободного альдегида или кетона.
Реакции альдегидов с реактивами Гриньяра приводят к образованию спиртов: первичных и вторичных, кетоны образуют третичные спирты.
Присоединение спиртов (синтез полуацеталей).
RC=O RO—H '• образуется сильный нуклеофил H(R) Kt\°H - алкоксил OR
| H + |
H(R) H(R)
+ полуацеталь
HO^ h°r
R-C-OR -&°^- R-C-°r'
H(R) H^° H(R) H(R)
°R" ,
------- ..R^-OR
H(R)
ацеталь
Реакция с пятихлористым фосфором. При действии РС15 (РВг3) на альдегиды или кетоны кислород карбонильной группы замещается двумя атомами галогена:
CHjC=0 + РС15 ► CH3CHCl2+ POCl3
H
CH3C=O + РС15 СН3СС12СН3+ РОС13
СН3
Присоединение аммиака, гидроксиламина, гидразина и его производных.
Реакции нуклеофильного присоединения-отщепления с замещением карбонильного кислорода. Присоединение аммиака позволяет различить альдегиды и кетоны. Альдегиды выделяют воду, образуя альдимины:
NH3
O I
CH3-С<^ + :NH3 ► CH3-С — O •« »
nh2'~\ pH
CHr С\ OH----------- - CH 3 CH =NH
I —H2O H
Альдимины легко циклизуются. Наиболее важное значение имеет реакция формальдегида с аммиаком с образованием гексаметилентетрамина -уротропина, синтезированного впервые А. М. Бутлеровым.
/СН\
N )n -1
6H2С - O + NH3 ^(CH2)6N4 - [C^cH
ch2 I ch2
\2CH2CH2
N
С гидроксиламином, гидразином и его замещенными: фенилгидразином, семикарба- зидом, альдегиды и кетоны, выделяя воду, образуют оксимы, гидразоны, фенилгидра- зоны и семикарбазоны. Это кристаллические вещества. Они служат для качественного и количественного определения карбонильных соединений, а также для их выделения и очистки. Под действием разбавленных кислот все эти соединения, присоединяя воду, выделяют исходные соединения:
H2N-NH2 ^C =N_NH2
H2N-NH- C6H5 =N-NH-C6H5
H2N-NH- CO-NH2 )c =N-NH- CO-NH2
Гидразоны под действием твердых едких щелочей разлагаются с выделением азота и предельных углеводородов. Эта реакция позволяет перейти от альдегидов и кетонов к предельным углеводородам. Это реакция Кижнера:
R\ / KOH R, t
/С =N-NH2------------ ►
Альдегиды восстанавливаются в первичные, а кетоны во вторичные спирты либо в результате каталитического гидрирования, либо путем использования таких восстановителей, как алюмогидрид лития LiAlH4 и боргидрид натрия NaBH4.
H2(Ni,Pt,Pd)
| / |
Альдегиды легко окисляются в карбоновые кислоты с таким же, как в исходном альдегиде, числом углеродных атомов:
R_ С =O lol /Р
| --------------- R-^\OH
H Kt
Кетоны не окисляются слабыми окислителями, а под действием сильных окислителей их молекулы распадаются, образуя кислоты (иногда кетоны) с меньшим числом углеродных атомов. Различное отношение к действию слабых окислителей используется для качественного открытия альдегидов ( в отличие от кетонов ). Так, альдегиды окисляются аммиачным раствором оксида серебра (реакция серебряного зеркала), а кетоны не окисляются оксидом серебра и этой реакции не дают.
™ ^ г\ , А гл NH4OH „ 2 Л I
R- С=° + Ag2° R“ С^Ш4 + 2Ag
H
Ag(NH3)2OH
Кетоны окисляются труднее по правилам, установленным Поповым. Если кетонная группа связана с двумя одинаковыми первичными радикалами, то разрыв углеродной цепи возможен с двух сторон от карбонильной группы:
1 2
СН3-СН2- С _CH2-CH3KMnQ4 CH3-CH2-COOH+ CH_COOH
о
Однако, если радикалы разной длины, то группа СО останется с наиболее коротким радикалом.
лп ^ _ ^ТТ KMnO4
C С CH Hсн 3-COOH+ CHjCOOH
о
Если один радикал первичный, а другой вторичный, то цепь рвется со стороны вторичного радикала.
Сн-Сн_С_снз KMnO СНз_с = о + CH3-COOH
СНз о СНз
Если один радикал третичный, то С=О группа останется с ним.
СНз CH3 ' KMnO4 С 3 CH_ С - ([^-СНг-СНз СНз- С -COOH + CH3_COOH
СНзО Снз
Альдегиды, особенно, их низшие представители, очень склонны к реакции полиме- ризациит в результате разрыва двойных связей альдегидных групп.
| n CH 2= O Формальдегид |
СН-кислоты. Реакции карбонильных соединений с участием а-водородных атомов. Реакции галогенов с карбонильными соединениями.
При действии галогенов на альдегиды и кетоны происходит замещение атомов водорода в а- положении к карбонильной группе на галоген.
| CH 3С-CH3 С12 O |
| СН2С1-С -CH3 + HCl о |
Альдольная и кротоновая конденсации.
Реакциями конденсации называются различные процессы удлиннения цепи (уплотнения органических молекул), приводящие к образованию более сложных соединений, в результате возникновения новых связей между углеродными атомами.
В реакцию вступают две молекулы, одна из которых реагирует свободной карбонильной группой, а другая- углеродным атомом, содержащим подвижный атом водорода в а-положении к карбонильной группе. Гидроксильный ион отрывает протон от а-углеродного атома молекулы альдегида или кетона, образуя сильный нуклеофил (енолят-анион), который атакует электрофильный углерод второй молекулы альдегида. В результате возникает новая С-С-связь, и образуется вещество, содержащее одновременно альдегидную и спиртовую группы: Это вещество было названо альдолем (альдегидо-алкоголь), а конденсация - реакцией альдольной конденсации. В альдольной конденсации могут участвовать молекулы разных альдегидов и кетонов. Кетоны вступают в реакцию,главным образом, за счет атомов углерода и водорода, находящихся в а-положении к карбонильной группе, сама же карбонильная группа кетонов в этих реакциях значительно менее активна, чем карбонильная группа альдегидов. Процессы альдольной конденсации имеют большое значение в природе: в частности, таким путем в растениях образуются молекулы углеводов. При соответствующих условиях реакция альдольной конденсации не останавливается на образовании альдоля; она может идти дальше при нагревании с отщеплением воды за счет подвижного а -водородного атома и гидроксила при в-углеродном атоме с образованием непредельного альдегида. От названия образующегося кротонового альдегида конденсация молекул карбонильных соединений, протекающая с выделением воды и образованием непредельных карбонильных соединений, получила название кротоновой конденсации. _
°н + CH_C=O------------------- >► CH_ C =O
HOH
| R_C_CH2_C=O H H |
| R_C=O I |
| CH^C=O + H |
| H |
| OH I
|
Лекция 4
КАРБОНОВЫЕ КИСЛОТЫ
Карбоновые кислоты являются реакционноспособным классом соединений. На их основе можно получить сложные эфиры, амиды, нитрилы и другие классы соединений. Многие представители карбоновых кислот и их производные находят широкое применение в народном хозяйстве, в медицине, в кожевенной промышленности, в пищевой промышленности. Как исходные мономеры в синтезе полимерных волокон, смол (орлон, нитрон) - исходным сырьем используется нитрилакриловой кислоты - НАК, получают орг. стекло на основе эфиров метакриловой кислоты и т.д.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|