- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СИз-C-Cl + 2 H-NH2 —*• CH3-C-N(CH3)2 + HCl 2 страница
Стереоизомерия моноз Природной D-глюкозе соответствует синтетический антипод- L-глюкоза.
CHO CHO
H—C~OH HO“C“H
HO“C“H h—C OH
h_c OH HO“C“H
h_c OH HO“C“H
CH2OH CH2OH
D-глюкоза L-глюкоза
Хотя альдегидные и кетонные формулы строения моносахаридов и хорошо объясняли многие реакции этих веществ, они не могли объяснить некоторые факты.
I. Альдогексозы, вступая в реакции, характерные для альдегидов (окисление, присоединение HCN), не обнаруживают некоторых альдегидных реакций, например, не образуют бисульфитного соединения с NaHSO3.
II. При стоянии свежеприготовленных растворов моносахаридов изменяется угол вращения плоскости поляризации света. Это явление называется мутаротацией.
III. Одна из пяти спиртовых гидроксильных групп глюкозы оказывается наиболее реакционноспособной.
Все эти факты становятся понятными, если принять что в растворах моносахаридов большинство их молекул содержится в виде таутомерных циклических форм,
представляющих собой внутримолекулярные полуацетали многоатомных альдегидо- или кетоспиртов. В дальнейших работах было показано, что такие моносахариды, как глюкоза, манноза, галактоза образуют шестичленные циклы, тогда как фруктоза, находится в форме пятичленного цикла.
При образовании циклического полуацеталя (полукеталя) карбонильный
углерод становится хиральным (асимметрическим) центром. Следовательно, каждый ациклический стереоизомер образует два циклических. Их называют аномерами, а новый хиральный центр - аномерным центром. Для указания его конфигурации используют обозначение а ив, связанные с взаимной ориентацией заместителей у аномерного центра и у С-атома, определяющего принадлежность к Д - или L- ряду.
Обозначение а получает тот аномер, в котором ОН- группы аномерного центра и С-атома, по которому определяется DL-конфигурация находятся по одну и ту же сторону от углеродной цепи в проекционной формуле Фишера. Если же эти группы находятся на противоположных сторонах, то такой аномер получает обозначение р. Префиксы а, р используют только в сочетании с конфигурационными префиксами (D, L).

| и—C-OH HO—C~ H И-C_OH H C OH |
| C --------------------------------------- C |
| HO—C“H HO C h h—C OH H_c OH |
HO—C—H
H—C—OH
H—C—OH
| CH2OH |
a-D-глюкопираноза
| P-D глюкопираноза |
| D-глюкоза |
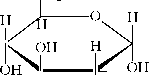
В циклических формах моносахаридов почти всегда имеются пяти или шестичленные кольца, включая атом кислорода. Для указания размера колец две последние буквы названия моносахарида (“за”) заменяют на окончание “фураноза” в случае пятичленного кольца, “пираноза” в случае шестичленного кольца. Фуранозные циклы почти плоские, у пиранозных наиболее устойчива конформация “кресла”. Проекции Фишера очень удобны для установления связи между структурой и названиями моносахаридов и их производных, однако, они не дают представления о действительной форме колец. Для этих целей получили распространение формулы Хеуорса:
| C"2O"
I I " O" |
a-D-глюкопираноза
В формуле Хеуорса кольцо нужно представить почти перпендикулярно к плоскости бумаги, а связанные с углеродными атомами заместители выше или ниже плоскости кольца. Значит, группы, стоящие справа в проекции Фишера, находятся в формуле Хеуорса ниже кольца, за исключением заместителя у С-атома, связанного с кольцом. У него группы, стоящие слева, оказываются внизу кольца. Для моносахаридов а-ряда ОН-группа аномерного центра D - конфигурации находится под кольцом, при р- конфигурации над кольцом. Для моносахаридов L-ряда отношения обратные: ОН- группа аномерного центра над кольцом отвечает а-аномеру, под кольцом р-аномеру. а- D и а-L формы (соответственно, р-D и р-L- формы) являются энантиомерами, т.е. зеркальными изомерами друг относительно друга.
| H |
Образование а и р циклических аномерных форм из цепной молекулы (циклоцепная таутомерия) лежит в основе явления мутаротации. Так, при растворении чистой
в воде через некоторое время появляется молекулы с
a-D-глюкозы ([a]D20 = +1130)
| это с 1130 до 520. |
Способы получения моноз В природе в зеленых растениях углеводы образуются в результате фотосинтеза, который представляет собой процесс химического связывания или “фиксации” углекислого газа и воды за счет использования энергии солнечных лучей растениями.
св ет
x CO2 + x H2O — ► (CH2O) + xO2 .
зеленые растения x
Первый синтез сахаристого вещества (моносахарида) был проведен А.М. Бутлеровым из формальдегида с использованием в качестве катализатора гидроксида кальция Са(ОН)2. Реакция осуществляется в несколько стадий.
н н н н н н н н н н н н н н н
„1111 сн2о .............................. сн2о
------ ► н—с—с—с—с=о- н_с_с_с_с_с=о ^*-н—с—с—с—с—с—с=о
III I I I I I I I I I
ононон онононон ононононон
В природных условиях - в клетках растений эта реакция альдольной конденсации регулируется ферментами. Главным источником получения моносахаридов, имеющих практическое значение, являются полисахариды. Так, глюкозу получают в большом
количестве гидролизом крахмала. (С6Н10О5)П + пН2О---------- > пС6Н12О6
Химические свойства Для моносахаридов характерны реакции, свойственные спиртам, альдегидам и кетонам, так как в молекулах простых сахаров содержатся гидроксильные и в скрытом виде карбонильные группы. При взаимодействии моносахаридов с различными веществами реакции могут протекать:
1. по карбонильной группе
2. по гидроксильным группам
3. с изменением углеродного скелета молекулы
Реакции, характерные для карбонильной группы
а) Моносахариды и полисахариды со свободными карбонильными группами являются довольно сильными восстановителями. Альдегидная группа сахаров окисляется при действии фелинговой жидкости, солей серебра (реакция серебряного зеркала) или ртути и других окислителей в альдоновые кислоты.
| н -он -н -он -он |
| н- НО н- Н- |
| СН2ОН глюкоза (альдоза) |
|
| + 2СиОН + Н20 желтая |
| Си20 + Н20 красная |
| (альдоновая) кислота |
| 2 Си(ОН)2 “ |
| Глюкоза + 2AgOH |
| -> |
| б) При окислении альдоз азотной кислотой окисляются и карбонильная и первичная спиртовая группы и образуются двухосновные кислоты.
|
D- галактоза слизевая кислота
в) Очень важной реакцией, позволяющей судить о строении сахаров, является взаимодействие их с фенилгидразином. При этом образуются озазоны - кристаллические вещества ярко-желтого цвета с четкой температурой плавления и характерной формой кристаллов. В реакции принимают участие первый и второй углеродные атомы.
| глюкоза промежуточный енол е) При нагревании моносахаридов с концентрированными растворами щелочей, так же как и в случае альдегидов, происходит осмоление моноз. Реакции, характерные для гидроксильной группы а) При окислении первичной спиртовой группы альдоз, не затрагивающем альдегидной группы, образуются уроновые кислоты: |
| фруктоза |
| г) По карбонильной группе монозы реагируют с гидроксиламином и синильной кислотой, образуя соответственно оксимы и оксинитрилы. д) При действии на моносахариды разбавленных растворов щелочей происходит тауто- мерное превращение альдегидной группы в кетонную, и наоборот. При этом сначала образуются двойная связь между первым и вторым атомами углерода |
| н—с—он | н—с—он | |
| сн2он | соон |
б) В циклических формах пентоз и гексоз наиболее реакционноспособной является гидроксильная группа, стоящая у первого атома углерода (полуацетальный или гликозидный гидроксил). Водород в полуацетальном гидроксиле замещается на радикал и образуется гликозидная связь.
г) Г идроксильные группы сахаров легко реагируют с кислотами с образованием соответствующих ацильных производных.
Реакции при которых изменяется углеродный скелет моносахаридов
а) Полное окисление моносахаридов.
C6H12O6 + 6 O2 ^ 6 CO2 + 6 H2O
б) Некоторые моносахариды D-ряда, например, глюкоза, фруктоза и манноза, расщепляются при каталитическом действии ферментов дрожжей, другие - при действии ферментов бактерий.
Реакция дегидратации При нагревании моносахаридов с концентрированными кислотами происходит дегидратация молекулы. Из пентоз образуется фурфурол, из гексоз - оксиметилфурфурол.
с,н10о, ~ 0-4, * 3 н-°
нагревание о н
пентоза фурфурол
Молекула дисахарида состоит из двух молекул моносахаридов, соединенных гликозидной связью. В зависимости от того, какие атомы углерода участвуют в образовании гликозидной связи, молекула дисахарида может или не может содержать свободную карбонильную группу.
По химическим свойствам олигосахариды можно разделить на две группы: невосстанавливающие и восстанавливающие. Невосстанавливающие сахара не имеют ОН-группы ни при одном аномерном центре, восстанавливающие - имеют свободную ОН-группу при аномерном центре. Невосстанавливающие сахара называют гликозил- гликозидами; восстанавливающие - гликозил-гликозами.
Свойства дисахаридов характеризуют следующие реакции:
1. Одна из самых важных реакций дисахаридов - это их способность гидролизоваться под действием кислоты или соответствующего фермента. В результате гидролиза разрывается гликозидная связь.
1 моль мальтозы + Н2О ^ 2 моля глюкозы
1 моль лактозы + Н2О ^ 1 моль глюкозы + 1 моль галактозы
1 моль сахарозы + Н2О ^ 1 моль глюкозы + 1 моль фруктозы
2. Реакции, характерные для карбонильной группы. Так же как моносахариды, мальтоза и лактоза окисляются ионами меди, серебра, ртути, образуют озазоны и вступают во все реакции, характерные для соединений, содержащих свободные карбонильные группы. В сахарозе нет потенциальной свободной карбонильной группы, и она не вступает ни в одну из перечисленных реакций.
3. Реакции, характерные для ОН-группы. Гидроксильные группы дисахаридов могут принимать участие в образовании гликозидных связей. Продуктами реакций являются три-, тетра- и полисахариды. С кислородосодержащими кислотами дисахариды образуют сложные эфиры.
4. Реакции, протекающие с разрывом углеродной цепи дисахаридов. Дисахариды могут быть окислены до диоксида углерода и воды. Под действием ферментов дрожжей сахароза и мальтоза дают этанол, а лактоза не изменяется.
5. Цветные реакции. Дисахариды не восстанавливают раствора ацетата меди в разбавленной уксусной кислоте и не дают окраски с раствором иода.
Полисахариды
Полисахариды - углеводы с большой молекулярной массой (3*10 - 4*10). Так как они не обладают полной однородностью, им не дают систематических названий Г омополисахариды, построенные из остатков D-глюкозы.
Крахмал - главное резервное энергетическое вещество растений, гликоген играет ту же роль у животных. Крахмал и гликоген построены из D -глюкозных единиц, связанных а-1,4 связями (как в мальтозе) и имеют разветвления, образующиеся за счет а-1,6 связей. Крахмал и гликоген различаются числом разветвлений. Гликоген имеет разветвление в каждом 8 - 10 звене, в крахмале имеются структуры почти линейные (амилоза) и структуры с разветвлениями через 20 - 30 звеньев (амилопектин).
Крахмал содержит 10 - 20% амилозы и 80 - 90% амилопектина. Амилоза растворима в воде, дает чисто синюю окраску с иодом, ее молекулярный вес изменяется от 4000 до 50000. В амилопектине глюкозные остатки в каждой цепи связаны 1,4 - гликозидными связями, а эти цепи связаны между собой 1,6-гликозидными связями. Амилопектин сильно набухает в горячей воде, но не растворяется. Молекулярный вес амилопектина больше 500000, с иодом он дает красно-фиолетовую окраску. Нагреванием сухого крахмала при 2500С или его частичным гидролизом в присутствии кислоты получают декстрины. Декстрины - это полисахариды, молекулы которых меньше, чем молекулы крахмала. Декстрины растворимы в воде.
Гликоген - один из важнейших источников энергии для животных организмов. Молекула гликогена представляет собой сильно разветвленную цепь; молекулярный вес гликогена 4 000 000. Гликоген - белый аморфный порошок, который растворяется в воде с образованием опалесцирующих коллоидных растворов.
Целлюлоза придает тканям растений механическую прочность. Она служит как бы скелетом растений. Молекула целлюлозы, подобно амилозе, представляет собой длинную неразветвленную цепь глюкозных остатков, соединенных 1,4-гликозидными связями. В отличие от амилозы, содержащей а-1,4-гликозидные связи, целлюлоза имеет в-1,4- гликозидные связи. Молекулярный вес целлюлозы изменяется от 100000 до 570000 (600000 для очищенной целлюлозы).
Различия в конфигурации между амилозой и целлюлозой (а-1,4 связи и в-1,4 связи, соответственно) ответственны за резко выраженные различия в физических свойствах и еще более удивительные различия в химических свойствах. Крахмал является почти универсальным продуктом питания, целлюлоза перерабатывается лишь некоторыми микроорганизмами.
Химические свойства полиоз
1. Гликозидные связи в полисахаридах гидролизуются под действием кислот или ферментов. Полный гидролиз большинства видов крахмала, гликогена, декстринов и целлюлозы приводит к образованию глюкозы:
(С6НШО5)п + (n-1)H2O ^ nC6H12O6
2. В полисахаридах практически не содержится свободных карбонильных групп, поэтому они не являются восстанавливающими веществами и не обладают химическими свойствами, характерными для альдегидов и кетонов.
3. Гидроксильные группы полисахаридов реагируют с кислородсодержащими кислотами с образованием сложных эфиров.
4. Полисахариды, содержащие только углерод, водород и кислород при сгорании превращаются в диоксид углерода и воду, при этом выделяется энергия.
Типичная целлюлоза - хлопок. При его обработке едким натром и сероуглеродом образуется ксантогенат целлюлозы, который растворяется в воде или разбавленной щелочи, образуя так называемый вискозный раствор. При продавливании вискозного раствора через фильеры в водный раствор, содержащий серную кислоту, струйки вискозного раствора превращаются в нити вискозного волокна.
| Лекция 7 |
| Аминокарбоновые кислоты, которые часто называют аминокислотами, можно рассматривать как замещенные карбоновые кислоты, в которых один или несколько атомов водорода замещены на аминогруппы. Бывают а-, Р-, у и.т.д. аминокарбоновые кислоты. Наибольшее значение имеют а-аминокислоты. Данные соединения имеют свойства как кислот, так и оснований. |
| в) Синтез Штреккера |
| В зависимости от строения радикала аминокислоты подразделяют на следующие группы: алифатические аминокислоты, алифатические оксиаминокислоты, серусодер- жащие аминокислоты, дикарбоновые аминокислоты (аминокислоты кислотного характера), диаминокарбоновые кислоты (аминокислоты основного характера), жирноароматические аминокислоты, гетероциклические аминокислоты и иминокислоты. Получение а-аминокислот: а) гидролиз белков; б) аммонолиз а-галогенкарбоновых кислот |
| Бг, |
| NH, |
| -NHXHRCOOH |
| BrCHRCOOH |
| CH2RCOOH |
| nh2chrcooh |
| АМИНОКИСЛОТЫ |
| -OH |
| H3O |
| NH, |
| -RCH-NH, |
| RCH |
| RCHO |
| 'NH, |
| Свойства аминокислот |
| Аминокислоты являются амфотерными электролитами. Они образуют соли как с кислотами так и с основаниями. |
| + HX NaOH NH3CHRCOOH ---------- NH2CHRCOOH ----------- ► NH2CHRCOONa 3 2 - H2O |
| X |
| nh2chrcooh |
| NH3CHRCOO |
| Для каждой аминокислоты имеется свое определенное значение рН, при котором биполярный ион преобладает в равновесии с аммонийной солью и карбоксилатом. Это так называемая изоэлектрическая точка (IP), определяемая соотношением: |
| - - н |
| - н |
| nh2chrcoo |
| nh3chrcooh |
| nh3chrcoo |
| + н- |
| + H+ |
| PK |
| В изоэлектрической точке растворимость а-аминокислот в воде минимальна. В присутствии неорганических кислот из а-аминокислот и спиртов образуются сложные эфиры, которые в отличие от свободных аминокислот могут подвергаться перегонке. |
| Восстановление гидридами металлов |
| В водных растворах и в твердом состоянии происходит образование внутренних солей. |
а-Аминокислоты могут алкилироваться под действием алкилгалогенидов
3R'X
NH2CHRCOOH > NR'3CHRCOO
При ацилировании а-Аминокислоты получаются азлактоны
С азотистой кислотой а-Аминокислоты реагируют с образованием оксикислот и выделением азота.
hno2
nh2chrcooh -------------------- HOCHRCOOH + H2O +n2
Формально белки и пептиды образуются при конденсации двух или нескольких аминокислот
—н2о
NH2CHRCOOH + NH2CHR'COOH ------- ^ NH2CHRC^
NHCHR'COOH
Отличительным структурным признаком пептидов является наличие пептидной группировки -СОКИ-.
Белки и пептиды
Протеины (белки в узком смысле) относятся к биополимерам.
Протеины с помощью кислотного, основного или ферментативного катализа могут расщепляться на простейшие составляющие - а-аминокарбоновые кислоты, обычно называемые просто а-аминокислотами.
R-CH-COOH
nh2
У большинства природных а-аминокислот (за исключением глицина) имеется ассиметричный атом углерода, что обуславливает явление оптической изомерии. Природные аминокислоты принадлежат почти исключительно к L ряду.
CHO COOH
HO— C —H h2n— C — H
CHjOH R
L-глицериновый альдегид L-аминокислота
По составу белки делят на простые (протеины) - состоят из только из аминокислотных остатков и сложные (протеиды) - состоят из двух частей: белковой и небелковой (нуклеиновые кислоты, углеводы, комплексносвязанные ионы металлов, липиды, фосфалипиды).
Строение белков:
Первичная - последовательность связи аминокислот.
Вторичная - упорядоченное свертывание полипептидной цепи из-за действия внутримолекулярных водородных связей.
Третичная - это трехмерная конформация его пептидной цепи. Третичная структура существует за счет взаимодействия различных функциональных групп между собой.
Четвертичная - (далеко не для всех молекул) - соответствует размещению в пространстве нескольких молекул.
Простейшие представители белков называются пептидами, т.е. соединениями,
полученными за счет образования пептидной связи.
По числу аминокислотных остатков, участвующих в построении пептида, различают олигопептиды (ди-, три-,............................................................ до декапептидов) и полипептиды.
Названия пептидов образуют из названий соответствующих аминокислот, причем аминокислоты, принимающие участие в образовании пептидной цепи за счет карбоксильной группы, получают суффикс -ил.
Некоторые из пептидов имеют большое биологическое значение: глутатион, инсулин, многие гормоны и. т. д.
Полипептиды, относительная молекулярная масса которых превышает 10000, называют протеинами (белками).
По форме молекул различают фибриллярные белки (волокнистые белки) и глобулярные белки (шарообразно построенные белки). Первые нерастворимы в воде и служат основной составной частью остовных тканей.
Фибромолекулярные белки: коллаген (хрящи, соединительные ткани, кости)
Кератин: волосы, роговая ткань).
Фиброин (шелка, коконы).
Миозин (мускульная ткань).
Вторые растворимы в воде с образованием коллоидных систем
Альбумин (основная составная часть куриного белка).
Глобин (белковый компонент гемоглобина).
При этом различают четыре структурных признака построения белков.
Первичная - последовательность аминокислотных остатков в полипептидных цепях. Эта последовательность определяет строение белка.
(например, миоглобин - 153 аминокислотных остатка)
Вторичная - упорядоченное свертывание полипептидной цепи из-за действия внутримолекулярных водородных связей. Стабилизация при этом осуществляется за счет возникновения спиральной структуры.
Наиболее часто встречается a - спираль, которая содержит 3,7 a - аминокислотных остатков на один виток спирали. Расстояние между отдельными витками 0,544 нм. Бывают и другие виды структур.
Третичная - это трехмерная конформация его пептидной цепи. Третичная структура существует за счет взаимодействия различных функциональных групп между собой.
Четвертичная - (далеко не для всех молекул) - соответствует размещению в пространстве нескольких молекул.
Протеиды
Протеиды являются белковоподобными веществами, в которых с белком связаны составные части небелкового характера, так называемые простетические группы. К хромопротеидам относят ферменты дыхания и гемоглобин. В них простетической группой служит красящее вещество.
Гликопротеиды содержат в качестве простетических групп углеводы.
Липопротеиды содержат в качестве простетических групп фофатиды.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|