
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СИз-C-Cl + 2 H-NH2 —*• CH3-C-N(CH3)2 + HCl 1 страница
Самым слабым ацилирующим веществом является карбоновая кислота, поэтому при взаимодействии с аммиаком она образует аммонийную соль, которая при сухой перегонке переходит в продукт ацилирования аммиака - амид карбоновой кислоты.
Гидролиз нитрилов. При проведении реакции омыления в определенных условиях (96% серной кислотой или перекисью водорода в растворе NaOH) можно получить из
нитрила амид карбоновой кислоты:
Химические свойства амидов
Солеобразование. Слабые основные свойства амидов выражаются в их способности давать соли лишь при взаимодействии с сильными кислотами, например:
| R-C-NH, + HCl |
ацилзамещенная аммонийная соль В то же время, амиды, содержащие N-H связи, являются более кислыми соединениями, чем аммиак и амины. Водород в амидной группе более подвижен и может быть замещен на металл. Так, при действии на амиды металлического натрия в жидком аммиаке образуются металлические производные аминов.
Подобными превращения объясняется способность амидов растворять окись ртути.
CH3-Cf*° + HgO * H2O + (CH3-C^° >Hg 3 ^-NH^ NH
И все же амиды - чрезвычайно слабые кислоты, и в практическом плане их следует рассматривать,. как вещества лишенные кислых свойств в водных растворах.
Характерной особенностью амидов является их способность к реакциям ацилирования, хотя она выражена значительно слабее, чем у галогенацилов, ангидридов и сложных эфиров карбоновых кислот.
Восстановление амидов приводит к образованию аминов с тем же числом атомов С.
СНз-е" + 2H------------------ ► CH3-CH2-NH2 + NH3
NH2 Pt, N1
Алкилирование галогеналкилами. При действии галогеналкилов на амиды или их металлические производные получаются N-замещенные амиды:
сНз-с*° + CH3J —► еИз-е; + NaJ
3 'NHNa NHCH3
Дегидратация. При нагревании амидов с фосфорным ангидридом (Р2О5) или с другими водоотнимающими средствами образуются нитрилы кислот.
P2O5
R—С—NH2 —о—► R~C=N + H2O
O t
Перегруппировка Гофмана. Для получения аминов часто используют реакцию взаимодействия амидов с бромом в присутствии щелочи или с белильной известью, которая носит название реакции Гофмана. При этом образуются амины с углеродной цепью на один атом углерода меньше, чем в исходном амиде.
Нитрилы карбоновых кислот
Нитрилами (цианистыми соединениями) называют производные карбоновых кислот, полученные замещением ОКСО- и ОКСИ- групп в карбоксильной группе на азот.
Нитрилы называют по названиям кислот с тем же углеродным составом с добавлением слова НИТРИЛ или по ацилам с изменением окончания ИЛ на О и добавлением слова НИТРИЛ.
Нитрилы могут существовать в двух таутомерных формах - нитрильной и изонитрильной:
HC=N^=* H-N=C H
R-C=N <=* R—N=C "
нитрил изонитрил
Способы получения
Алкилирование солей синильной кислоты.
RJ + KCN —*R-C=N + KJ
При взаимодействии солей синильной кислоты и щелочных металлов с гало- геналкилами образуются преимущественно нитрилы, с солями серебра - изонитрилы.
Одновременное образование нитрила и изонитрила, по-видимому объясняется тем, что алкильная группа галогеналкила связывается с неподеленной электронной парой либо С-атома иона цианида, либо атома азота. _
Дегитратация амидов, аммонийных солей карбоновых кислот и оксимов альдегидов.
Дегидратация аммониевых солей
Лекция 5
НИТРОСОЕДИНЕНИЯ, АМИНЫ И АМИНОСПИРТЫ
Нитросоеденения являются очень важным классом азотистых производных углеводородов, содержащих связь С-N. Мононитропарафины имеют очень большое значение как промежуточные продукты в синтезе разнообразных веществ (аминов, нитроспиртов, альдегидов, кетонов), их также применяют в качестве растворителей для красителей, смол, каучуков и т.д. Среди нитросоединений есть важные лекарственные вещества, например, левомицитин, фурацилин, 5-НОК. Многие нитросоединения токсичны, введение карбоксильной и оксигруппы уменьшает их токсичность.
Нитросоединениями называются производные углеводородов, которые получаются при замещении одного или нескольких атомов нитрогруппами- N02, при этом образуется непосредственная связь углерод-азот.
Общая формула нитросоединений: R-N02. В зависимости от того, с каким атомом углерода связана нитрогруппа, различают первичные, вторичные и третичные нитросоединения. Нитросоединения изомерны эфирам азотистой кислоты (алкилнитритам).
:
Однако приведенные выше формулы нитросоединений являются упрощенными. В действительности как показали исследования, оба атома кислорода в нитросоединениях совершенно равноценны и азот находится в sp2 гибридном состоянии и имеет кратные связи с кислородом. Аналогично, карбрксилат-аниону нитрогруппа может быть представлена в виде гибрида двух эквивалентных граничных структур:
Номенклатура.
По систематической номенклатуре - по названию углеводорода с приставкой НИТРО- и цифрой местоположения нитрогруппы.
Способы получения Нитрование парафинов (См. алканы).
Алкилирование солей азотистой кислоты. Хорошим растворителем для этой цели является диметилсульфоксид (СН3)280 и диметилформамид HCON(CH3)2. В результате реакции наряду с нитросоединениями образуются сложные эфиры азотистой кислоты:
Окисление аминов. Третичные нитросоединения могут быть получены окислением соответствующего амина водным раствором КМиОд.
(
H3C-C-NH2 ^° ^ KM°4—►H3C-C-NO2 + H2O
3 I 2 H2 1 22
CH3 CH3
Окислением соответствующих оксимов при действии трифторнадуксусной кислоты.
CF3-C*
R-CH=N-OH OH> R-CH2-NO2
Нитросоединения с нитрогруппой в ядре получают прямым нитрованием бензола и его гомологов с использованием смеси концентрированных азотной и серной кислот.
Химические свойства
Наличие полного положительного заряда на ключевом атоме - причина того, что нитрогруппа сильнейшая электроноакцепторная группа, обладающая -I - эффектом. Смещение электронных пар ковалентных связей происходит посредством сильного индуктивного эффекта.
Нитрогруппа в насыщенных соединениях, подобно карбонильной группе, активизирует а- водородные связи, что делает нитросоединения склонными к реакциям а-замещения и в этом своем химическом поведении нитросоединения жирного ряда напоминают свойства рассмотренных ранее альдегидов, кетонов и карбоновых кислот.
CH3-NO2 слабая кислота, РКа ~ 110 слабее H2CO3
Подвижность а-водородных атомов проявляется также в том, что первичные и вторичные нитросоединения могут играть роль метиленовой компоненты в реакциях конденсации с карбонильными соединениями.
Кроме - I-эффекта, нитрогруппа проявляет и М- эффект (ап-сопряжение) действующий в том же направлении, что приводит к увеличению подвижности а- водородных атомов и что проявляется в таутомерии первичных и вторичных нитросоединений, которые в щелочной среде перегруппировываются в аци-нитро-форму (кислотную).
Нитросоединения следует рассматривать как таутомерные вещества, реагирующие в нитро- и аци-нитро-формах. Поэтому нитросоединения называют псевдокислотами, способными диссоциировать с образованием аниона. Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, тем не менее образуют нейтральные соли щелочных металлов - нейтролизация нитросоединений основаниями (образование нейтральных солей) происходит медленно, а истинных кислот, как известно мгновенно. Активность водородных атомов у углерода, непосредственно связанного с нитрогруппой проявляется и в реакциях с азотистой кислотой, в реакциях конденсации с альдегидами и в реакциях с галогенами. Кроме того, нитросоединения склонны к реакциям восстановления, сами выступая в качестве окислителя. Восстановление. При восстановлении нитросоединения образуют первичные амины.
R-NO2 + 6 H —► R-NH2 + 2 H2O
CH3-NO2 + 6 h —► ch3-nh2 + 2 H2O
Ароматические нитросоединения во сстанавливаются водородом в момент выделения до ароматических аминов.
В нейтральном или щелочном растворе активность обычных восстанавливающих агентов по отношению к нитробензолу меньше, чем в кислом растворе, поэтому появляется возможность задержать восстановление на различных промежуточных стадиях.
Галогенирование. При галогенировании первичных и вторичных нитросоединений в щелочной среде образуются а-галогензамещенные нитросоединения.
+ 2Br
CH3-CH2-NO2 ——^ CH3-CBr2-NO2 + 2NaBr + 2 H2O
Реакция со щелочами. Первичные и вторичны:-: нитросоединения растворимы в щелочах с образованием солей. Полученные натриевые производные имеют характер солей, при действии кислот на них образуются исходные нитросоединения.
Конденсация. Первичные и вторичные нитросоединения под действием щелочей легко вступают в реакции конденсации с альдегидами за счет атома водорода, находящегося в a-положении к нитрогруппе. При этом формальдегидом реагируют все имеющиеся а- атомы водорода, а с другими альдегидами только один такой атом. Соответственно, нитрометан с формальдегидом образуется трехатомный спирт.
Активированная двойная связь делает возможное участие нитроолефинов в реакции Дильса-Альдера в качестве диенофилов.
Амины
Амины представляют собой практически очень важный класс органических соединений. Они являются полупродуктами в производстве азокрасителей, многих лекарственных препаратов (например, сульфимедийных препаратов: фтивазида, ПАСКа - для лечения туберкулеза) высокомолекулярных соединений.
Аминами называются производные аммиака, в молекуле которого один или несколько атомов водорода замещены на радикалы. В зависимости от R амины могут быть разделены на амины жирного, ациклического ароматического и гетероциклических рядов.
По числу атомов водорода, замещенных углеводородными радикалами, различают первичные, вторичные и третичные амины.
H
H-N-H R-NH2 NH R-N
Группа-NH, входящая в состав первичных аминов. Называется АМИНОГРУППОЙ. Группа >NH, входящая в состав вторичных аминов, называется ИМИНОГРУППОЙ. По систематической номенклатуре амины называют по названию углерода с наиболее длинной цепью и вводят названия замещающих аминогрупп в виде префиксов: Изомерия аминов зависит от местоположения аминогруппы в углеродной цепи и от количества и природы радикалов, связанных с атомом азота. Например, для аминов состава C^nN можно написать 8 изомеров (4 первичных и вторичных и 1 третичный).
Способы получения Действием аммиака на галогенопроизводные получают смесь первичных, вторичных и третичных аминов, а также соли четвертичных аммониевых оснований.
Алкилирование происходит путем присоединения алкила к неподеленному дуплету азота с образованием аммониевых солей.
' /н
Соли четвертичных аммониевых оснований напоминают соли щелочных металлов,
при действии влажной окиси серебра они переходят в гидроокиси тетраалкиламмония, представляющие собой сильные основания
© 0 д„ о ho Ф ©
(CH3)4N J Ag 2^° 2 O » (Ch3)4N oh
Алкилирование аммиака первичными спиртами является современным промышленным методом получения первичных, вторичных и третичных аминов жирного ряда и заключается во взаимодействии спиртов с аммиаком над окисью ThO2 или Al2O3.
ROH + hnh2 —--------------- ► R-NH2 + H2O
300 C
первичный амин
Первичные ароматические амины получают восстановлением нитрилов, расщеплением амидов карбоновых кислот по Гофману, восстановительным аминированием.
Вторичные и третичные амины, в особенности содержащие различные радикалы, с успехом получают восстановлением замещенных амидов.
JO 2Hi
R-C кат2 >R-CH2-NH-R' + H2O
NH-R' кат'
R-C^R' R-ch2-nX]R ' + H2O
'R'
Химические свойства
Почти во всех реакциях аминов первой стадией является образование связи с участием неподеленной пары электронов атома азота. Амины, подобно аммиаку, проявляют основные свойства. Они способны присоединить протон при действии широкого круга кислот, однако первичные и вторичные амины могут выступать также в качестве кислот, хотя очень слабых.
Например, литиевые соли таких аминов легко могут быть получены в эфирном растворе при действии фениллития на амин.
В химическом отношении амины являются нуклеофилами - они имеют несвязанную пару на валентной оболочке атома азота, и в реакциях, протекающих с разрывом связей, характерной первоначальной стадией почти всегда является нуклеофильная атака за счет неподеленной пары электронов атома азота (реакции алкилирования, ацилирования с реактивами Гриньяра ,хлорирование и др.).
Гидратация. Амины проявляют основные свойства и являются органическими основаниями. Водные растворы аминов имеют щелочную реакцию, т.к. амины с водой образуют гидроокиси замещенного аммония.
CH3-NH2 + H-OH - - [CH3-NH3] OH - - [ch3-nh3] + OH
Основность изменяется в зависимости от природы групп, связанных с атомом азота. Основность аминов выше, чем аммиака.
Солеобразование. Подобно аммиаку амины, как сухие, так и в водных растворах взаимодействуют с кислотами, образуя соли.
R-NH2 + H-Cl---------- R-NH3] Cl
Замещение атомов водорода в аминогруппе.
r-c;^° + HNR2' --------------------- ► r-c+ hx
-V ' 1HN1V2 --------
4x XNR-
Галоидные алкилы, подобно галогенводородным кислотам присоединяются к аминам с образованием солей ди-, три-, и тетраалкиламмония.
г— Q hj CH3J CH3J г О
R-NH2 + CH3J ----------- > [r-NH2-CH3] J ----------------- > R-NH-CH3 _ > R-N(CH3)Z---------------------- >[R-N(CH3)^ j
Хлорирование. При действии хлора на первичные или вторичные амины в присутствии щелочи легко идет замещение атомов водорода аминогруппы на хлор:
СЫзЫИ2 + 2 Cl2 + 2 NaOH--------- ►CH3-N/Cl + 2 H2O
\С1
Окисление первичных, вторичных аминов идет очень трудно и практически значения не имеет. Третичные амины окисляются лег^о до оки^си третичного амина.
(СНз)зЫ : + HOOH----------- ► (CH3)3N —-—►O + H2O
СЕРУСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Сульфокислотами называются производные углеводородов, получающиеся путем замещения атома водорода в углеводородной молекуле на сульфогруппу: R- SO3H
Названия сульфокислот по систематической номенклатуре складываются из названия углеводорода с добавлением суффикса сульфоновая кислота (сульфокислота) или префикса ”сульфо”.
Способы получения.
Реакция алкилирования кислых солей сернистой кислоты.
HcK802 + RHa^ —►RSO3H + NaCl
Окисление тиолов
2 C H3SH + 3 O2--------- ► 2CH3-SO3H
Реакции сульфирования алканов (См. свойства алканов)
Реакция фотохимического сульфохлорирования парафинов (См. свойства алканов)
Химические свойства
Сульфокислоты по своей силе сравнимы с серной и хлорной кислотами, т.к. являются сильными кислотами, хорошо растворимы в воде. Их соли хорошо кристаллизуются.
Реакция солеобразования.
R-SO2-OH + NaOH —► R-SO2-ONa + H2O
2R-SO2-OH + Ca(OH)2 —► (R-SO2O)2Ca + H2O
Образующиеся соли по своим свойствам подобны солям серной кислоты. Основное преимущество сульфонатов натрия в качестве моющих средств перед натриевыми солями жирных кислот, используемых в обычных мылах, заключается в том, что соответствующие кальциевые и магниевые соли растворимы в гораздо большей степени и при использовании воды сульфонаты не образуют хлопьев.
Образование производных сульфокислот. При действии на сульфокислоты РС15 образуются хлорангидриды сульфокислот или сульфохлориды. Сульфохлориды используются в промышленности для получения сложных эфиров алкансульфокислот, которые в дальнейшем могут быть применены в качестве алкилирующих средств.
Р t0
CH3-CH2-S-Cl + HO-CH3------------ ►CH3-CH2-SOrPCH3 + HCl
о
При действии на сульфохлориды аммиаком образуются амиды сульфокислот.
R-SOp + NH3 ^R-SOjM^ + на
Сульфамиды при хлорировании их в щелочной среде образуют хлорамиды сульфокислот (хлорамины).
R-SO2-NH2 + Cl2 + KOH —>-RSO2NCl2 + KCl + H2O
Сульфокислоты ароматического ряда
Ароматическими сульфокислотами называют производные бензола или его гомологов, в молекулах которых один или несколько атомов водорода бензольного ядра замещены на сульфогруппы. Общая формула ароматических сульфокислот: Ar-SO2-OH.
Способы получения
Ароматические сульфокислоты получают реакциями сульфирования бензола и его гомологов 100% серной кислотой или олеумом.
CH + H2SO4------------ ►C6H5SO2OH + H2O
Лекция 6
ЛИПИДЫ ЖИРЫ. ОКСО- И ОКСИКИСЛОТЫ
Липиды не являются химически однородным классом веществ. К ним принадлежат жиры и воска, которые относят к постым липидам, а также фосфатиды и гликолипиды, относимые к сложным липидам. Часто к этой группе веществ относят стероиды и каро- тиноиды. Липиды нерастворимы в воде, однако хорошо растворяются во многих органических рпастворителях.
Жиры
Жиры представляют собой полные сложные эфиры глицерина с алифатическими кислотами.
CH2— O-CO-(CH2)m-CH3
I '
CH- O-CO-(CH2)n-CH3
I
CH2— O-CO-(CH2)x-CH3
Благодаря процессам биосинтеза большинство природных жирных кислот имеет неразветвленный углеродный скелет и четное число атомов углерода.
Наиболее распространенные насыщенные кислоты: лауриновая (додекановая), ми- ристиновая (тетрадекановая), пальмитиновая (гексадекановая), стеариновая (октадекА- новая). Наиболее распространенные ненасыщенные кислоты: олеиновая (октадецен-9- овая), линолевая (октадекадиен-9,12-овая), линоленовая (октадекатриен-9,12,15-овая).
У ненасыщенных кислот существует п-диастереомерия: олеиновая (Z-форма) и элаидиновая (Е-форма).
На температуру плавления жиров оказывает влияние как длина углеродной цепи, так и содержание ненасыщенных кислот. Жиры - жидкие при комнатной температуре часто называют маслами. Для характеристики различных жиров используют иодное число, число омыления и кислотное число.
Иодное число служит мерой содержания ненасыщенных жирных кислот. Под этим термином понимают количество иода в граммах, которые могут присоединить 100 г жира.
Числом омыления называют количество гидроксида калия в миллиграммах, необходимое для омыления 1 г. жира.
Кислотное число измеряется в миллиграммах гидроксида калия, расходующегося для нейтрализации 1 г жира.
Воска
Воска представляют собой сложные эфиры высших монокарбоновых кислот с не- разветвленной цепью с высшими одноатомными неразветвленными цепями (С14-С18).
Оксикарбоновые кислоты
В оксикарбоновых кислотах один или несколько атомов водорода в углеводородном радикакале заменены на гидроксильные группы. Оксикарбоновые кислоты подразделяют на две группы: кислоты, содержащие спиртовые и содержащие фенольные гидроксильные группы. По систематической номенклатуре оксикислоты рассматриваются как замещенные карбоновые кислоты.
Способы получения
Гидрированиеэфиров оксокарбоновых кислот
R-C-(CH2)nCOOR' R-CH-(CH2)nCOOR' R-CH-(CH2)nCOOH
O OH OH
H,O
R-CH-CN > R-CHCOOH
I I
OH OH
Гидролиз циангидринов.
Г идролиз галогенкарбоновых кислот.
Реакция Реформатского. Из сложных эфиров галогенкарбоновых кислот.
Br-CH2COOR' Zn ► BrZn-CH2COOR' + RCHO --------------- »
R-CH-CH2COOR' Hp > R-CH-CH2COOR' H2^ R-CH-CH2COOH
OznBr OH OH
5. Окисление оксиальдегидов.
Химические свойства
а-Оксикислоты дегидратируются с образованием 3,6-диалкил-1,4-диоксандионы- 2,5. Эти соединения называют лактидами. Лактиды могут быть расщеплены гидролитически. При их перегонке происходит декарбонилирование с образованием альдегидов.
Р-оксикислоты дегидратируются с образованием непредельных кислот
-H2O
R-CH-CH2-COOH —^ R-CH=CH-COOH
I
OH
Из у- и 5-оксикислот с отщеплением воды из гидроксильной и карбоксильной групп образуются сложные эфиры, которые называют у- и 5-лактонами.
/
"O^'O
а-Оксикислоты при нагревании с разбавленной серной или соляной кислотой отщепляют муравьиную кислоту.
R-CH(OH)-COOH —R-CHO + HCOOH
При реакции с иодистым водородом оксикислоты превращаются в незамещенные карбоновые кислоты
Фенолкарбоновые кислоты
Для синтеза фенолкарбоновых кислот могут быть использованы любые реакции, при помощи которых в бензольное кольцо вводятся гидроксильная или карбоксильная группы. Наиболее приемлема реакция Кольбе-Шмитта.
Ацилированием салициловой кислоты уксусным ангидридом в присутствии пиридина получают ацетилсалициловую кислоту.
Оксокарбоновые кислоты Получение
1. Гидролиз оксонитрилов.
2. Конденсация кляйзена
3. Янтарный ангидрид с реактивом Гриньяра
УГЛЕВОДЫ
Класс оксикарбонильных соединений интересен тем, что к нему относят соединения, называемые углеводами. Углеводы широко распространены в животном и растительном мире, они играют исключительную роль во многих жизненных процессах. Углеводы составляют 80% от сухой массы растений и 2% от сухой массы животных организмов. Углеводы, синтезируемые растениями, служат важными пищевыми веществами для животных организмов. К важнейшим углеводам, образующимся в результате фотосинтеза, относятся крахмал и свекловичный (тростниковый) сахар. Оболочки растительных клеток состоят главным образом из углеводов (целлюлозы).
Оксиальдегидами и оксикетонами (оксикарбонильными соединениями) называются соединения, содержащие одновременно в углеводородной цепи гидроксильную и карбонильную группы (-OH, C=O). Название этих соединений образуют, используя номенклатуру карбонильных соединений, обозначая наличие -ОН группы приставкой окси- и указывая положение гидроксила относительно карбонильной группы.
Для оксикарбонильных соединений различают:
1. Структурную изомерию, обусловленную: наличием альдегидной или кетонной функции (например, глицериновый альдегид и диоксиацетон); расположением -ОН группы относительно карбонильной функции, т.е. различают а-,Р-,у-,5- и другие карбонильные соединения.
2. Оптическую изомерию, связанную с наличием в молекуле ассиметрического атома С. Так, глицериновый альдегид существует в виде двух оптически активных изомеров (энантиомеров). Один вращает плоскость поляризации света вправо (+), другой - влево (-). Для них установлена абсолютная конфигурация и правовращающий изомер назван D-изомером, левовращающий - L-изомером. Оптические изомеры изображают проекционными формулами Фишера.
(+) D -глицериновый альдегид (-) L -глицериновый альдегид
| ОН |
| H |
| CHO |
| Н |
| НО |
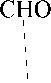
| (-) |
| СН2ОН |
Конфигурацию D- и L- изомеров глицеральдегида используют для класссификАции других хиральных соединений, т.е. для отнесения их к D- или L- ряду. Т.о., принадлежность к оптическому ряду определяется совпадением пространственного расположения заместителей у ассиметрического атома С с расположением заместителей в D- и L-изомерах глицеральдегида.
Большинство углеводов имеют общую формулу Cn(H2O)n - отсюда и произошло название углеводы (К. Шмидт, 1844 г.). Например: C6H12O6; C12H22O11 Большой класс углеводов делят на две группы:
1. простые углеводы (или простые сахара)
2. сложные углеводы (или сложные сахара).
Простыми углеводами (моносахаридами или монозами) называют такие углеводы, которые не способны гидролизоваться с образованием более простых углеводов.
Большинство этих веществ имеет состав, соответствующий общей формуле CnH2nOn, т.е. у них число атомов углерода равно числу атомов кислорода.
Пентозы: C5H10O5 арабиноза, рибоза, ксилоза
Гексозы C6H12O6 глюкоза, фруктоза, галактоза, манноза.
Моносахариды являются полиоксикарбонильными. Их классифицируют по числу углеродных атомов в молекуле (тетрозы С4Н8О4, пентозы С5Н10О5, Гексозы С6Н12О6) и присутствию альгидной или кетогруппы: альдозы и кетозы.
Сложными углеродами (полисахаридами или полиозами) называют такие углеводы, которые способны гидролизоваться с образованием более простых углеводов. Большинство этих веществ имеет состав с общей формулой CmH2nOn. Сложные углеводы подразделяются на олигосахариды (oligos - мало) и полисахариды.
| Олигосахариды | дисахариды | Сахароза /Г+Ф/ Мальтоза /Г+Г/ Лактоза /Г+Гал/ |
| трисахариды | Рафиноза /Г+Ф+Г ал/ | |
| Полисахариды | Крахмал, гликоген, целлюлоза |
Для моносахаридов существуетЗ вида изомерии:
1. Структурная - по наличию альгидной или кетонной функции. Например, структурными изомерами являются глюкоза и фруктоза. Оба соединения имеют состав С6Н12О6, но в молекуле глюкозы присутствует альдегидная группа, а в молекуле фруктозы - кетонная.
2. Цикло-цепная таутомерия. Также как у- и 5- оксикарбонильные соединения, углеводы образуют в растворах циклические полуацетали, полукетали.
3. Пространственная (оптическая; стерео-) изомерия.
Молекулы моносахаридов хиральны, имеют два или более ассиметрических атома С. Количество оптических изомеров находят по формуле Фишера: N = 2n, где N - количество оптических изомеров, n - количество ассиметрических атомов углерода. Оптически активные изомеры, не являющиеся зеркальными, называются диастереомерами.
Энантиомеры моноз различаются только направлением вращения плоскости поляризации света, имеют одинаковые названия. Направление оптического вращения обозначают знаками (+) и (-). Буквами D и L обозначают принадлежность данного моносахарида к D или L ряду, сравнивая расположение заместителей у последнего ассиметрического углеродного атома с глицериновым альдегидом.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|