- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СИз-C-Cl + 2 H-NH2 —*• CH3-C-N(CH3)2 + HCl 2 страница
Но это, в частности, указывает на тот факт, что реакции, идущие с разрывом связи углерод-углерод, энергетически менее выгодны, чем реакции с разрывом связи углерод-водород.
Наиболее характерными реакциями замещения алканов являются реакции : галогенирования, нитрования, сульфирования и реакции внедрения.
Реакции замещения могут осуществляться либо по радикальному, либо по ионному механизму. Реакции алканов обычно идут по механизму SR.
Основные реакции алканов Галогенирование (реакции металлепсии)
Замещение атомов водорода на атомы галогенов - одна из наиболее характерных реакций алканов. Реакции могут идти со всеми галогенами, но со скоростью течения неодинаковой, т.к. она зависит от реакционной способности галогена.
F > Cl > Br > J
Реакция со фтором очень экзотермична )435,4 кдж/моль) и идет со взрывом. Иодирование алканов происходит очень трудно и не идет до конца.
В общем виде реакция галогенирования:
R—H + Hal2 ——►о R-Hal + HHal
250-400 C обычно смесь
Реакционная способность Н: третичный > вторичный > первичный > СН3Н.
CH3 Cl2 I
C^-CH-CH —^ CHrC-CH и CHrOT-CHzCl
Ch3 hv Ch Ch3
трибутилхлорид хлористый изобутил
Галогенирование алканов осуществляется по радикальному механизму, который часто называют цепным механизмом, а сами реакции - цепными реакциями. Реакции, включающие ряд стадий, каждая из которых регенерирует реакционно способную частицу, вызывающую следующую стадию, называют цепными реакциями. Различают три стадии цепного механизма:
-инициирование цепи, -развитие цепи (рост цепи), -обрыв цепи.
Механизм галогенироания алканов рассмотрим на примере хлорирования простейшего алкана - метана.
CH4 + Cl2 hV “ CH3CI + HCl
1- я стадия - инициирование цепи, или появление свободных радикалов хлора происходит под действием кванта света.
Образовавшиеся радикалы (атомы) хлора (а их требуется совсем немного) способны начать вторую стадию - стадию роста цепи.
2- я стадия - стадия развития цепи. На каждом этапе стадии роста цепи происходит исчезновение одной активной частицы и появление другой; в данном случае это реакция атомов хлора и метаном и метильных радикалов с хлором.
Cl ■ + CH4 ---------------- ► CH3 ' + HCl
4 * Развитие цепи
CH3' + Cl2 -------------------- ► Cl' + CH3CI
Важной особенностью второй стадии является то, что вместо атома хлора, расходуемого на первом этапе второй стадии, появляется другой атом (радикал) на втором этапе, т. е. реагенты превращаются в продукты реакции, а атомы или радикалы в процессе не исчезают. Со стадиями роста цепи конкурируют стадии обрыва цепи, заключающиеся в исчезновении атомов или радикалов.
3- я стадия - обрыв цепи - происходит при уничтожении " ведущего" радикала в результате взаимодействия с другой радикальной частицей. В случае хлорирования метана это возможно при соединении двух реакционноспособных частиц (уравнения 4,5,6) или при их адсорбции на поверхности реакционного сосуда.
При галогенировании алканов в зависимости от того, какой атом водорода алкана замещается, может образоваться несколько изомерных продуктов. Установлено,что реакционная способность водорода зависит от того, что является ли он первичным, вторичным или третичным, а не от алкана, в котором он находится. Как ранее было показано, легкость отщепления водородных атомов:
третичный > втроичный > первичный > СН4 Нитрование (реакция М.И. Коновалова, 1888г.)
Другой промышленно важной реакцией является нитрование алканов, приводящая к образованию нитропарафинов. Реакция обычно проводится в газовой фазе при повышенных температурах с использованием в качестве нитрующего агента азотной кислоты или четырехокиси азота.
425 C
R-H + HNO3--------- ► R-NO2 + H2O
Все имеющиеся данные указывают на свободно-радикальный механизм нитрования, однако, многие аспекты реакции выяснены еще не полностью. По-видимому, первым актом реакции нитрования является дегидратация азотной кислоты с образованием пятиокиси азота и диссоциацией последней на радикалы.
В качестве побочных продуктов возможно образование эфиров азотистой кислоты:
R + • NO2 —> R-O-NO
Для реакции нитрования действуют рассмотренные ранее обычные правила замещения, т.е. начиная с пропана образуется смесь нитропарафинов, причем водород у третичного атома углерода замещается легче, чем у вторичного.
На реакцию нитрования расходуется около 40% азотной кислоты. Остальная кислота действует как окислитель, поэтому наряду с нитросоединениями в этом процессе получаются и различные кислородные соединения - спирты, альдегиды, кетоны, кислоты. Кроме того, образуются и непредельные углеводороды.
М.И. Коновалов впервые проводил эту реакцию с 13% азотной кислотой в запаянной трубке при 1390-1500 С.
Сульфирование
При обычной температуре парафины не взаимодействуют с серной кислотой. Однако, с дымящейся серной кислотой (олеум) при нагревании парафины вступают в химическую реакцию. При этом истинным сульфирующим агентом является не серная кислота, а серный ангидрид.
R-H + HO-SO2-OH —* R-SO2-OH + H2O
алкансульфокислота
Сульфохлорирование
Лучшие результаты дает реакция сульфохлорирования сернистым ангидридом и хлором, осуществляемая по механизму радикального замещения.
А также сульфоокисление:
R-H + 2 SO2 + O2 + H2O —► R-SO2OH + H2SO4
Сульфопроизводные высших предельных углеводородов применяются в качестве моющих средств.
Горение алканов (окисление)
Реакция алканов с кислородом, приводящая к образованию диоксида углерода, воды и, что наиболее важно, выделению тепла. Ее практическое значение очевидно.
пламя
CnH2n+2 + избыток O2 * nCO2 + (n+1)H2O
ХИМИЯ ЦИКЛОАЛКАНОВ
Основоположником химии циклоалканов является В. В. Марковников. Он нашел, что наряду с ароматическими углеводородами нефть содержит и насыщенные пяти и шестичленные циклические соединения состава СпН2п, неизвестные ранее. Существование насыщенных циклических систем он доказал встречным синтезом.
В сельском хозяйстве в борьбе с насекомыми широко применяется гексахлорциклогексан (гамма- изомер).
Циклогексан используется для синтеза адипиновой кислоты и капролактама - полупродуктов для производства синтетических волокон, нейлона ,капрона, заменяющих ряд натуральных продуктов (хлопок , металл) при изготовлении сетей деталей машин, предметов быта и т. д.
Циклогексановые ядра входят в состав природных веществ : алкалоидов, терпенов, антибиотиков, стероидов, витаминов и др. важных соединений.
Гомологический ряд циклоалканов. Теория напряжения Байера. Конформации
Классификация
Циклоалканы подразделяются по следующим признакам:
1). размер цикла
С3-С4 малые циклы
С5-С7 обычные
С8-С12 средние
| моноциклические CnH2n циклогексан СО... |
| 2n-2 |
 бициклические CnH
бициклические CnH
Трициклические CnH2n-4
3) взаимное расположение колец
а) изолированные циклы '—'
б) циклы ,соединенные С-С связью '—' '—'
в)циклы с одним общим атомом С (спирановые) '—''—'
г) циклы с двумя общими атомами С (конденсированные ) —
д) циклы с числом общих атомов С более двух (мостиковые)
Номенклатура
Название моноциклических углеводородов по систематической номенклатуре
образуется от числа атомов С в цикле и приставки цикло или по числу метиленовых
CHf— CH2 CH2—CH2 CH2—CH2
CH2 CH2—CH2 CH2 CH2
циклопропан циклобутан ^ циклопентан
звеньев . триметилен тетраметилен CH2 пентаметилен
Для бициклических углеводородов ставится приставка бицикло, затем в [ ] указывается число атомов С, исключая общее. Если общих 2, то О, если 3, то - 1 и название углеводорода по общему числу атомов С в бициклах.
бицикло [ 4,3,0] нонан бицикло[ 2,2,1] гептан
Название спиранов начинается со слова " спиро " , далее [ ] указывается число атомов С в каждом цикле кроме спиранового и далее название углеводорода от общего числа
атомов С в цикле
Заместители нумеруются так, чтобы сумма их номеров была минимальной
|
|
| СН3 |
| СН3 |
1,2,4- триметилциклогексан
1.3 Изомерия
Для циклоалканов возможны два вида изомерии : структурная и пространственная.
Структурная изомерия
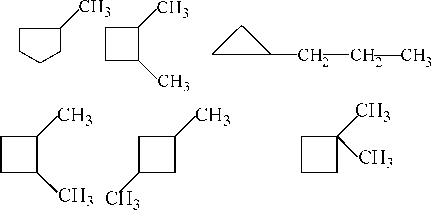
| /СИз |
| -СИ—СИ^СИ, |
| СИ |
б) изомерия положения
в)изомерия заместителя
1.3.2 Пространственная (стерео) изомерия
а) геометрическая . При наличии одного заместителя изомеров нет.
При двух и более заместителях возможно образование цис- и транс- изомеров по
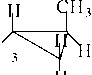
| К \ \ \ * |
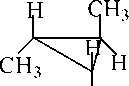 H
H
|
| H |
| CH H цис H транс б) Оптическая изомерия (энантиомерия) только для транс - изомеров. |
| ch, |
| CH |
| H |
| Нз |
| отношению к плоскости кольца CH |
| Н |
в)поворотная (конформацонная ) изомерия
Для циклогексана возможны две конформации : "кресла " и "ванны" образованные вращением по простым С- С связям
Эти формы энергетически не равновесны переходящие друг в друга только за счет свободного вращения называются конформациями.
В конформации "ванны" 4 атома лежат в одной плоскости , а 2 атома С над плоскостью
4 скошенных и 2 заслоненных конформации.
В форме "кресла" атомы С по три расположены в двух параллельных плоскостях. Все 6 скошенных конформаций энергетически более выгодны.
Двенадцать С-Н связей. 6 из них направлены радиально от кольца под углом 1090 28 к оси симметрии — экваториальные (е) других располагаются параллельно оси симметрии и называются осевые или аксиальные (а) имеют место чередование связей а, с, вверх и вниз.
Необходимо отметить , что е более выгодно, т. к, при а расположении заместитель вступает в стерическое взаимодействие с а -Н при С3 и С5.
1.4. Теория напряжения Байера. Положения теории Байера
1. Циклические структуры плоские в
|
|
^90 , 120° и т.д.
2. Чем больше отклонение валентного угла от тетраэдрического, тем больше напряжен цикл и меньше его устойчивость. Напряжение, которое испытывает цикл - угловое напряжение.
Мера напряженности цикла - альфа рассчитывается по формуле
| а= |
| а |
| 24044' 9044' 0044' 5016' |
| циклопропан циклобутан циклопентан циклогексан |
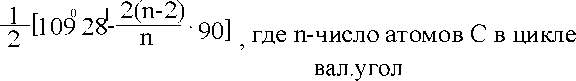
Ближе всего к тетраэдрическому углу валентный угол в циклопентане, более всего напряженность в циклопропане и макроциклах, если они плоские.
Теория Байера не могла объяснить ряд факторов:
а)циклогексан не уступает по прочности и легкости образования циклопентану;
б) теплоты сгорания дельта-Н, рассчитанные на одно метиленовое звено СН2, начиная с 5-6 членных циклов и выше составляют приблизительно одинаковую величину;
в) были синтезированы устойчивые высшие циклы.
Ошибка Байера заключалась в том, что он считал все циклы плоскими.
Противоречия теории напряжения с опытом были устранены работами Саксе и Мора 1890 г. Они показали что, 6 и 7 -членные и высшие циклы не плоские, и могут быть свободны от напряжения . Циклогексан может быть в форме "кресла" и "ванны".
Только для циклопропана теория Байера имеет полное соответствие, если цикл плоский и валентный угол 600 . Но природа связей в циклопропане не так проста, как в пропане и пропене . Для атома С в Sp3 гибридизации валентный угол 1090 28.
|
|
За счет взаимного отталкивания Sp3 гибридных орбиталей, максимум электронной плотности находится не на прямой, связывающей центры атомов.
Валентный угол равен не 60, а 1040, за счет этого угловое напряжение уменьшается, происходит изгибание связей они приобретают частично ненасыщенный характер (банановые связи ). Циклопропан по своим свойствам ближе к алкенам, для него характерные реакции присоединения с раскрытием цикла.
В циклобутане и циклопентане один из атомов С непрерывно выходит из плоскости и кольцо колеблется (конверт) это уменьшает общую энергию молекулы. Напряжения которые выводят атом С из плоскости — торсионное напряжение.
Способы получения
2.1 Источники получения циклоалканов.
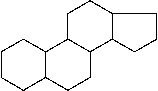
В небольших количествах алициклические соединения встречаются в растительных и животных организмах. Например, природный инсектицид - пиретрин, содержащийся в ромашке, имеет молекулу в виде трехчленного цикла. В основе многих молекул физиологически активных веществ /каротиноиды, алкалоиды, стероиды, гормоны, витамины/ лежит структура циклопентапергидрофенантрена.
|
|
Однако основным источником алициклических одноядерных соединений (5-ти и 6- ти членных), так же как и алканов служит нефть.
2.2 Действие металлов на дигалоидные соединения с удаленными друг от друга галогенами. Применяют для этой цели натрий (Фрейнд,1881 г. ), а также цинк в спиртовом растворе(реакция Густавсона). Таким способом легко получают циклы с тремя атомами углерода , а 5-ти и 6- ти членные с небольшими выходами.
| HC^^CHi HiC |
Гидрогенизация производных бензола и его гомологов (Сабатье, Сандеран).
CH-- CH pH CH
cK >H
CH CH ' -CH CH
\ / \ /
ch=ch CH—CH
Диеновый синтез, реакция Дильса-Альдера (нобелевская премия 1950 г.).
сГ Т_/> hc/^ch,
CH + CH ^н Ч
| \ |
акроелин CH2 nh
H2 циклогексен-3
бутадиен карбальдегид
2.6 Прямая циклизация парафинов (Казанский Б.А.) .Реакция идет в присутствии платинового катализатора.
СИ— (СН^Шз-^Н— Г^ТЗЩ-
СНз
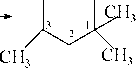
| 1,1,3-триметилциклопентан |
■
| - Н 2 СНз СНз |
Химические свойства
Химические свойства циклоалканов изменяются под влиянием углового напряжения. Чем более напряжен цикл, тем он более реакционноспособен. Циклопропан и циклобутан значительно более реакционноспособны, чем углеводороды с открытой цепью и в химическом поведении похожи на соединения с кратными связями. Для них характерны реакции присоединения. Результатом таких реакций оказывается раскрытие цикла путем разрыва связи С-С и образованием соединений с открытой цепью.
Неустойчивость циклопропанового кольца проявляется в легкости гидрирования (в присутствии платинового катализатора) и во взаимодействии с галогенопроизводными кислотами (бромисто-водородная). Реакции радикального замещения сближают циклоалканы по химическим свойствам с алканами.
4.2. Основные химические реакции.
4.2.1. Гидрирорвание.
Водород присоединяется к циклоалканам более трудно, чем к этиленовым углеводородам. Катализаторы гидролизации Pt, Pd Ni .
Галогенирование.
\
Хлор замещает атомы водорода во всех циклоалканах по свободнорадикальному механизму без размыкания кольца. Бром присоединяется к циклопропану и циклобутану в ионизирующих растворителях.
+C12 /\ ^ + HCl
2 SR Cl
C Cl
+ Br2 CAd^ Br—CH—CH—CH2—Bi
4.2.3. Г идрогалогенирование.
Галогеноводороды размыкают 3-х и 4-х членные циклы и идет реакция присоединения. Для циклопентана и далее реакция не наблюдается.
/\ + HBr —- CH 3 — CH2— CH2 Br
К несимметричным циклогексанам присоединение галогенаводорода протекает
по правилу В.В. Марковникова.
/
СИ,------ СН------ СН2 ---------- •'СН,------- СН------ СН2---------- "СНз— СН СН2—
3 \ / \ /
СН2 СН2
СН3 Br -------------------- СНз— СН—СН2— СН3
I
Br
Отмечено, что если в кольце имеются электронодонорные заместители, скорость реакции электрофильного присоединения увеличивается по сравнению со скоростью самого циклопропана.
Отношение к высокой температуре.
Соединения, содержащие триметиленовый цикл при больших температурах обычно изомеризуются в этиленовые соединения
| о |
Наиболее устойчивы к нагреванию 5-ти 6-ти членные циклы. Семи, восьми и более - изомеризуются в мелкие циклы.
Отношение к окислителям.
При повышении температуры и при действии энергичных окислителей для циклических соединений характерно оброзование двух основных кислот с тем же числом атомов углерода в молекуле.
Дегидрогенизация.
высшие циклы ( особенно циклогексан) ,не имеющие двух заместителей при однолм и том же атоме углерода, обладает способностью терять шесть атомов водорода, превращаясь в ароматические углеводороды.
300°C,Pd -3H2 ”
Если при одном атоме углерода находятся два заместителя, то один либо отщепляется, либо переходит в орто- или мета- положение.
ХИМИЯ АЛКЕНОВ
Этиленовые углеводороды относятся к непредельным, ненасыщенным углеводородам - большой группе углеводородов, в молекулах которых два или несколько атомов углерода связаны между собой кратными связями (двойными или тройными). В зависимости от характера межуглеродных кратных связей и их количества непредельные углеводороды делятся на три класса: 1) этиленовые (алкены); 2) диеновые (алкадиены); 3) ацетиленовые (алкины).
Этиленовые углеводороды, или алкены - ненасыщенные углеводороды с открытой цепью, содержащие в молекуле одну двойную связь. Простейшим представителем таких углеводородов является этилен С2Н4, в связи с чем соединения этого ряда называют также углеводородами ряда этилена. Часто их называют - олефины. Алкены являются соединениями, родственные алканам. Однако наличие двойной связи придает алкенам значительную реакционную способность, по сравнению с алканами.
Благодаря относительно низкой энергии образования п-связи алкены легко вступают в реакцию присоединения по кратной связи. Для алкенов характерно электрофильное и радикальное присоединение (в том числе полимеризация и окисление). Алкены как и другие ненасыщенные соединения, в молекулах которых содержатся различные функциональные заместители, обладают совокупностью свойств непредельных углеводородов и соответствующих классов соединений, а также некоторыми специфическими свойствами, обусловленные взаимодействием заместителя с кратной связью.
Строение, Изомерия и номенклатура
Характерной особенностью строения алкенов является наличие в молекуле двойной углерод-углеродной связи. Двойная связь образуется при помощи двух пар обобщенных электронов (четырехэлектронная связь).
Углеродные атомы, связанные двойной связью, находятся в состоянии sp2- гибридизации, каждый из них образует три a-связи, лежащие в одной плоскости и под углом 1200. Негибридизованные орбитали р-электронов расположены перпендикулярно к плоскости a-связей и параллельно друг другу и вследствие "бокового" перекрывания образуют вторую связь, называемую п-связью (электроны называют п-электронами). Электронное облако п-связи частично расположено над плоскостью, а частично под плоскостью, в которой лежат атомы углерода. Таким образом, две пары электронов образуют различные по своей природе, геометрии и прочности a- и п-связи. Двойная связь представляет собой сочетание аил связей. Боковое перекрывание негибридизованных р-орбиталей, образующих п-связь, сближает атомы углерода и расстояние между ними становится короче - длина двойной С=С связи 0,134 нм (длина простой С-С связи 0,154 нм). Влияние двойной связи на свойства алкенов будем рассматривать при изучении их химических свойств.
Номенклатура алкенов
1. Тривиальные названия олефинов образуются из названия радикалов соответствующих предельным углеводородам с добавлением окончания ЕН.
2. По рациональной номенклатуре этиленовые углеводороды рассматривают как производные этилена, у которого атомы водорода замещены на радикал. Местонахождение радикалов можно указывать, если углеродные атомы этилена обозначить буквами а и р.
3. По систематической номенклатуре названия этиленовых углеводородов составляются из названий соответствующих предельных углеводородов путем замены окончания АН на ЕН, цифрой после окончания показывают положение двойной связи (например, атома углерода, за которым следует двойная связь).
В современной литературе цифру, показывающую положение двойной связи, ставят перед названием углеводорода. За главную цепь принимается самая длинная цепь с двойной связью. Нумерация углеродных атомов начинается с того конца, к которому ближе двойная связь.
Названия одновалентных радикалов складывается из названий соответствующих этиленовых углеводородов по систематической номенклатуре + окончание ИЛ. Цифрой указывается положение двойной связи. Часто используются тривиальные названия.
Водородные атомы, непосредственно связанные с ненасыщенными атомами водорода, образующими двойную связь, часто называют винильными водородами. Изомерия алкенов
Для простых алкенов характерно три типа изомерии:
1) изомерия углеродного скелета - структурная изомерия;
2) изомерия положения двойной связи в цепи (структурная изомерия);
3)_.пространственная (геометрическая) цис-транс-изомерия.
Способы получения алкенов
В противоположность парафинам, олефины встречаются в природе редко. Низшие олефины в небольших количествах могут входить в состав нефтяного газа, высшие в состав некоторых нефтей. Важнейшим промышленным поставщиком олефинов является нефтеперерабатывающая промышленность. Большое количество олефинов образуется при крекинге нефти.
Крекинг нефти
Это главный промышленный путь получения олефинов, нефть представляет собой смесь углеводородов состава С1-С40, различного строения.
Крекинг нефти идет при высокой температуре с образованием алканов, алкенов и Н2. Разрыв углеродной цепи идет по радикальному механизму.
В процессе крекинга осуществляется реакция элиминирования, т. е. отщепляются два атома водорода от соседних атомов углерода.
Реакции элиминирования, приведенные ниже можно использовать не только для синтеза, они, что более важно, представляют общие пути образования двойной связи (углерод-углеродной) в молекуле любого типа.
Дегидрогалогенирование алкилгалогенидов
—1C“C—(спирту—'C=C— + KH + H2O H X
Легкость дегидрогалогенирования: третичные > вторичные > первичные.
Если рассмотреть ряд алкилгалогенидов, то при переходе от первичного к вторичному и затем к третичному, структура становится более разветвленной у атома углерода, связанного с галогеном. Это увеличение степени разветвленности приводит к следующим результатам: во-первых, появляется большое количество атомов водорода для атаки основанием, и следовательно, вероятность элиминирования становится больше, и во-вторых, образуется более разветвленный и более устойчивый алкен (более устойчивое переходное состояние и меньшая Еакт). Роль гидроксил-иона заключается в отщеплении иона водорода (протона) от атома углерода: одновременно отщепляется ион галогена в виде аниона и образуется двойная связь.
Направление реакции определяется относительными скоростями конкурирующих реакций. Так, в приведенном ранее примере, для втор-бутилхлорида атака основанием
любого из трех атомов водорода при Ci может привести к образованию бутена-1; атака любого из атомов водорода при С3 может привести к бутену-2. Бутен-2 является основным продуктом, т.е. образуется быстрее, несмотря на фактор вероятности 3:2, который не благоприятствует его образованию. Этой схеме отвечают и другие примеры: преобладающим продуктом является алкен, имеющий большее число алкильных групп, связанных с атомом углерода с двойной связью.
СНз /СНз СН2
CH3CH2CBrCH3--------- ►СН3СН=С. + СНзСН2С=СН2
СНз
2- метил-2-бромбутан 71% 29%
Легкость образования алкенов. R2C=CR2>R2C=CHR>R2C=CH2>RCH=CHR>RCH=CH2 Интересно отметить, что устойчивость алкенов изменяется в точно такой же последовательности. Полезно запомнить правило, чем устойчивее алкен, тем легче он образуется в реакции дегидрогалогенирования.
Закономерность наблюдается при образовании алкенов по реакциям дегидро- галогенирования алкилгалогенидов, а также дегидратации спиртов была изучена русским ученым А.М. Зайцевым и нашла выражение в правилах Зайцева (1875 г.).
В реакциях дегидрогалогенирования образуется наиболее замещенный, т.е. наиболее устойчивый алкен. Водород реакции элиминирования отщепляется от наименее гидрогенизированного атома углерода.
Дегидратация спиртов Спирты превращаются в алкены дегидратацией, которая протекает в присутствии кислоты и при нагревании. Дегидратацию обычно проводят, либо нагревая спирт с серной или фосфорной кислотой при температуре около 2000С, либо пропуская пары спирта над окисью алюминия Al2O3 при 350-4000С, при этом окись алюминия реагирует как кислота Льюиса. Легкость дегидратации спиртов: третичные > вторичные > первичные.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|