- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
№ 4 Основні принципи класифікації мікробів. 2 страница
| № 15 Методи мікроскопії (люмінесцентна, темнопольна, фазово-контрастна, електронна). Люмінесцентна (або флюоресцентная) мікроскопія. Основана на явищі фотолюмінесценції. Люмінесценція - свічення речовин, що виникає після воздействія на них будь-яких джерел енергії: світлових, електронних променів, іонізуючого випромінювання. Фотолюмінесценція - люмінесценція об'єкта під впливом світла. Якщо освещать люминесцирующий об'єкт синім світлом, то він випускає промені червоного, оранжевого, жовтого або зеленого кольору. У результате виникає кольорове зображення об'єкта. Темнопольна мікроскопія. Мікроскопія в темному полі зренія заснована на явищі дифракції світла при сильному бічному освітленні зважених в рідині найдрібніших частинок (ефект Тиндаля). Ефект досягається за допомогою параболоід- або кардіоідконденсора, які замінюють звичайний конденсор в біологіческом мікроскопі. Фазовоконтрастна мікроскопія. Фазово-контрастну пристосування дає можливість побачити в мікроскоп прозорі об'єкти. Вони набувають високу контрастність зображення, яка може бути позитивною або негативною. Позитивним фазовим контрастом називають темне зображення об'єкта в світлому полі зору, негативним - світле зображення об'екта на темному тлі. Для фазово-контрастної мікроскопії використовують звичайний мікроскоп і додаткове фазово-контрастну пристрій, а також спеціальні освітлювачі. Електронна мікроскопія. Дозволяє спостерігати об'єкти, розміри яких лежать за межами роздільної способності світлового мікроскопа (0, 2 мкм). Електронний мікроскоп застосовується для вивчення вірусів, тонкої будови різних мікроорганізмів, макромолекулярних структур та інших субмікроскопіческіх об'єктів. |
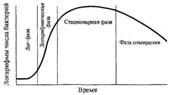
№ 16 Ріст і розмноження бактерій. Фази розмноження. Життєдіяльність бактерій характеризується зростанням - фор-мування структурно-функціональних компонентів клітини і збільшенням самої бактеріальної клітини, а також размноженіем - самовідтворенням, що призводить до збільшення колічества бактеріальних клітин в популяції. Бактерії розмножуються шляхом бінарного поділу навпіл, рідше шляхом брунькування. Актиноміцети, як і гриби, можуть размножаться спорами. Актиноміцети, будучи гілкуюються бактеріями, розмножуються шляхом фрагментації ниткоподібних клітин. Грампозитивні бактерії діляться шляхом вростання сінтезірующіхся перегородок поділу всередину клітини, а грамнегативні - шляхом перетяжки, в результаті утворення гантелевід-них фігур, з яких утворюються дві однакові клітки. Поділу клітин передує реплікація бактеріальної хромосоми по напівконсервативний типом (двуспіральная ланцюг ДНК розкривається і кожна нитка добудовується комплементарної нітью), що призводить до подвоєння молекул ДНК бактеріального ядра - нуклеоида. Реплікація ДНК відбувається в три етапи: ініціація, елонгація, або зростання ланцюга, і термінация. Розмноження бактерій в рідкому поживному середовищі. Бактерії, засіяні в певний, що не змінюється обсяг пітательной середовища, розмножуючись, споживають поживні елементи, що приводить надалі до виснаження живильного середовища і прекращенію росту бактерій. Культивування бактерій в такий сістеме називають періодичним культивуванням, а культуру - періодичною. Якщо ж умови культивування підтримуються шляхом безперервної подачі свіжої живильного середовища і відтоку такого ж об'єму культуральної рідини, то таке культівірованіе називається безперервним, а культура - безперервною. При вирощуванні бактерій на рідкому поживному середовищі спостерігається придонний, дифузний або поверхневий (у вигляді плівки) зростання культури. Зростання періодичної культури бактерій, вирощуваних на рідкому поживному середовищі, поділяють на кілька фаз, або періодів: 1. лаг-фаза; 2. фаза логарифмічного росту; 3. фаза стаціонарного росту, або максимальної концентрації бактерій; 4. фаза загибелі бактерій. Ці фази можна зобразити графічно у вигляді відрізків крівой розмноження бактерій, що відбиває залежність логаріфма числа живих клітин від часу їх культивування. Лаг-фаза - період між посевом бактерій і початком розмноження. Тривалість лаг-фази в середньому 4-5 ч. Бактерії при цьому збільшуються в размерах і готуються до поділу; наростає кількість нуклеінових кислот, білка та інших компонентів. Фаза логарифмічного (експоненціального) зростання є періодом інтенсівного ділення бактерій. Тривалість її близько 5 6 ч. При оптимальних умовах зростання бактерії можуть ділитися кожні 20-40 хв. Під час цієї фази бактерії найбільш раніми, що пояснюється високою чутливістю компонентов метаболізму інтенсивно зростаючої клітини до інгібіторів синтезу білка, нуклеїнових кислот та ін. Потім настає фаза стаціонарного росту, при якій кількість жізнеспособних клітин залишається без змін, складаючи максі-мінімальний рівень (М-концентрація). Її тривалість виражается у годинах і коливається залежно від виду бактерій, їх особливостей і культивування. Завершує процес росту бактерій фаза загибелі, що характеризується відмиранням бактерій в умовах виснаження джерел живильного середовища і накопичення в ній продуктів метаболізму бактерій. Продовж-ність її коливається від 10 год до декількох тижнів. Інтенсівность росту і розмноження бактерій залежить від багатьох факторов, у тому числі оптимального складу живильного середовища, окислювально-відновного потенціалу, рН, температури та ін. Розмноження бактерій на щільному живильному середовищі. Бактерії, що ростуть на щільних поживних середовищах, утворюють ізолірованние колонії округлої форми з рівними або нерівними краямі (S- і R-форми), різної консистенції і цвета, що залежить від пігменту бактерій. Пігменти, розчинні у воді, дифундують в пітательную середу і забарвлюють її. Другая група пігментів нерастворима у воді, але розчинна у органіческіх розчинниках. І, наконец, існують пігменти, не розчинні ні у воді, ні в органічних сполуках. Найбільш поширені серед мікроорганізмів такі пігменти, як каротини, ксантофілли і меланіни. Меланіни являются нерозчинними пігментами чорного, коричневого або червоного кольору, синтезуються з фенольних сполук. Меланіни поряд з каталазой, супероксідцісмутазой і пероксидазами захищають мікроорганізми від впливу токсичних перекисних радикалів кисню. Багато пігменти володіють антімікробним, антібіотікоподобних дією. |
№ 17 Способи отримання енергії бактеріями (дихання, броженіе). Методи культивування анаеробів.
Подих, або біологічне окислення, засноване на окіслітельно-відновних реакціях, що йдуть з утворенням АТФ-універсального акумулятора хімічної енергії. Енергія необхідна мікробної клітці для її життєдіяльності. При диханні відбуваються процеси окислення і відновлення: окислення - віддача донорами (молекулами або атомами) водорода або електронів; відновлення - приєднання водорода або електронів до акцептора. Акцептором водню або електронів може бути молекулярний кисень (таке дихання називається аеробним) або нітрат, сульфат, фумарат (таке дихання називається анаеробним - нітратних, сульфатних, фумаратним). Анаеробіоз (від грец. АЕГ - повітря + bios - життя) - життєдіяльність, що протікає за відсутності свободного кисню. Якщо донорами і акцепторами водню являются органічні сполуки, то такий процес називається бродінням. При бродінні відбувається ферментативне розщеплення органічних сполук, переважно вуглеводів, в анаеробних умовах. З урахуванням кінцевого продукту розщеплення вуглеводів розрізняють спиртове, молочнокисле, уксуснокислое та інші види бродіння. По відношенню до молекулярного кисню бактерії можна розділити на три основні групи: облігатні, тобто обязательние, аероби, облігатні анаероби і факультативні анаероби. Методи культивування анаеробів. Для культивування анаеробів необхідно знизити окислювально-відновний потенціал середовища, создать умови анаеробіозу, т. Е. Пониженого вмісту кисню в середовищі і навколишньому її просторі. Це досягається застосуванням фізичних, хімічних і біологіческіх методів. Фізичні методи. Засновані на вирощуванні мікроорганізмов в безповітряному середовищі, що досягається: 1) посівом в середовища, що містять редуцирующие і легко окислюються речовини; 2) посівом мікроорганізмів в глибину щільних пітательних середовищ; 3) механічним видаленням повітря з судин, в которих вирощуються анаеробні мікроорганізми; 4) заміною повітря в судинах яким-небудь індіфферентним газом. В якості редукуючих речовин зазвичай іспользуют шматочки (близько 0, 5 г) тварин або рослинних тканин (печінка, мозок, нирки, селезінка, кров, картопля, вата). Ці тканини пов'язують розчинений у середовищі кіслород і адсорбируют бактерії. Щоб зменшити содержаніе кисню в живильному середовищі, її перед посівом кип'ятять 10-15 хв, а потім швидко охолоджують і залівают зверху невеликою кількістю стерильного вазелінового масла. Висота шару масла в пробірці близько 1 см. В якості легко окислюється речовин використовують глюкозу, лактозу і муравьінокіслий натрій. Кращою рідким живильним середовищем з редуцірующімі речовинами є середовище Кітта - Тароцці, которая використовується з успіхом для накопичення анаеробів при первинному посіві з досліджуваного матеріалу і для підтримки зростання виділеної чистої культури анае-робов. Посів мікроорганізмів в глибину щільних середовищ проізводят за способом Віньяль - Вейона, який полягає в механічній захисту посівів анаеробів від кисню повітря. Беруть скляну трубку завдовжки 30 см і діаметром 3-6 мм. Один кінець трубки витягають в ка-пілляров у вигляді пастерівської піпетки, а в іншого кінця роблять перетяжку. У що залишився широкий кінець трубки вставляють ватяну пробку. У пробірки з розплавленим і охолодженим до 50 ° С живильним агаром засівають досліджуваний матеріал. Потім насмоктують засіяний агар у стерильні трубки Віньяль - Вейона. Капіллярний кінець трубки запаюють в полум'ї пальника і трубки поміщають в термостат. Так створюються сприятливі умови для зростання самих строгих анаеробів. Для виделенія окремої колонії трубку надрізають напільніком, дотримуючись правил асептики, на рівні колонії, ломают, а колонію захоплюють стерильною петлею і переносять в пробірку з живильним середовищем для дальнейшего вирощування та вивчення в чистому вигляді. Видалення повітря виробляють шляхом його механіческого відкачування зі спеціальних приладів - анаероста-тов, в які поміщають чашки з посівом анаеробів. Переносний анаеростатах являє собою толстостенний металевий циліндр з добре притертою кришкой (з гумовою прокладкою), забезпечений отводящим краном і вакуумметром. Після розміщення засіяних чашок або пробірок повітря з анаеростатах видаляють за допомогою вакуумного насоса. Заміну повітря індиферентним газом (азотом, водородом, аргоном, вуглекислим газом) можна робити в тих же анаеростатах шляхом витіснення його газом з балона. Хімічні методи. Засновані на поглинанні кіслорода повітря в герметично закритій посудині (анаеро-стате, ексикаторі) такими речовинами, як пирогаллол або гідросульфіт натрію Na2S204. Біологічні методи. Засновані на спільному виращіваніі анаеробів зі строгими аеробами. Для цього із застиглої агаровой пластинки по діаметру чашки вирізають стерильним скальпелем смужку агару шіріной близько 1 см. Виходить два агарових напівдиска в одній чашці. На одну сторону агаровой пластинки засевают аероб, наприклад часто використовують S. aureus або Serratia marcescens. На іншу сторону засівають анаероб. Краю чашки заклеюють пластиліном або заливають розплавленим парафіном і поміщають в термостат. При наявності відповідних умов в чашці почнуть размножаться аероби. Після того, як весь кисень у пространстве чашки буде ними використаний, почнеться зростання анаеробів (через 3-4 діб). З метою скорочення воздуш-ного простору в чашці живильне середовище наливають можливо більш товстим шаром. Комбіновані методи. Засновані на поєднанні фізіческіх, хімічних і біологічних методів створення анаеробіозу. | |
|
№ 18 Типи і механізми живлення бактерій. Типи харчування. Мікроорганізми нуждаются у вуглеводах, азоті, сірці, фосфорі, калії та інших елементах. Залежно від джерел вуглецю для живлення бактерії поділяються на аутотрофи, що використовують для побудови своїх клітин діоксид вуглецю С02 та інші неорганічні сполуки, і гетеротрофи, живляться за рахунок готових органічних сполук. Аутотрофнимі бактеріями є нитрифицирующие бактерії, що знаходяться в грунті; серобактерии, що мешкають у воді з сірководнем; железобактеріі, що живуть у воді з закисной залізом, та ін. Гетеротрофи, утилизирующие органічні залишки відмерлих організмів у навколишньому середовищі, називаються сапрофіти. Гетеротрофи, що викликають захворювання у людини або жівотних, відносять до патогенних і умовно-патогенних. Серед патогенних мікроорганізмів зустрічаються облігатні і факультатівние паразити (від грец. Parasitos - нахлібник). Облігатні паразити здатні існувати тільки всередині клітини, наприклад рикетсії, віруси і деякі найпростіші. Залежно від окисляемого субстрату, званого донором електронів або водню, мікроорганізми ділять на дві групи. Мікроорганізми, що використовують як донорів водорода неорганічні сполуки, називають літотрофни-ми (від грец. Lithos - камінь), а мікроорганізми, іспользующіе як донорів водню органічні сполуки, - органотрофи. Враховуючи джерело енергії, серед бактерій розрізняють фототрофи, тобто фотосинтезирующие (наприклад, синьо-зелені водорослі, що використовують енергію світла), і хемотрофи, нуждающіеся в хімічних джерелах енергії. Механізми харчування. Надходження різних речовин в бак-ріальних клітку залежить від величини і розчинності їх молекул в ліпідах або воді, рН середовища, концентрації речовин, різних факторів проникності мембран та ін. Клітинна стінка пропускає невеликі молекули і іони, затримуючи макромолекули масою більше 600 Д. Основним регулятором поступленія речовин у клітину є цитоплазматична мембрана. Умовно можна виділити чотири механізму проникнення пітательних речовин в бактеріальну клітину: це проста діффузія, полегшена дифузія, активний транспорт, транслокация груп. Найбільш простий механізм надходження речовин у клітину - проста дифузія, при якій переміщення речовин проісходіт внаслідок різниці їх концентрації по обидві сторони цитоплазматичної мембрани. Речовини проходять через липид-ву частину цитоплазматичної мембрани (органічні молекули, лікарські препарати) і рідше по заповненим водою каналам в цитоплазматичної мембрані. Пасивна дифузія здійснюється без витрати енергії. Полегшена дифузія відбувається також у результаті різниці концентрації речовин по обидві сторони цітоплазматіческой мембрани. Однак цей процес здійснюється з помощью молекул-переносників, що локалізуються в цітоплазматіческой мембрані і володіють специфічністю. Кожен переносчік транспортує через мембрану відповідне речовина або передає іншому компоненту цитоплазматичної мембрани - власне переносники. Білками-переносниками можуть бути пермеази, місце синтезу яких - цітоплазматіческая мембрана. Полегшена дифузія протікає без витрати енергіі, речовини переміщуються від більш високої концентрації до більш низькою. Активний транспорт відбувається за допомогою пермеаз і спрямований на перенесення речовин від меншої концентрації в сторону більшою, тобто як би проти течії, тому даний про цес супроводжується витратою метаболічної енергії (АТФ), що утворюється в результаті окисно-відновних реакцій в клітці. Перенесення (транслокація) груп схожий з активним транспортом, відрізняючись тим, що переноситься молекула відоізменяется в процесі перенесення, наприклад фосфорилируется. Вихід речовин з клітини здійснюється за рахунок дифузії та за участю транспортних систем. | |||
| № 19 Основні принципи культивування бактерій. Універсальним інструментом для виробництва посівів является бактеріальна петля. Крім неї, для посіву уколом пріменяют спеціальну бактеріальну голку, а для посівів на чашках Петрі - металеві або скляні шпателі. Для посівів рідких матеріалів поряд з петлею використовують пастеровскіе і градуйовані піпетки. Перші попередньо ізготовляют із стерильних легкоплавких скляних трубочок, які витягають на полум'я у вигляді капілярів. Кінець капілляра відразу ж запаюють для збереження стерильності. У пастерівських і градуювальних піпеток широкий кінець закривают ватою, після чого їх поміщають в спеціальні пенали або обгортають папером і стерилізують. При пересеве бактеріальної культури беруть пробірку в ліву руку, а правою, обхопивши ватяну пробку IV і V пальцями, виймають її, проносячи над полум'ям пальника. Утримуючи другімі пальцями тієї ж руки петлю, набирають нею посівної матеріал, після чого закривають пробірку пробкою. Потім у пробірку зі скошеним агаром вносять петлю з посівним матеріалом, опускаючи її до конденсату в нижній часті середовища, і зигзагоподібним рухом розподіляють мате ріал по скошеної поверхні агару. Вийнявши петлю, обпалюють край пробірки і закривають її пробкою. Петлю стерилізують в полум'ї пальника і ставлять у штатив. Пробірки з посівами надг записують, вказуючи дату посіву і характер посівного матеріала (номер дослідження або назва культури). Посіви «газоном» виробляють шпателем на поживний агар в чашці Петрі. Для цього, відкривши лівою рукою кришку, петлей або піпеткою наносять посівний матеріал на поверхню поживного агару. Потім проводять шпатель через полум'я горелкі, остуджують його про внутрішню сторону кришки і розтирають матеріал по всій поверхні середовища. Після інкубації посіву з'являється рівномірний суцільний ріст бактерій. |
|
№ 20 Штучні поживні середовища, їх класифікація. Вимоги, що пред'являються до живильних середовищ. Живильним середовищем в мікробіології називають середовища, содержащіе різні сполуки складного або простого складу, які застосовуються для розмноження бактерій або інших мікроорганізмів в лабораторних або промислових умовах. Поживні середовища готують з продуктів тваринного або рас-тітельного походження. Велике значення має наявність в живильному середовищі ростових факторів, які каталізують метаболічні процеси мікробної клітини (вітаміни группи В, нікотинова кислота та ін. ). Штучні середовища готують за певними рецептами з різних настоїв чи відварів тваринного або рослинного проісхожденія з додаванням неорганічних солей, углеводов і азотистих речовин. У бактеріологічній практиці найчастіше використовують сухі поживні середовища, які отримують на основі досягнень сучасної біотехнології. Для їх приготування використовують економічно рентабельне нехарчове сировина: втратили термін придатності кровозамінники (гидролизин-кислотний гідролізат крові тварин, аминопептид - ферментативний гідролізат крові; продукти біотехнології (кормові дріжджі, кормовий лізин, виноградна мука, белколізін). Сухі поживні середовища можуть зберігатися протягом тривалого часу, зручні при транспортуванні і мають відносно стандартний склад. За консистенцією поживні середовища можуть бути жідкімі, напіврідкими, щільними. Щільні середовища готують шляхом добавленія до рідкому середовищі 1, 5-2% агару, напіврідкі - 0, 3- 0, 7% агару. Агар являє собою продукт переробки особого виду морських водоростей, він плавиться при температурі 80-86 ° С, твердне при температурі близько 40 ° С і в застившем стані надає середовищі щільність. У деяких випадках для отримання щільних поживних середовищ використовують желатин (10-15%). Ряд природних поживних середовищ (згорнута сиворотка крові, згорнутий яєчний білок) самі по собі є щільними. За цільовим призначенням середовища поділяють на основні, елективні та діфференціально-діагностичні. До основних відносяться середовища, застосовувані для вирощування багатьох бактерій. Це триптичного гідролізати м'ясних, рибних продуктів, крові тварин або казеїну, з яких готують рідку середу - поживний бульйон і щільну - пітательний агар. Такі середовища служать основою для пріготовленія складних поживних середовищ - цукрових, кров'яних та ін., Що задовольняють харчові потреби патогенних бактерій. Елективні поживні середовища призначені для ізбірательного виділення та накопичення мікроорганізмів определенного виду (або певної групи) з матеріалів, содержащіх різноманітну сторонню мікрофлору. При створенні елективних поживних середовищ виходять з біологічних особенностей, які відрізняють дані мікроорганізми від большінства інших. Наприклад, виборчий ріст стафілококів наблюдается при підвищеній концентрації хлориду натрію, холерного вібріона - в лужному середовищі і т. Д. Диференційно-діагностичні живильні середовища пріменяются для розмежування окремих видів (або груп) мікроорганізмов. Принцип побудови цих середовищ заснований на тому, що різні види бактерій розрізняються між собою за біохіміческой активності внаслідок неоднакового набору ферментов. Особливу групу складають синтетичні і полусінтетіческіе поживні середовища. До складу синтетичних середовищ входять хімічно чисті речовини: амінокислоти, мінеральні солі, вуглеводи, вітаміни. У напівсинтетичні середовища додатково включають пептон, дріжджовий екстракт та інші поживні речовини. Ці середовища найчастіше застосовують у науково-ісследовательской роботі і в мікробіологічної промисловості при отриманні антибіотиків, вакцин та інших препаратів. В останні роки в цілях економії поживних середовищ і ускоренной ідентифікації деяких мікроорганізмів (ентеробактерії, стафілококи, стрептококи та ін. ) Застосовуються так називаемие Мікротест-системи (МТС). Вони являють собою полістиролові пластини з лунками, в яких містяться стерільние диференційно-діагностичні середовища. Стерилізацію МТС проводять УФ-опроміненням. Мікротест-системи особливо зручні при масових бактеріологічних дослідженнях в практичних лабораторіях. Вимоги, що пред'являються до живильних середовищ. Будь живильне середовище має відповідати наступним требованіям: містити всі необхідні для розмноження мікроорганізмів речовини в легкозасвоюваній формі; мати оптимальні вологість, в'язкість, рН, бути ізотонічність і по возможності прозорою. Кожну живильне середовище стерилізують певним способом залежно від її складу. |
№ 21 Принципи та методи виділення чистих культур бактерій. Чистою культурою називається популяція бактерій одного виду або одного різновиду, вирощена на живильному середовищі. Багато видів бактерій підрозділяють за однією ознакою на біологічні варіанти - біовари. Біовари, разлічающіеся за біохімічними властивостями, називають хемоварамі, по антігенним властивостям - сероварами, по чутливості до фагу - фаговаров. Культури мікроорганізмів одного і того ж виду, або биовара, виділені з різних джерел або в різний час з одного і того ж джерела, називають штамами, які зазвичай позначаються номерами або будь-якими сімволамі. Чисті культури бактерій в діагностичних бактеріологіческіх лабораторіях отримують з ізольованих колоній, пересіваючи їх петлею в пробірки з твердими або, рідше, рідкими поживними середовищами. Колонія являє собою видиме ізольоване скопленіе особин одного виду мікроорганізмів, що утворюється в результаті розмноження однієї бактеріальної клітини на щільному живильному середовищі (на поверхні або в глибині її). Колонії бактерій різних видів відрізняються один від одного за своєю морфологіі, кольором та іншими ознаками. Чисту культуру бактерій отримують для проведення диагно-стических досліджень - ідентифікації, яка досягається шляхом визначення морфологічних, культуральних, біохіміческіх та інших ознак мікроорганізму. Морфологічні та тинкторіальні ознаки бактерій вивчають при мікроскопічному дослідженні мазків, забарвлених різними методами, і нативних препаратів. Культуральні властивості характеризуються пітательнимі потребами, умовами і типом росту бактерій на плотних і рідких поживних середовищах. Вони встановлюються по морфологіі колоній і особливостям росту культури. Біохімічні ознаки бактерій визначаються набором конститутивних і індуцібельних ферментів, притаманних певному роду, виду, варіанту. У бактеріологічній практіке таксономическое значення мають найчастіше сахаролитические і протеолітичні ферменти бактерій, які определяют на диференційно-діагностичних середовищах. При ідентифікації бактерій до роду та виду звертають вніманіе на пігменти, що забарвлюють колонії і культуральну середу в різноманітні кольори. Наприклад, червоний пігмент образуют Serratia marcescens, золотистий пігмент - Staphylococcus aureus (золотистий стафілокок), синьо-зелений пігмент - Pseu-domonas aeruginosa. Для встановлення биовара (хемовара, серовара, фаготип) проводять додаткові дослідження по виялвеніб відповідного маркера - визначенню ферменту, антигену, чутливості до Фанам. Методи виділення чистих культур бактерій. Універсальним інструментом для виробництва посівів является бактеріальна петля. Крім неї, для посіву уколом пріменяют спеціальну бактеріальну голку, а для посівів на чашках Петрі - металеві або скляні шпателі. Для посівів рідких матеріалів поряд з петлею використовують пастеровскіе і градуйовані піпетки. Перші попередньо ізготовляют із стерильних легкоплавких скляних трубочок, які витягають на полум'я у вигляді капілярів. Кінець капілляра відразу ж запаюють для збереження стерильності. У пастерівських і градуювальних піпеток широкий кінець закривают ватою, після чого їх поміщають в спеціальні пенали або обгортають папером і стерилізують. При пересеве бактеріальної культури беруть пробірку в ліву руку, а правою, обхопивши ватяну пробку IV і V пальцями, виймають її, проносячи над полум'ям пальника. Утримуючи другімі пальцями тієї ж руки петлю, набирають нею посівної матеріал, після чого закривають пробірку пробкою. Потім у пробірку зі скошеним агаром вносять петлю з посівним матеріалом, опускаючи її до конденсату в нижній часті середовища, і зигзагоподібним рухом розподіляють мате ріал по скошеної поверхні агару. Вийнявши петлю, обпалюють край пробірки і закривають її пробкою. Петлю стерилізують в полум'ї пальника і ставлять у штатив. Пробірки з посівами надг записують, вказуючи дату посіву і характер посівного матеріала (номер дослідження або назва культури). Посіви «газоном» виробляють шпателем на поживний агар в чашці Петрі. Для цього, відкривши лівою рукою кришку, петлей або піпеткою наносять посівний матеріал на поверхню поживного агару. Потім проводять шпатель через полум'я горелкі, остуджують його про внутрішню сторону кришки і розтирають матеріал по всій поверхні середовища. Після інкубації посіву з'являється рівномірний суцільний ріст бактерій. | № 22 Ферменти бактерій. Ідентифікація бактерій по фер-ментатівной активності. В основі всіх метаболічних реакцій в бактеріальної клітці лежить діяльність ферментів, які належать до 6 классам: оксіредуктази, трансферази, гідролази, лігази, ліази, ізомерази. Ферменти, образуемие бактеріальної клітиною, можуть локалізоваться як усередині клітини - ендоферменти, так і виділятися в навколишнє середовище - екзоферменти. Екзоферменти відіграють велику роль у забезпеченні бактеріальної клітини доступними для проникнення всередину істочнікамі вуглецю та енергії. Більшість гидролаз є екзоферменти, які, виділяючись у навколишнє середовище, расщепляют великі молекули пептидів, полісахарідов, ліпідів до мономерів і димерів, здатних проникнути всередину клітини. Ряд екзоферментів, наприклад гиалуронидаза, коллагеназа та інші, є ферментами агресії. Деякі ферменти локалізовани в Периплазма бактеріальної клітини. Вони беруть участь у процессах переносу речовин в бактеріальну клітину. Ферментативний спектр є таксономическим ознакою, характерним для сімейства, роду і - в деяких случаях - для видів. Тому визначенням спектра ферментативної активності пользуются при встановленні таксономічного положення бактерій. Наявність екзоферментов можна визначити за допомогою діфференціально-діагностичних середовищ, тому для ідентифікації бактерій розроблені спеціальні тест-системи, що складаються з набору диференційно-діагностичних середовищ. Ідентифікація бактерій по ферментатівной активності. Найбільш часто визначають ферменти класу гідролаз і оксидоредуктаз, використовуючи спеціальні методи і середовища. Для визначення протеолітичної активності мікроорганізми засівають в стовпчик желатину уколом. Через 3-5 днів посіви переглядають і відзначають характер розрідження желатину. При розкладанні білка деякими бактеріями можуть виділятися специфічні продукти - індол, сірководень, аміак. Для їх определенія служать спеціальні індикаторні папірці, ко торие поміщають між шийкою і ватяною пробкою в пробірку з МПБ або (і) пептонною водою, засіяними досліджуваними мікроорганізмами. Індол (продукт разложенія триптофану) забарвлює в рожевий колір смужку паперу, просоченої насиченим розчином щавлевої кислоти. Папір, просочений розчином ацетату свинцю, у присутності сірководню чорніє. Для визначення аміаку використовують червону лакмусовий папірець. Для багатьох мікроорганізмів таксономическим прізнаком служить здатність розкладати певні вуглеводи з утворенням кислот і газоподібних продуктов. Для виявлення цього використовують середовища Гисса, содержащіе різні вуглеводи (глюкозу, сахарозу, мальтозу, лактозу та ін. ). Для виявлення кислот в середу доданий реактив Андреде, який змінює свій колір від блідо-жовтого до червоного в інтервалі рН 7, 2-6, 5, тому набір середовищ Гісса з ростом мікроорганізмів називають «строкатим поруч». Для виявлення газообразованія в рідкі середовища опускають поплавці або іспользуют напіврідкі середовища з 0, 5% агару. Для того щоб определіть інтенсивне кислотообразование, характерне для бродіння змішаного типу, в середу з 1% глюкози і 0, 5% пептона (середа Кларка) додають індикатор метиловий червоний, який має жовтий колір при рН 4, 5 і вище, і червоний -При більш низьких значеннях рН. Гідроліз сечовини визначають по виділенню амміака (лакмусовий папірець) і подщелачиванию середовища. При ідентифікації багатьох мікроорганізмів іспользуют реакцію Фогеса - Проскауера на ацетоін - промежуточное з'єднання при утворенні бутандіолу з піровиноградної кислоти. Позитивна реакція свідетельствует про наявність бутандіолового бродіння. Виявити каталазу можна за бульбашок кисню, які починають виділятися відразу ж після смешіванія мікробних клітин з 1% розчином перекису водорода. Для визначення цитохромоксидази застосовують реактіви: 1) 1% спиртовий розчин сс-нафтола-1; 2) 1% водний розчин N-диметил-р-фенілендіамін дигідро-хлориду. Про наявність цитохромоксидази судять по синьому фарбуванню, появляющемуся через 2-5 хв. Для визначення нітритів використовують реактів Грісса: Появленіе червоного забарвлення свідчить про налічіі нітритів. | |
| № 23 Внутрішньовидова ідентифікація бактерій (епідеміологіческое маркування). З метою виявлення епідемічної ланцюжка захворювання, в т. Ч. Для виявлення джерела інфекції, здійснюють внутрішньовидову ідентифікацію бактерій, до-раю полягає у визначенні фаготип (фаговаров), вивченні антигенних та інших властивостей виділених бактерій. Визначення фаготип - фаготіпірованіе виробляють при стафілококової інфекції, черевний тиф, паратифе В. Фаготіпірованіе - один з методів епідеміологіческого маркування. Застосовується для виявлення джерела інфекції. Виділення бактерій одного фаговаров від різних хворих вказує на спільне джерело їх зараження. Предварітельно фаготіруется. При внутрішньовидової ідентифікації бактерій, т. Е. При определеніі фаговаров (фаготип) бактерій за допомогою Фагот-бенкетування, на чашку з щільним ПС, засіяну чистою культурою збудника у вигляді «газону», завдають краплі різних діагностичних типоспецифічних фагів. Бактеріі, чутливі до фагу, лизируются (утворюється стерільное пляма, «бляшка» або так звана негативна колонія фага). На засіяні «газоном» стафілококи наносяться краплі суспензії стафілококових бактеріофагів. Через добу після інкубації в термостаті видно стерильні зони відсутності росту бактерій (стерильні «бляшки») в результаті размноженія бактеріофагів, що викликають лізис цих бактерій. | № 24 Особливості фізіології грибів.
Гриби відносяться до царства Fungi (Mycetes, Mycota). Це мно-гоклеточние або одноклітинні нефотосинтезуючі (бес-хлорофільние) еукаріотичні мікроорганізми з клітинною стінкою. Гриби за типом харчування - гетеротрофи, стосовно кисню - аероби і факультатівние анаероби. Ростуть в широких діапазонах температур (оптимальна температура 25-30 ° С), мають статевої та безстатевий способи розмноження. Тому гриби шіроко поширені в навколишньому середовищі, особливо в грунті. Гриби разом з синьо-зеленимі водоростями утворюють симбіоз у вигляді лишайника. У цьому симбіозі гриби поглощают воду і розчинні в ній речовини, а синьо-зелені водорості постачають грибам органічні сполуки. Інший вид взаімоотношеній - мікориза - симбіоз грибів і коренів вищих рослин. Гриби культивують протягом декількох діб на суслі-агарі або рідкому суслі, середовищі Сабуро, Чапека та ін. Для цієї мети можна використовувати лабораторних тварин. Деякі гриби мають диморфізмом, т. Е. Здатністю утворювати нитчасті і дріжджові форми залежно від умов зростання. Дріжджоподібні форми часто образуются in vivo, т. Е. При інфікуванні человека грибами. Розмноження грибів відбувається статевим і безстатевим (вегетативним) способами. Статеве розмноження грибів відбувається з утворенням гамет, статевих суперечка та інших полових форм. Статеві форми називаються телеоморфи. Безстатеве (вегетативне) розмноження грибів відбувається з утворенням відповідних форм, званих Анаморф. Типи грибів. Виділяють 3 типи грибів, що мають статевий спосіб розмноження (так називаемие вчинені гриби): зігоміцети (Zygomycota), аскоміцети (Ascomycota) і базидіоміцети (Basidiomycota). Окремо виділяють умовний, формальний тип / групу грибів - дейтероміцети (Deiteromycota), у яких є тільки безстатевий спосіб розмноження (так звані недосконалі гриби). |
№ 25 Особливості фізіології найпростіших. Найпростіші - еукаріотичні одноклітинні мікроорганізми, складові подцарство Protozoa в царстві жівотних (Animalia); є одноклітинними тваринами. Зовні найпростіші оточені мембраною (пеллікулой) - аналогом цитоплазматичної мембрани клітин тварин. Вони містять: ядро з ядерною оболонкою і ядерцем; цітоплазму, що складається з ЕПР, мітохондрій, лізосом, численних рибосом та ін. Розміри найпростіших коливаються в середньому від 2 до 100 мкм. Зовні вони оточені мембраной (пеллікулой) - аналогом цитоплазматичної мембрани клітин тварин. Найпростіші представлено 7 типами, з яких чотири типи (Sarcomastigophora, Apicomplexa, Ciliopkora, Microspora) включають збудників захворювань у людини. Найпростіші мають: органи руху (джгутики, війки, псевдоподии), харчування (травні вакуолі) і виделенія (скоротливі вакуолі); можуть харчуватися в результаті фагоцитозу або утворення особливих структур. Деякі найпростіші мають опорні фібрили. Розмножуються бесполим шляхом - подвійним поділом або множинним деленіем (шизогонія), а деякі і статевим шляхом (спорогонія). Багато хто з них при несприятливих умовах утворюють цисти - покояться стадії, стійкі до зміни температури, вологості та ін. При фарбуванні за Романовським- Гімзою ядро найпростіших забарвлюється в червоний, а цітоплазма-в блакитний колір. За типом харчування вони можуть бути гетеротрофами або ауто-трофі. Багато найпростіші (дизентерійна амеба, лямбліі, трихомонади, лейшмании, балантидії) можуть рости на поживних середовищах, що містять нативні білки і амінокіслоти. Для їх культивування використовуються також культури клітин, курячі ембріони та лабораторні тварини. | |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|