
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Кислоты.
H3PO3 фосфористая кислота.
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
H3PO4 ортофосфорная кислота
H3PO4 ортофосфорная кислота – бесцветное кристаллическое вещество.
В нормальных условиях H3PO4 химически инертна, при нагревании взаимодействует с металлами, их оксидами и гидроксидами, солями:
2H3PO4 + 3Mg = Mg3(PO4)2 + 3H2
3H3PO4 + 4Fe = FeHРО4 + Fe3(PO4)2 + 4H2
2H3PO4 + 3MgO = Mg3(PO4)2 + 3H2O
H3PO4 + КОН = KH2РО4 + H2O
H3PO4 + 2КОН = К2НРО4 + 2H2O
H3PO4 + 3КОН = К3РО4 + 3H2O
2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2 + 6H2O
H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
2H3PO4 + 3NH3 = NH4H2PO4 + (NH4)2HPO4
Н3PO4 + 3AgNO3 = Ag3PO4↓ + 3НNO3 (качественная реакция на PO43−)
Н3PO4 + 3NaHCO3 = Na3PO4 + CO2 + 3H2O
При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7
2H3PO4  H2P2O7 + H2O
H2P2O7 + H2O
пирофосфорная кислота
Соли.
Соли фосфорной кислоты: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
Фосфаты.
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO3
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Ca3(PO4)2 + 8C = Ca3P2 + 8CO
3Ca3(PO4)2 + 16Al = 3Ca3P2 + 8Al2O3
Гидрофосфаты.
K2HPO4 + H3PO4 = 2KH2PO4
K2HPO4 + KOH = K3PO4 + H2O
4Na2HPO4(разб.) + 3CaCl2 = Ca3(PO4)2 + 6NaCl + 2NaH2PO4
Na2HPO4(конц.) + CaCl2 = CaHPO4 + 2NaCl
2Na2HPO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3 + NaH2PO4
Дигидрофосфаты.
3NaH2 PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3 + 2H3PO4
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Фосфор. Соединения фосфора.
1. Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
2. Ортофосфат кальция прокалили с углем и речным песком. Образовавшееся при этом белое светящееся в темноте вещество сожгли в атмосфере хлора. Продукт этой реакции растворили в избытке гидроксида калия. К полученной смеси прилили раствор гидроксида бария. Напишите уравнения описанных реакций.
3. Простое вещество, полученное при нагревании смеси фосфата кальция с коксом и оксидом кремния, растворяется в растворе едкого кали. Выделяющееся газообразное вещество сожгли, продукты горения собрали и охладили, а в полученный раствор добавили нитрат серебра. Напишите уравнения описанных реакций.
4. Смесь ортофосфата кальция, кокса и песка нагрели в электрической печи. Один из продуктов этой реакции может самовоспламеняться на воздухе. Твердый продукт горения этого вещества при нагревании растворили в воде и через полученный раствор пропустили газообразный аммиак. Напишите уравнения описанных реакций.
5. Простое вещество, смесь которого с бертолетовой солью используется в спичках и воспламеняется при трении, сожгли в избытке кислорода. Твердое вещество белого цвета, образовавшееся в результате сгорания, растворили в избытке раствора гидроксида натрия. Полученная при этом соль с раствором нитрата серебра образует осадок ярко-желтого цвета. Напишите уравнения описанных реакций.
6. Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода, при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций.
7. Фосфор сожгли в избытке хлора, образующееся твердое вещество смешали с фосфором и нагрели. Продукт реакции обработали водой, при этом выделился бесцветный газ с резким запахом. Раствор добавили к подкисленному серной кислотой раствору перманганата калия, который в результате реакции обесцветился. Напишите уравнения описанных реакций.
8. Продукт взаимодействия фосфида магния с водой сожгли и продукты реакции поглотили водой. Образовавшееся вещество используется в промышленности для получения двойного суперфосфата из фосфорита. Напишите уравнения описанных реакций.
9. Фосфин пропустили через горячий раствор концентрированной азотной кислоты. раствор нейтрализовали негашеной известью, выпавший осадок отделили, смешали с коксом и кремнезёмом и прокалили. Продукт реакции, который светится на воздухе, нагрели в растворе едкого натра. Напишите уравнения описанных реакций.
10. Красный фосфор сожгли в атмосфере хлора. Продукт реакции обработали избытком воды и в раствор добавили порошкообразный цинк. Выделившийся газ пропустили над нагретым оксидом двухвалентного железа. Напишите уравнения описанных реакций.
11. Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт реакции при нагревании растворили в большом количестве воды. После нейтрализации полученного раствора пищевой содой в него добавили нитрат серебра. Напишите уравнения описанных реакций.
12. К твёрдому веществу, которое образуется при сжигании фосфора в избытке хлора, добавили фосфор и смесь нагрели. Продукт реакции обработали небольшим количеством горячей воды и в полученный раствор добавили подкисленный серной кислотой раствор перманганата калия. Напишите уравнения описанных реакций.
13. Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
14. Фосфат кальция прокалили с углем в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
15. Фосфат кальция прокалили с песком и углем. Полученное простое вещество сожгли в кислороде, продукт реакции растворили в воде и нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
16. Фосфор сожгли в избытке кислорода, а образовавшееся вещество сплавили с оксидом натрия. полученную соль разделили на две части: первую ввели в реакцию с хлоридом кальция, а вторую – с нитратом серебра. Напишите уравнения описанных реакций.
17. Красный фосфор окислили кипящей азотной кислотой. Выделившийся при этом газ поглотили раствором гидроксида калия. Продукт окисления в первой реакции нейтрализовали гидроксидом натрия, а к образовавшейся реакционной массе по каплям добавили раствор хлорида кальция до прекращения выпадения осадка. Напишите уравнения описанных реакций.
Фосфор. Соединения фосфора. (ответы)
1) Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
PH3 + 2O2 = H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO3
2) Ca3(PO4)2 + 5C + 3SiO2
3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
2K3PO4 + 3Ba(OH)2 = Ba3(PO4)2 + 6KOH
3) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 3H2O = 2H3PO4 или
PH3 + 2O2 = H3PO4
H3PO4 + 3AgNO3 = Ag3PO4↓ + 3HNO3
4) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
4P + 5O2 = 2P2O5 или P4 + 5O2 = P4O10
P2O5 + 3H2O = 2H3PO4
2H3PO4 + 3NH3 = NH4H2PO4 + (NH4)2HPO4
5) 6P + 5KClO3 = 5KCl + 3P2O5
4P + 5O2 = 2P2O5
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
6) P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2Na2HPO4  Na4P2O7 + H2O
Na4P2O7 + H2O
7) 2P + 5Cl2 = 2PCl5
3PCl5 + 2P = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
или, так как ортофосфат марганца нерастворим
15H3PO3 + 6KMnO4 + 3H2SO4 = 11H3PO4 + 3K2SO4 + 2Mn3(PO4)2↓ + 9H2O
8) Mg3P2 + 6H2O = 3Mg(OH)2↓ + 2PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 3H2O = 2H3PO4
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
9) PH3 + 8HNO3(конц. гор.) = H3PO4 + 8NO2 + 4H2O
2H3PO4 + 3CaO = Ca3(PO4)2↓ + 3H2O
2HNO3 + CaO = Ca(NO3)2 + H2O
Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
10) 2P + 5Cl2 = 2PCl5
PCl5 + 4H2O = H3PO4 + 5HCl↑
3Zn + 2H3PO4 = Zn3(PO4)2↓ + 3H2
H2 + FeO = Fe + H2O
11) 4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3NaHCO3 = Na3PO4 + 3CO2 + 3H2O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
12) 2P + 5Cl2 = 2PCl5
3PCl5 + 2P = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
13) 2P + 3Cl2 = 2PCl3
PCl3 + 3H2O = H3PO3 + 3HCl
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
10HCl + 2KMnO4 + 3H2SO4 = 5Cl2 + K2SO4 + 2MnSO4 + 8H2O
или
16HCl + 2KMnO4 = 5Cl2 + 2KCl + MnCl2 + 8H2O
14) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO3 + 5KCl + 4H2O
2K3PO3 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6KOH
15) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
16) 4P + 5O2 = 2P2O5
P2O5 + 3Na2O = 2Na3PO4
2Na3PO3 + 3CaCl2 = Ca3(PO4)2↓ + 6NaCl
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Сера. Соединения серы.
Сера.
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
Взаимодействие с неметаллами:
S + H2 = H2S
3S + 2P = P2S3
2S + C = CS2
S + O2 = SO2
S + Cl2 = SCl2 (S2Cl2)
S + 3F2 = SF6
Взаимодействие с металлами приводит к образованию соответствующих сульфидов:
S + Fe = FeS
S + Hg = HgS
3S + 2Al = Al2S3
При взаимодействии со сложными веществами (окислителями) сера проявляет свойства восстановителя:
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
S + 2H2SO4 = 3SO2 + 2H2O
S + 2KClO3 = 3SO2 + 2KCl
При кипячении в щелочах сера растворяется с образованием сульфитов и сульфидов:
S + NaOH = Na2SO3 + Na2S + H2O
S + H2O (пар) = 2H2S + SO2
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 = Na2S2O3
Соединения серы.
Сероводород.
В реакциях сероводород проявляет свойства сильного восстановителя (степень окисления серы −2)
При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 = 2S↓ + 2H2O
В избытке кислорода:
2H2S + 3O2 = 2SO2↑ + 2H2O
При взаимодействии с бромом, хлором сероводород окисляется до свободной серы:
H2S + Br2 = 2HBr + S↓
H2S + Cl2 = 2HCl + S↓
H2S + 4Cl2 + 4H2O = + H2SO4 + 8HCl
В целом большинство окислителей окисляют H2S с образованием серы:
2H2S + SO2 = 3S + 2H2O
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
2H2S + 4Ag + O2 = 2Ag2S + 2H2O
H2S + 2HNO3(конц.) = S + 2NO2 + 2H2O
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
H2S + H2SO4(конц.) = S + SO2 + 2H2O (кип.)
H2S + 8HNO3(конц.) = H2SO4 + 8NO2 + 4H2O (кип.)
H2S + 3H2SO4(конц.) = 4SO2 + 4H2O
Оксиды.
Оксид серы (IV). Сернистый газ.
Получить SO2 можно сжиганием серы, сероводорода, обжигом сульфидов, действием на сульфиты более сильной кислотой:
S + O2 = SO2
2H2S + 3O2 = 2SO2 + 2H2O
2CuS + 3O2 = 2SO2 + 2CuO
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
Оксид серы (IV) (сернистый газ). Степень окисления серы в SO2 +4 может повышаться, понижаться или оставаться неизменной.
Без изменения степени окисления проходят те реакции SO2, в которых он проявляет общие свойства кислотного оксида:
▪ взаимодействие с водой:
SO2 + H2O ↔ H2SO3
▪ взаимодействие с основными оксидами:
SO2 + Na2O = Na2SO3
▪ взаимодействие со щелочами.
SO2 + 2NaOH(избыток) = Na2SO3 + H2O
SO2 + NaOH(избыток) = NaHSO3
SO2 + Na2CO3 = Na2SO3 + CO2
Наиболее ярко выражены восстановительные свойства SO2; степень окисления серы в таких реакциях повышается:
2SO2 + O2 = 2SO3
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
SO2 + 2HNO3 = H2SO4 + 2NO2
SO2 + O3 = SO3 + O2
5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + 2MnSO4 + K2SO4 качественная реакция на SO2 и на сульфит ион SO32− (обесцвечивание раствора)
SO2 + PbO2 = PbSO4
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства:
SO2 + 2Н2S = 3S + 2H2O
SO2 + 2CO 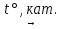 2СО2 + S
2СО2 + S
Оксид серы (VI). Серный ангидрид.
При обычных условиях – бесцветная ядовитая жидкость.
Оксид серы (VI) получают окислением оксида серы (IV) кислородом воздуха при нагревании в присутствии катализатора, термическим разложением сульфатов, взаимодействием SO2 с озоном, с NO2:
2SO2 + O2 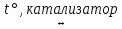 2SO3
2SO3
Fe2(SO4)3 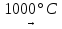 Fe2O3 + 3SO3 (в смеси с SO2 и O2)
Fe2O3 + 3SO3 (в смеси с SO2 и O2)
SO2 + O3 = SO3 + O2
SO2 + NO2 = SO3 + NO
Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 + 2KI = I2 + K2SO3
3SO3 + H2S = 4SO2 + H2O
5SO3 + 2P = P2O5 + 5SO2
Оксид серы (VI) является типичным кислотным оксидом:
SO3 + H2O = H2SO4
SO3 + MgO = MgSO4
SO3 + 2NaOH(избыток) = Na2SO4 + H2O
SO3 + NaOH(избыток) = NaHSO4
Кислоты.
H2SO4 серная кислота.
Разбавленная серная кислота обладает всеми свойствами сильных нелетучих кислот (взаимодействует с основными и амфотерными оксидами, с основаниями, амфотерными гидроксидами с образованием соответствующих солей, с металлами стоящими в ряду напряжений до водорода (кроме Pb) вытесняет летучие и более слабые кислоты из их солей.
H2SO4 + CuO = CuSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
H2SO4 + 2NaOH(избыток) = Na2SO4 + 2H2O
H2SO4(избыток) + NaOH = NaHSO4 + H2O
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
H2SO4(разб.) + Fe = FeSO4 + H2↑
H2SO4 + Na2CO3 = Na2SO4 + CO2↑ + H2O
H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3↓
Качественной реакцией на сульфат-ион является взаимодействие с растворимыми соединениями бария. Белый осадок BaSO4нерастворим в воде и кислотах.
SO42− + Ba2+ = BaSO4↓
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до SO2. С активными металлами может восстанавливаться до S, Н2 S.
Fe, Al, Cr пассивируются концентрированной серной кислотой на холоду. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2 Al  Al2(SO4)3 + 3SO2 + 6H2O
Al2(SO4)3 + 3SO2 + 6H2O
2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg = HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag = Ag2SO4 + SO2↑+ 2H2O
5H2SO4(конц.) + 4Zn = 4ZnSO4 + H2S↑ + 4H2O
5H2SO4(конц.) + 4Mg = 4MgSO4 + H2S↑ + 4H2O
Окислителем концентрированная серная кислота выступает и по отношению к неметаллам:
5H2SO4(конц.) + 2P = 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С = СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S = 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr = Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI = 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S = 4S↓ + 4H2O
Концентрированная серная кислота способна вытеснять летучие кислоты из их солей:
H2SO4(конц.) + NaCl(тв.) = NaHSO4 + HCl↑
H2SO4(конц.) + NaNO3(тв.) = NaHSO4 + HNO3
H2SO4(конц.) + NaClO4 = NaHSO4 + HClO4↑
Соли.
Сульфиды.
Сульфиды, как и оксиды в зависимости от характера и степени окисления второго элемента могут быть основными (Na2S, K2S), амфотерными (Al2S3, Cr2S3), кислотными (SiS2, P2S3) что наглядно проявляется при гидролизе этих соединений.
Na2S + H2O ↔ NaHS + NaOH
S2− + H2O ↔ HS− + OH−
Al2S3 + 12H2O = 2Al(OH)3 + 3H2S
SiS2 + 2H2O = SiO2 + 2H2S
При взаимодействии с окислителями сульфиды проявляют свойства восстановителей:
CuS + 4H2SO4(конц. гор.) = CuSO4 + 4SO2 + 4H2O
CuS + 8HNO3(конц. гор.) = CuSO4 + 8NO2 + 4H2O
СuS + Cl2 = CuCl2 + S
2CuS + 3O2 = 2CuO + 2SO2
Cr2S3 + 6H2SO4(конц.) = Cr2(SO4)3 + 3S + 3SO2 + 6H2O
Cr2S3 + 30HNO3(конц. гор.) = 2Cr(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
Cr2S3 + 12NaOH (конц.) = 2Na3[Cr(OH)6] + 3Na2S + 6H2O
2Cr2S3 + 9O2 = 2Cr2O3 + 6SO2
HgS + 10HNO3(конц.) = Hg(NO3)2 + H2SO4 + 8NO2 + 4H2O
ZnS + 4H2SO4(конц. гор.) = ZnSO4 + 4SO2 + 4H2O
ZnS + 8HNO3(конц.) = ZnSO4 + 8NO2 + 4H2O
2ZnS + 3O2 = 2SO2 + ZnO
Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−:
Na2S + Pb(NO3)2 = PbS↓ + 2NaNO3
черный
Na2S + 2AgNO3 = Ag2S↓ + 2NaNO3
черный
Na2S + Cu(NO3)2 = CuS↓ + 2NaNO3
черный
Сульфиты.
Na2SO3 + 2H2SO4конц.) = 2NaHSO4 + SO2 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
Na2SO3 + S = Na2S2O3
3Na2SO3 + 4H2SO4 + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O
Na2SO3 + S = Na2S2O3
Сульфаты.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова соль
CaSO4 ∙ 2H2O − гипс
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O − кристаллическая сода
Сульфаты щелочных металлов не разлагаются даже при нагревании до 1000°С.
Сульфаты таких металлов, как Cu, Al, Zn, Cr, Fe (II) подвергаются термическому разложению на оксид металла и SO2 и O2; в FeSO4 Fe (II) окисляется до Fe (III), а сульфаты самых тяжелых металлов разлагаются до металла:
2CuSO4
2CuO + SO2 + O2 (SO3)
2Al2(SO4)3  2Al2O3 + 6SO2 + 3O2
2Al2O3 + 6SO2 + 3O2
2ZnSO4  2ZnO + SO2 + O2
2ZnO + SO2 + O2
2Cr2(SO4)3  2Cr2O3 + 6SO2 + 3O2
2Cr2O3 + 6SO2 + 3O2
4FeSO4  2Fe2O3 + 4SO2 + O2
2Fe2O3 + 4SO2 + O2
Сера. Соединения серы.
1. В нагретую концентрированную серную кислоту внесли медную проволоку и выделяющийся газ пропустили через избыток раствора едкого натра. Раствор осторожно выпарили, твердый остаток растворили в воде и нагрели с порошкообразной серой. Непрореагировавшую серу отделили фильтрованием и к раствору прибавили серную кислоту, при этом наблюдали образование осадка и выделяется газ с резким запахом. Напишите уравнения описанных реакций.
2. Сернистый газ пропустили через раствор перекиси водорода. Из образовавшегося раствора выпарили воду и к остатку добавили магниевую стружку. Выделившийся газ пропустили через раствор медного купороса. Выпавший осадок черного цвета отделили и подвергли обжигу. Напишите уравнения описанных реакций.
3. При обжиге некоторого минерала А, состоящего из двух элементов, образуется газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. При взаимодействии вещества Б, состоящего из тех же элементов, что и минерал А, но в другом соотношении, с концентрированной хлороводородной кислотой выделился ядовитый газ с запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется простое вещество желтого цвета и вода. Напишите уравнения описанных реакций.
4. Твердое вещество, образующееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций.
5. Раствор средней соли, образующейся при пропускании сернистого газа через раствор щелочи, на длительное время оставили на воздухе. Твердое вещество, образующееся после выпаривания раствора, смешали с коксом и нагрели до высокой температуры. При добавлении к твердому продукту реакции соляной кислоты выделился газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
6. Сернистый газ растворили в воде и раствор нейтрализовали, добавляя едкий натр. В образовавшийся раствор добавили перекись водорода и после окончания реакции ─ серную кислоту. Напишите уравнения описанных реакций.
7. Несколько гранул цинка внесли в сосуд с концентрированной серной кислотой. Выделяющийся газ пропустили через раствор ацетата свинца (II), осадок отделили, подвергли обжигу и образовавшийся газ ввели во взаимодействие с водным раствором перманганата калия. Напишите уравнения описанных реакций.
8. К нагретой концентрированной серной кислоте добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагрели с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
9. На сульфид двухвалентного железа подействовали раствором соляной кислоты, выделившийся газ собрали и сожгли в воздухе. Продукты реакции пропустили через избыток раствора едкого кали, после чего в образовавшийся раствор добавили раствор перманганата калия. Напишите уравнения описанных реакций.
10) Пирит подвергли обжигу, полученный газ с резким запахом пропустили через сероводородную кислоту. Образовавшийся желтоватый осадок отфильтровали, просушили, смешали с концентрированной азотной кислотой и нагрели. Полученный раствор дает осадок с нитратом серебра. Напишите уравнения описанных реакций.
11) Газ, полученный при обжиге пирита, вступил в реакцию с сероводородом. полученное в результате реакции вещество желтого цвета обработали концентрированной азотной кислотой при нагревании. К образовавшемуся раствору прилили раствор хлорида бария. Напишите уравнения описанных реакций.
12) Сульфид цинка подвергли обжигу. Образовавшийся газ с резким запахом пропустили через раствор сероводорода до выпадения желтого осадка. Осадок отфильтровали, просушили и с алюминием. Полученное соединение поместили в воду до прекращения реакции.
Напишите уравнения описанных реакций.
13) Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Напишите уравнения описанных реакций.
14) Некоторое количество сульфида железа (II) разделили на две части. Одну часть обработали соляной кислотой, а другую часть подвергли обжигу на воздухе. При взаимодействии выделившихся газов получилось желтое вещество, которое нагрели с концентрированной азотной кислотой. Напишите уравнения описанных реакций.
15) Серу нагрели в атмосфере хлора. Полученный продукт обработали концентрированной серной кислотой при нагревании. Выделившийся при этом сернистый газ растворили в избытке раствора гидроксида калия. Получившаяся соль прореагировала с порошком серы при кипячении раствора. Напишите уравнения описанных реакций.
16) Порошок сульфида хрома (III) растворили в серной кислоте. При этом выделился газ и образовался окрашенный раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом черный осадок побелел после обработки его пероксидом натрия. Напишите уравнения описанных реакций.
17) Калий сплавили с серой. Полученную соль обработали соляной кислотой. Выделившийся при этом газ пропустили через раствор бихромата калия в кислой среде. Выпавшее вещество желтого цвета отфильтровали и сплавили с алюминием. Напишите уравнения описанных реакций.
18) Железо сплавили с серой, полученную соль обработали разбавленной серной кислотой. Выделившийся газ сожгли в избытке кислорода, а образовавшееся соединение поглотили раствором гидроксида калия. Напишите уравнения описанных реакций.
19) Серу сплавили с алюминием, полученную соль растворили в воде. Выпавший осадок растворили в избытке гидроксида калия, а газ сожгли в избытке кислорода. Напишите уравнения описанных реакций.
20) Серу растворили в кипящем растворе гидроксида натрия. к полученному раствору добавили хлорид цинка, выпавший осадок отфильтровали и сожгли а кислороде. Образовавшийся при этом газ прореагировал с сероводородом. Напишите уравнения описанных реакций.
21) Оксид серы (IV) окислили кислородом в присутствии катализатора. Образовавшееся вещество поглотили избытком гидроксида натрия, а к полученному раствору добавили раствор хлорида бария. Выпавший осадок отфильтровали и прокалили с коксом. Напишите уравнения описанных реакций.
Сера. Соединения серы.
1) 2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
SO2 + 2NaOH(избыток) = Na2SO3 + H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
2) SO2 + H2O2 = H2SO4
5H2SO4(конц.) + 4Mg = 4MgSO4 + H2S↑ + 4H2O
H2S + CuSO4 = CuS↓ + H2SO4
2CuS + 3O2 = 2CuO + 2SO2↑
3) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
FeS + 2HCl = FeCl2 + H2S↑
2H2S + SO2 = 3S↓ + 2H2O
4) SO2 + 2H2S = 3S↓ + 2H2O
3S + 2Al = Al2S3
Al2S3 + 3H2SO4 = Al2(SO4)3 + 3H2S↑
Al2(SO4)3 + 3K2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
5) SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + O2 = 2Na2SO4
Na2SO4 + 4C  Na2S + 4CO↑
Na2S + 4CO↑
Na2S + 2HCl = 2NaCl + H2S↑
6) SO2 + H2O = H2SO3
H2SO3 + 2NaOH = Na2SO3 + 2H2O
Na2SO3 + H2O2 = Na2SO4 + H2O
Na2SO4 + H2SO4 = 2NaHSO4
7) 5H2SO4(конц.) + 4Zn = 4ZnSO4 + H2S↑ + 4H2O
H2S + (CH3COO)2Pb = PbS↓ + 2CH3COOH
2PbS + 3O2 = 2PbO + 2SO2↑
5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + 2MnSO4 + K2SO4
8) 2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
9) FeS + 2HCl = FeCl2 + H2S↑
2H2S + 3O2 = 2SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
K2SO3 + 2KOH + 2KMnO4 = K2SO4 + 2K2MnO4 + H2O
10) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
SO2 + 2H2S = 3S↓ + 2H2O
S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O
H2SO4 + 2NaNO3 = BaSO4↓ + 2HNO3
11) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
SO2 + 2H2S = 3S↓ + 2H2O
S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O
H2SO4 + NaCl2 = BaSO4↓ + 2HCl
12) 2ZnS + 3O2 = 2ZnO + 2SO2↑
SO2 + 2H2S = 3S↓ + 2H2O
3S + 2Al = Al2S3
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S↑
13) ZnS + 2HCl = ZnCl2 + H2S↑
H2S + 2NaOH = Na2S + 2H2O
Na2S + FeCl2 = FeS + 2NaCl
4FeS + 7O2 = 2Fe2O3 + 4SO2↑
14) FeS + 2HCl = FeCl2 + H2S↑
4FeS + 7O2 = 2Fe2O3 + 4SO2↑
SO2 + 2H2S = 3S↓ + 2H2O
S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O
15) S + Cl2 = S2Cl2
S2Cl2 + 3H2SO4 = 5SO2 + 2HCl + 2H2O
SO2 + 2KOH = K2SO3 + H2O
K2SO3 + S = K2S2O3
16) Cr2S3 + 3H2SO4 = Cr2(SO4)3 + H2S↑
Cr2(SO4)3 + 6NH3 + 6H2O = 2Cr(OH)3↓ + 3(NH4)2SO4
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
PbS + 4H2O2 = PbSO4 + 4H2O
17) 2K + S = K2S
K2S + 2HCl = 2KCl + H2S↑
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3S + 2Al = Al2S3
18) Fe + S = FeS
FeS + H2SO4 = FeSO4 + H2S↑
2H2S + 3O2 = 2SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
19) 2Al + 3S = Al2S3
Al2S3 + 3H2O = 2Al(OH)3↓ + H2S↑
Al(OH)3 + 3KOH = K3[Al(OH)6]
2H2S + 3O2 = 2SO2 + 2H2O
20) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Na2S + ZnCl2 = ZnS↓ + 2NaCl
2ZnS + 3O2 = 2SO2 + 2ZnO
2H2S + 3O2 = 2SO2 + 2H2O
21) 2SO2 + O2 = 2SO3
2NaOH + SO3 = Na2SO4 + H2O
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
BaSO4 + 4C  BaS + 4CO
BaS + 4CO
Галогены.
Хлор. Соединения хлора.
i.
Хлор.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
NaCl → Na+ + Cl−
K: Na+ + 1e → Naº 2
A: 2Cl− ̶ 2e → Cl2º 1
2Na+ + 2Cl− 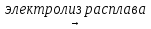 2Na º + Cl2º ↑
2Na º + Cl2º ↑
2NaCl 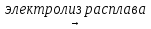 2Na + Cl2↑
2Na + Cl2↑
K: 2H2O + 2e → H2° + 2OH− 1
A: 2Cl− ̶ 2e → Cl2° 1
2H2O + 2Cl−  H2°↑ + 2OH− + Cl2°↑
H2°↑ + 2OH− + Cl2°↑
2NaCl + 2H2O  H2↑ + 2NaOH + Cl2↑
H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием соляной кислоты с сильными окислителями, например:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами – неметаллами и металлами, – так и со сложными веществами:
Cl2 + H2 = 2HCl
3Cl2 + 2P = 2PCl3
5Cl2 + 2P = 2PCl5
2Cl2 + Si = SiCl4
2Cl2 + C (кокс) + 2H2O (пар) = CO2 + 4HCl
Cl2 + 2Na = 2NaCl
Cl2 + Mg = MgCl2
Cl2 + Cu = CuCl2
3Cl2 + 2Fe = 2FeCl3
Cl2 + H2O ↔ HCl + HClO
2Cl2 + 2H2O = 4HCl + O2 (на свету или кип.)
Сl2 + 2NaOH (хол.) = NaCl + NaClO + H2O
3Cl2 + 6NaOH (гор.) = 5NaCl + NaClO3 + 3H2O
2Сl2 + 2Са(OH) (хол.) = СaCl2 + Сa(ClO)2 + 2H2O
Cl2 + 2NaI = 2NaCl + I2
Cl2 + 2NaBr = 2NaCl + Br2
Cl2 + 3H2O2 = 2HCl + 2H2O + O2
Cl2 + H2S = S + 2HCl
Cl2 + H2O + Na2SO3 = 2HCl + Na2SO4
ii.
Соединения хлора.
1.
Хлороводород.
Хлороводород получают действием концентрированной соляной кислоты на твердый хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
Хлороводород получают также прямым взаимодействием простых веществ:
Cl2 + H2
2. Кислоты.
Соляная кислота.
В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами, стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl2 + H2
2HCl + CaO = CaCl2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H
((__lxGc__=window.__lxGc__||{'s':{},'b':0})['s']['_228469']=__lxGc__['s']['_228469']||{'b':{}})['b']['_699880']={'i':__lxGc__.b++};
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|