
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 5 страница
1) ZnO + 2HCl = ZnCl2 + H2O
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2HNO3(недостаток) = Zn(OH)2↓ + 2NaNO3 + 2H2O
2) 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
HNO3 + NaOH = NaNO3 + H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
3) ZnO + H2SO4 = ZnSO4 + H2O
2ZnSO4  2ZnO + 2SO2 + O2
2ZnO + 2SO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
4) 2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
Zn(OH)2 + 4(NH3 · H2O) = [Zn(NH3)4](OH)2 + 4H2O
5) 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
NH4NO3  N2O + 2H2O
N2O + 2H2O
ZnO + C  Zn + CO
Zn + CO
6) Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Na2[Zn(OH)4] + 2HNO3 = Zn(OH)2↓ + 2NaNO3 + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
7) 4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
ZnSO4 + Ba(NO3)2 = Zn(NO3)2 + BaSO4
Zn(NO3)2 + Mg = Zn + Mg(NO3)2
2Mg(NO3)2  2Mg(NO2)2 + O2↑
2Mg(NO2)2 + O2↑
8) 2ZnS + 3O2 = 2ZnO + 2SO2↑
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + CO2 = Zn(OH)2 + Na2CO3 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
9) ZnS + 2HCl = ZnCl2 + H2S↑
2ZnS + 3O2 = 2ZnO + 2SO2↑
2H2S + SO2 = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
10) Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
H2 + 2Li = 2LiH
K2[Zn(OH)4] + 2HCl = 2KCl + Zn(OH)2↓
Zn(OH)2  ZnO + H2O
ZnO + H2O
Медь и соединения меди.
i.
Mедь.
Медь – химически малоактивный металл, в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II).
2Cu + H2O + CO2 = (CuOH)2CO3
При нагревании медь реагирует с достаточно сильными окислителями,
с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 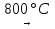 2Cu2О 2Cu + О2
2Cu2О 2Cu + О2 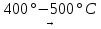 2CuО
2CuО
С галогенами , серой:
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Cu + S 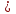 CuS
CuS
Медь растворяется в кислотах-окислителях:
при нагревании в концентрированной серной кислоте:
Cu + 2H2SO4(конц.)  CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
без нагревания в азотной кислоте:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб..) = 3Cu(NO3)2 + 2NO2 + 4H2O
3Cu + 2HNO3 + 6HCl = 3CuCl2 + 2NO + 4H2O
Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
ii.
Соединения меди.
1.
Оксиды.
Оксид меди (II)
В лаборатории оксид меди (II) получают окислением меди при нагревании, или прокаливанием (CuOH)2CO3, Cu(NO3)2:
2Cu + O2  2CuO
2CuO
(CuOH)2CO3  2CuO + CO2 + H2O
2CuO + CO2 + H2O
2Cu(NO3)2  2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
Оксид меди проявляет слабо выраженные амфотерные свойства (с преобладаниемосновных). СuO взаимодействует с кислотами:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
CuO + 2H+ = Cu2+ + H2O
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
3CuO + 2NH3  3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
СuO + C = Cu + CO
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
В лаборатории его получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2  CH3COOH + Cu2O↓ + 2H2O
CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2  CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Оксид меди (I) обладает основными свойствами. При действии на оксид меди (I) галогеноводородной кислотой получают галогениды меди (I) и воду:
Cu2O + 2HCl = 2CuCl↓ + H2O
При растворении Cu2O в кислородсодержащих кислотах, например, в растворе серной, образуются соли меди (II) и медь:
Cu2O + H2SO4(разб.) = CuSO4 + Cu + H2O
В концентрированной серной, азотной кислотах образуются только соли (II).
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → Сu–C ≡ C–Cu + 2NH4Cl
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
2Cu2O + O2 = 4CuO
2.
Гидроксиды.
Гидроксид меди (II).
Гидроксид меди (II) проявляет слабо выраженные амфотерные свойства (с преобладанием основных). Сu(OН)2 взаимодействует с кислотами:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
Cu(OН)2 + 2H+ = Cu2+ + 2H2O
Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH )2 + 2NaOH(конц.) = Na2[Cu(OH)4]
При нагревании гидроксид меди (II) разлагается:
Сu(OH)2  CuO + H2O
CuO + H2O
3.
Соли.
Соли меди (I).
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
2CuCl + Cl2 = 2CuCl2
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
4CuI + 5H2SO4(конц.гор.) = 4CuSO4 + I2 + H2S + 4H2O
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.хол.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
2CuCl2 + 4KI = 2CuI + I2 + 4HCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
CuSO4 + Fe = FeSO4 + Cu
CuS + 8HNO3(конц.гор..) = CuSO4 + 8NO2 + 4H2O
CuS + 2FeCl3 = CuCl2 + 2FeCl2 + S
2CuS + 3O2  2CuO + 2SO2↑
2CuO + 2SO2↑
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
2CuCl2 + 4KI = 2CuI + I2↓ + 4KCl
CuBr2 + Na2S = CuS↓ + 2NaBr
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
2Cu(NO3)2 + 2Н2О  2Cu + O2 + 4HNO3
2Cu + O2 + 4HNO3
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
2Cu(NO3)2  2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
(CuOH)2CO3  2CuO + CO2 + H2O
2CuO + CO2 + H2O
Na2[Cu(OH)4] + 4HCl = 2NaCl + CuCl2 + 4H2O
2[Cu(NH3)2]Cl + К2S = Cu2S + 2KCl + 4NH3
При смешивании растворов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
Медь и соединения меди.
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Поученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Медь. Соединения меди.
1. CuCl2  Cu + Сl2
Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2. CuCl2 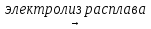 Cu + Сl2
Cu + Сl2
на катоде на аноде
Cu + S  CuS
CuS
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3. NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
2NaNO3  2NaNO2 + O2↑
2NaNO2 + O2↑
4. Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
CuO + C  Cu + CO
Cu + CO
6. Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3  2CuO + CO2 + H2O
2CuO + CO2 + H2O
CuO + H2  Cu + H2O
Cu + H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O  2Cu + O2 + 4HNO3
2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10. (CuOH)2CO3  2CuO + CO2 + H2O
2CuO + CO2 + H2O
CuO + 2HNO3  Cu(NO3)2 + H2O
Cu(NO3)2 + H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
3CuO + 2NH3  3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
11. CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2  CuO + H2O
CuO + H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|