
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 10 страница
Соли.
Соли фосфорной кислоты: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
Фосфаты.
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO3
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Ca3(PO4)2 + 8C = Ca3P2 + 8CO
3Ca3(PO4)2 + 16Al = 3Ca3P2 + 8Al2O3
Гидрофосфаты.
K2HPO4 + H3PO4 = 2KH2PO4
K2HPO4 + KOH = K3PO4 + H2O
4Na2HPO4(разб.) + 3CaCl2 = Ca3(PO4)2 + 6NaCl + 2NaH2PO4
Na2HPO4(конц.) + CaCl2 = CaHPO4 + 2NaCl
2Na2HPO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3 + NaH2PO4
Дигидрофосфаты.
3NaH2 PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3 + 2H3PO4
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Фосфор. Соединения фосфора.
1. Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
2. Ортофосфат кальция прокалили с углем и речным песком. Образовавшееся при этом белое светящееся в темноте вещество сожгли в атмосфере хлора. Продукт этой реакции растворили в избытке гидроксида калия. К полученной смеси прилили раствор гидроксида бария. Напишите уравнения описанных реакций.
3. Простое вещество, полученное при нагревании смеси фосфата кальция с коксом и оксидом кремния, растворяется в растворе едкого кали. Выделяющееся газообразное вещество сожгли, продукты горения собрали и охладили, а в полученный раствор добавили нитрат серебра. Напишите уравнения описанных реакций.
4. Смесь ортофосфата кальция, кокса и песка нагрели в электрической печи. Один из продуктов этой реакции может самовоспламеняться на воздухе. Твердый продукт горения этого вещества при нагревании растворили в воде и через полученный раствор пропустили газообразный аммиак. Напишите уравнения описанных реакций.
5. Простое вещество, смесь которого с бертолетовой солью используется в спичках и воспламеняется при трении, сожгли в избытке кислорода. Твердое вещество белого цвета, образовавшееся в результате сгорания, растворили в избытке раствора гидроксида натрия. Полученная при этом соль с раствором нитрата серебра образует осадок ярко-желтого цвета. Напишите уравнения описанных реакций.
6. Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода, при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций.
7. Фосфор сожгли в избытке хлора, образующееся твердое вещество смешали с фосфором и нагрели. Продукт реакции обработали водой, при этом выделился бесцветный газ с резким запахом. Раствор добавили к подкисленному серной кислотой раствору перманганата калия, который в результате реакции обесцветился. Напишите уравнения описанных реакций.
8. Продукт взаимодействия фосфида магния с водой сожгли и продукты реакции поглотили водой. Образовавшееся вещество используется в промышленности для получения двойного суперфосфата из фосфорита. Напишите уравнения описанных реакций.
9. Фосфин пропустили через горячий раствор концентрированной азотной кислоты. раствор нейтрализовали негашеной известью, выпавший осадок отделили, смешали с коксом и кремнезёмом и прокалили. Продукт реакции, который светится на воздухе, нагрели в растворе едкого натра. Напишите уравнения описанных реакций.
10. Красный фосфор сожгли в атмосфере хлора. Продукт реакции обработали избытком воды и в раствор добавили порошкообразный цинк. Выделившийся газ пропустили над нагретым оксидом двухвалентного железа. Напишите уравнения описанных реакций.
11. Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт реакции при нагревании растворили в большом количестве воды. После нейтрализации полученного раствора пищевой содой в него добавили нитрат серебра. Напишите уравнения описанных реакций.
12. К твёрдому веществу, которое образуется при сжигании фосфора в избытке хлора, добавили фосфор и смесь нагрели. Продукт реакции обработали небольшим количеством горячей воды и в полученный раствор добавили подкисленный серной кислотой раствор перманганата калия. Напишите уравнения описанных реакций.
13. Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
14. Фосфат кальция прокалили с углем в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
15. Фосфат кальция прокалили с песком и углем. Полученное простое вещество сожгли в кислороде, продукт реакции растворили в воде и нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
16. Фосфор сожгли в избытке кислорода, а образовавшееся вещество сплавили с оксидом натрия. полученную соль разделили на две части: первую ввели в реакцию с хлоридом кальция, а вторую – с нитратом серебра. Напишите уравнения описанных реакций.
17. Красный фосфор окислили кипящей азотной кислотой. Выделившийся при этом газ поглотили раствором гидроксида калия. Продукт окисления в первой реакции нейтрализовали гидроксидом натрия, а к образовавшейся реакционной массе по каплям добавили раствор хлорида кальция до прекращения выпадения осадка. Напишите уравнения описанных реакций.
Фосфор. Соединения фосфора. (ответы)
1) Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
PH3 + 2O2 = H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO3
2) Ca3(PO4)2 + 5C + 3SiO2
3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
2K3PO4 + 3Ba(OH)2 = Ba3(PO4)2 + 6KOH
3) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 3H2O = 2H3PO4 или
PH3 + 2O2 = H3PO4
H3PO4 + 3AgNO3 = Ag3PO4↓ + 3HNO3
4) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
4P + 5O2 = 2P2O5 или P4 + 5O2 = P4O10
P2O5 + 3H2O = 2H3PO4
2H3PO4 + 3NH3 = NH4H2PO4 + (NH4)2HPO4
5) 6P + 5KClO3 = 5KCl + 3P2O5
4P + 5O2 = 2P2O5
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
6) P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2Na2HPO4  Na4P2O7 + H2O
Na4P2O7 + H2O
7) 2P + 5Cl2 = 2PCl5
3PCl5 + 2P = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
или, так как ортофосфат марганца нерастворим
15H3PO3 + 6KMnO4 + 3H2SO4 = 11H3PO4 + 3K2SO4 + 2Mn3(PO4)2↓ + 9H2O
8) Mg3P2 + 6H2O = 3Mg(OH)2↓ + 2PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 3H2O = 2H3PO4
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
9) PH3 + 8HNO3(конц. гор.) = H3PO4 + 8NO2 + 4H2O
2H3PO4 + 3CaO = Ca3(PO4)2↓ + 3H2O
2HNO3 + CaO = Ca(NO3)2 + H2O
Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
10) 2P + 5Cl2 = 2PCl5
PCl5 + 4H2O = H3PO4 + 5HCl↑
3Zn + 2H3PO4 = Zn3(PO4)2↓ + 3H2
H2 + FeO = Fe + H2O
11) 4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3NaHCO3 = Na3PO4 + 3CO2 + 3H2O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
12) 2P + 5Cl2 = 2PCl5
3PCl5 + 2P = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
13) 2P + 3Cl2 = 2PCl3
PCl3 + 3H2O = H3PO3 + 3HCl
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
10HCl + 2KMnO4 + 3H2SO4 = 5Cl2 + K2SO4 + 2MnSO4 + 8H2O
или
16HCl + 2KMnO4 = 5Cl2 + 2KCl + MnCl2 + 8H2O
14) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO3 + 5KCl + 4H2O
2K3PO3 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6KOH
15) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
16) 4P + 5O2 = 2P2O5
P2O5 + 3Na2O = 2Na3PO4
2Na3PO3 + 3CaCl2 = Ca3(PO4)2↓ + 6NaCl
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Сера. Соединения серы.
Сера.
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
Взаимодействие с неметаллами:
S + H2 = H2S
3S + 2P = P2S3
2S + C = CS2
S + O2 = SO2
S + Cl2 = SCl2 (S2Cl2)
S + 3F2 = SF6
Взаимодействие с металлами приводит к образованию соответствующих сульфидов:
S + Fe = FeS
S + Hg = HgS
3S + 2Al = Al2S3
При взаимодействии со сложными веществами (окислителями) сера проявляет свойства восстановителя:
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
S + 2H2SO4 = 3SO2 + 2H2O
S + 2KClO3 = 3SO2 + 2KCl
При кипячении в щелочах сера растворяется с образованием сульфитов и сульфидов:
S + NaOH = Na2SO3 + Na2S + H2O
S + H2O (пар) = 2H2S + SO2
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 = Na2S2O3
Соединения серы.
Сероводород.
В реакциях сероводород проявляет свойства сильного восстановителя (степень окисления серы −2)
При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 = 2S↓ + 2H2O
В избытке кислорода:
2H2S + 3O2 = 2SO2↑ + 2H2O
При взаимодействии с бромом, хлором сероводород окисляется до свободной серы:
H2S + Br2 = 2HBr + S↓
H2S + Cl2 = 2HCl + S↓
H2S + 4Cl2 + 4H2O = + H2SO4 + 8HCl
В целом большинство окислителей окисляют H2S с образованием серы:
2H2S + SO2 = 3S + 2H2O
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
2H2S + 4Ag + O2 = 2Ag2S + 2H2O
H2S + 2HNO3(конц.) = S + 2NO2 + 2H2O
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
H2S + H2SO4(конц.) = S + SO2 + 2H2O (кип.)
H2S + 8HNO3(конц.) = H2SO4 + 8NO2 + 4H2O (кип.)
H2S + 3H2SO4(конц.) = 4SO2 + 4H2O
Оксиды.
Оксид серы (IV). Сернистый газ.
Получить SO2 можно сжиганием серы, сероводорода, обжигом сульфидов, действием на сульфиты более сильной кислотой:
S + O2 = SO2
2H2S + 3O2 = 2SO2 + 2H2O
2CuS + 3O2 = 2SO2 + 2CuO
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
Оксид серы (IV) (сернистый газ). Степень окисления серы в SO2 +4 может повышаться, понижаться или оставаться неизменной.
Без изменения степени окисления проходят те реакции SO2, в которых он проявляет общие свойства кислотного оксида:
▪ взаимодействие с водой:
SO2 + H2O ↔ H2SO3
▪ взаимодействие с основными оксидами:
SO2 + Na2O = Na2SO3
▪ взаимодействие со щелочами.
SO2 + 2NaOH(избыток) = Na2SO3 + H2O
SO2 + NaOH(избыток) = NaHSO3
SO2 + Na2CO3 = Na2SO3 + CO2
Наиболее ярко выражены восстановительные свойства SO2; степень окисления серы в таких реакциях повышается:
2SO2 + O2 = 2SO3
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
SO2 + 2HNO3 = H2SO4 + 2NO2
SO2 + O3 = SO3 + O2
5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + 2MnSO4 + K2SO4 качественная реакция на SO2 и на сульфит ион SO32− (обесцвечивание раствора)
SO2 + PbO2 = PbSO4
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства:
SO2 + 2Н2S = 3S + 2H2O
SO2 + 2CO 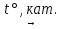 2СО2 + S
2СО2 + S
Оксид серы (VI). Серный ангидрид.
При обычных условиях – бесцветная ядовитая жидкость.
Оксид серы (VI) получают окислением оксида серы (IV) кислородом воздуха при нагревании в присутствии катализатора, термическим разложением сульфатов, взаимодействием SO2 с озоном, с NO2:
2SO2 + O2 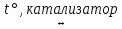 2SO3
2SO3
Fe2(SO4)3 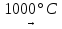 Fe2O3 + 3SO3 (в смеси с SO2 и O2)
Fe2O3 + 3SO3 (в смеси с SO2 и O2)
SO2 + O3 = SO3 + O2
SO2 + NO2 = SO3 + NO
Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 + 2KI = I2 + K2SO3
3SO3 + H2S = 4SO2 + H2O
5SO3 + 2P = P2O5 + 5SO2
Оксид серы (VI) является типичным кислотным оксидом:
SO3 + H2O = H2SO4
SO3 + MgO = MgSO4
SO3 + 2NaOH(избыток) = Na2SO4 + H2O
SO3 + NaOH(избыток) = NaHSO4
Кислоты.
H2SO4 серная кислота.
Разбавленная серная кислота обладает всеми свойствами сильных нелетучих кислот (взаимодействует с основными и амфотерными оксидами, с основаниями, амфотерными гидроксидами с образованием соответствующих солей, с металлами стоящими в ряду напряжений до водорода (кроме Pb) вытесняет летучие и более слабые кислоты из их солей.
H2SO4 + CuO = CuSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
H2SO4 + 2NaOH(избыток) = Na2SO4 + 2H2O
H2SO4(избыток) + NaOH = NaHSO4 + H2O
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
H2SO4(разб.) + Fe = FeSO4 + H2↑
H2SO4 + Na2CO3 = Na2SO4 + CO2↑ + H2O
H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3↓
Качественной реакцией на сульфат-ион является взаимодействие с растворимыми соединениями бария. Белый осадок BaSO4нерастворим в воде и кислотах.
SO42− + Ba2+ = BaSO4↓
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до SO2. С активными металлами может восстанавливаться до S, Н2 S.
Fe, Al, Cr пассивируются концентрированной серной кислотой на холоду. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2 Al  Al2(SO4)3 + 3SO2 + 6H2O
Al2(SO4)3 + 3SO2 + 6H2O
2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg = HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag = Ag2SO4 + SO2↑+ 2H2O
5H2SO4(конц.) + 4Zn = 4ZnSO4 + H2S↑ + 4H2O
5H2SO4(конц.) + 4Mg = 4MgSO4 + H2S↑ + 4H2O
Окислителем концентрированная серная кислота выступает и по отношению к неметаллам:
5H2SO4(конц.) + 2P = 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С = СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S = 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr = Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI = 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S = 4S↓ + 4H2O
Концентрированная серная кислота способна вытеснять летучие кислоты из их солей:
H2SO4(конц.) + NaCl(тв.) = NaHSO4 + HCl↑
H2SO4(конц.) + NaNO3(тв.) = NaHSO4 + HNO3
H2SO4(конц.) + NaClO4 = NaHSO4 + HClO4↑
Соли.
Сульфиды.
Сульфиды, как и оксиды в зависимости от характера и степени окисления второго элемента могут быть основными (Na2S, K2S), амфотерными (Al2S3, Cr2S3), кислотными (SiS2, P2S3) что наглядно проявляется при гидролизе этих соединений.
Na2S + H2O ↔ NaHS + NaOH
S2− + H2O ↔ HS− + OH−
Al2S3 + 12H2O = 2Al(OH)3 + 3H2S
SiS2 + 2H2O = SiO2 + 2H2S
При взаимодействии с окислителями сульфиды проявляют свойства восстановителей:
CuS + 4H2SO4(конц. гор.) = CuSO4 + 4SO2 + 4H2O
CuS + 8HNO3(конц. гор.) = CuSO4 + 8NO2 + 4H2O
СuS + Cl2 = CuCl2 + S
2CuS + 3O2 = 2CuO + 2SO2
Cr2S3 + 6H2SO4(конц.) = Cr2(SO4)3 + 3S + 3SO2 + 6H2O
Cr2S3 + 30HNO3(конц. гор.) = 2Cr(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
Cr2S3 + 12NaOH (конц.) = 2Na3[Cr(OH)6] + 3Na2S + 6H2O
2Cr2S3 + 9O2 = 2Cr2O3 + 6SO2
HgS + 10HNO3(конц.) = Hg(NO3)2 + H2SO4 + 8NO2 + 4H2O
ZnS + 4H2SO4(конц. гор.) = ZnSO4 + 4SO2 + 4H2O
ZnS + 8HNO3(конц.) = ZnSO4 + 8NO2 + 4H2O
2ZnS + 3O2 = 2SO2 + ZnO
Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−:
Na2S + Pb(NO3)2 = PbS↓ + 2NaNO3
черный
Na2S + 2AgNO3 = Ag2S↓ + 2NaNO3
черный
Na2S + Cu(NO3)2 = CuS↓ + 2NaNO3
черный
Сульфиты.
Na2SO3 + 2H2SO4конц.) = 2NaHSO4 + SO2 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
Na2SO3 + S = Na2S2O3
3Na2SO3 + 4H2SO4 + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O
Na2SO3 + S = Na2S2O3
Сульфаты.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова соль
CaSO4 ∙ 2H2O − гипс
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O − кристаллическая сода
Сульфаты щелочных металлов не разлагаются даже при нагревании до 1000°С.
Сульфаты таких металлов, как Cu, Al, Zn, Cr, Fe (II) подвергаются термическому разложению на оксид металла и SO2 и O2; в FeSO4 Fe (II) окисляется до Fe (III), а сульфаты самых тяжелых металлов разлагаются до металла:
2CuSO4
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|