
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 12 страница
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв. Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия. Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
13) Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия. Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
Галогены.
1) 2NaI 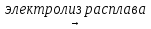 2Na + I2
2Na + I2
на катоде на аноде
I2 + H2S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
I2 + 6NaOH (гор.) = NaIO3 + 5NaI + 3H2O
2) 2NaI + 2H2O  2H2 + 2NaOH + I2
2H2 + 2NaOH + I2
на катоде на аноде
I2 + 2K = 2KI
8KI + 8H2SO4(конц.) = 4I2↓ + H2S↑ + 4K2SO4 + 4H2O или
8KI + 9H2SO4 (конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3 + 3S + 4KOH
3) Cl2 + H2O ↔ HCl + HClO
HCl + NaOH = NaCl + H2O
HClO + NaOH = NaClO + H2O
NaClO + 2HCl = NaCl + Cl2 + H2O
4) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
9H2SO4(конц.) + 8NaI(тверд.) = 8NaHSO4 + 4I2↓ + H2S + 4H2O
NH4OH + HCl = NH4Cl + H2O
NH4OH + H2S = NH4HS + H2O
5) 2KClO3 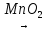 2KCl + 3O2↑
2KCl + 3O2↑
4KClO3  KCl + 3KClO4
KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
6) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 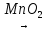 2KCl + 3O2↑
2KCl + 3O2↑
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
7) 3I2 + 3P = 2PI3
PI3 + 3H2O = H3PO3 + 3HI
HI + NaOH = NaI + H2O
NaI + AgNO3 = AgI↓ + NaNO3
8) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
NaClO + 2HI = NaCl + I2 + H2O
9) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2NaBr + Cl2 = 2NaCl + Br2
2NaCl + 2H2O
2H2 + 2NaOH + Cl2
на катоде на аноде
H2 + Cl2 = 2HCl
10) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
2KClO3 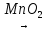 2KCl + 3O2↑
2KCl + 3O2↑
C + O2 = CO2
11) 2NaI + 2H2O  2H2 + 2NaOH + I2
2H2 + 2NaOH + I2
на катоде на аноде
I2 + H2 = 2HI
8HI + H2SO4 (конц.) = 4I2↓ + H2S↑ + 4H2O или
2HI + H2SO4 (конц.) = I2↓ + SO2↑ + 2H2O
а) H2S + 2KOH = K2S + 2H2O
H2S + K2S = 2KHS или
б) SO2 + 2KOH = K2SO3 + 2H2O
K2SO3 + SO2 + H2O = 2KHSO3
12) 4HCl + PbO2 = PbCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
2KClO3 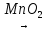 2KCl + 3O2↑
2KCl + 3O2↑
13) I2 + 10HNO3  2HIO3 + 10NO2 + 4H2O
2HIO3 + 10NO2 + 4H2O
2HIO3  I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO  I2 + 5CO2
I2 + 5CO2
3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
14) 2KI + Cl2 = 2KCl + I2
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
2HIO3  I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO = I2 + 5CO2
15) I2 + 2HClO3 = 2HIO3 + Cl2
2HIO3  I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO  I2 + 5CO2
I2 + 5CO2
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
16) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
17) 2NaCl 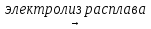 2Na + CL2
2Na + CL2
на катоде на аноде
Cl2 + H2 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
18) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 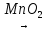 2KCl + 3O2↑
2KCl + 3O2↑
Литература.
Химические свойства неорганических веществ. Учеб. Пособие для вузов. /Лидин Р.А. – М. Химия
Химия. Пособие для поступающих в вузы / О.О. Максименко. – М.: филол. о-во СЛОВО: изд-во Эксмо
Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная Книготорговая Компания.
Переходные элементы и их соединения. Пособие для старшеклассников и абитуриентов. И.И. Новошинский, Н.С. Новошинская
Химия. Материалы для подготовки к единому государственному экзамену и вступительным экзаменам в вузы / О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|