
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 8 страница
Соли (карбонаты, гидрокарбонаты).
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO3  CaO + CO2
CaO + CO2
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH4)2CO3  2NH3 + 2H2O + CO2
2NH3 + 2H2O + CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3  Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Качественной реакцией на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2
Na2CO3 + 2HCl = 2NaCl + CO2 ↑ + H2O
NaHCO3 + HCl = NaCl + CO2 ↑ + H2O
При смешивании растворов будет происходить гидролиз и по аниону слабой кислоты и по катиону слабого основания:
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
Кремний. Соединения кремния.
Кремний.
При низких температурах кремний химически инертен, при высоких температурах реагирует как с неметаллами, так и с некоторыми металлами. В большинстве случаев кремний является восстановителем, в реакциях с более сильными восстановителями (активными металлами) выступает в роли окислителя.
При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 = SiO2
При взаимодействии с галогенами (с фтором при комнатной температуре), при нагревании с хлором, бромом, иодом образуются галогениды кремния:
Si + 2Cl2 = SiCl4
Si + 2Br2 = SiBr4
При температуре выше 600°С взаимодействует с серой:
Si + 2S = SiS2
При температуре около 2000°С кремний соединяется с углеродом с образованием карбида кремния (карборунда):
Si + С = SiС
При взаимодействии с активными металлами образуются силициды металлов:
Si + 2Mg = Mg2Si
Si + 2Са = Са2Si
Si + 2MgO = Mg2Si + 2SiO
Силициды щелочных, щелочноземельных металлов и магния разлагаются водой, щелочами и разбавленными кислотами с образованием силана:
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4↑
2Ca2Si + 4NaOH + 10H2O = 2Na2SiO3 + 4Ca(OH)2 + SiH4↑
Mg2Si + 4HCl = 2MgCl2 + SiH4↑
В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты :
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте:
Si + 6HF = H2[SiF6] + 2H2
(Si(тв.) + 4HF(г.) = SiF4 + 2H2)
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF = 3SiF4 + 4NO + 8H2O
Соединения кремния.
Оксиды.
Оксид кремния (IV). Как кислотный оксид, SiO2 при сплавлении взаимодействует с твердыми щелочами, основными оксидами и карбонатами с образованием солей кремниевой кислоты (силикатов):
SiO2 + 2KOH  K2SiO3 + H2O (растворы щелочей также действуют на SiO2)
K2SiO3 + H2O (растворы щелочей также действуют на SiO2)
SiO2 + CaO  CaCO3
CaCO3
SiO2 + K2CO3  K2SiO3 + CO2
K2SiO3 + CO2
Взаимодействует с плавиковой кислотой:
SiO2 + 6HF = H2[SiF6] + 2H2O
При нагревании смеси SiO2 с углеродом образуется карбид кремния:
SiO2 + 3С  SiС + 2СО
SiС + 2СО
SiO2 + 2Mg  2MgO + Si
2MgO + Si
3SiO2 + Ca3(PO4)2 + 5C  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
Водородное соединение. Силан.
Силан – ядовитый бесцветный газ. На воздухе силан горит с образованием SiO2 и H2O, водой и щелочами разлагаются с выделением водорода:
SiH4 + 2O2 = SiO2 + 2H2O
SiH4 + 2H2O = SiO2 + 4H2
SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2
Тетрахлорид кремния.
SiCl4 + 3H2O = H2SiO3↓ + 4HCl
SiCl4 + 2H2 = Si + 4HCl
Углерод, кремний. Соединения углерода и кремния.
1. Газы, которые выделяются при нагревании угля в концентрированной азотной и серной кислотах, смешали друг с другом. Продукты реакции пропустили через известковое молоко. Напишите уравнения описанных реакций.
2. Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при нагревании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение. Напишите уравнения описанных реакций.
3. Газ, образовавшийся при сгорании кокса, длительное время соприкасался с раскаленным углем. Продукт реакции последовательно пропустили через слой железной руды и негашеную известь. Напишите уравнения описанных реакций осадка.
4. Одно из веществ, образующихся при сплавлении оксида кремния с магнием, растворяется в щелочи. Выделяющийся газ ввели в реакцию с серой, а продукт их взаимодействия обработали хлором. Напишите уравнения описанных реакций.
5. Силицид магния обработали раствором хлороводородной кислоты и выделяющийся газ сожгли. Твердый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали некоторое время. После охлаждения продукт реакции (используется под названием «жидкое стекло») растворили в воде и обработали раствором серной кислотой. Напишите уравнения описанных реакций.
6. Хлорид кремния (IV) нагрели в смеси с водородом. Продукт реакции смешали с магниевым порошком, нагрели и обработали водой, одно из образующихся веществ самовоспламеняется на воздухе. Напишите уравнения описанных реакций.
7. Силицид магния обработали раствором соляной кислоты, продукт реакции сожгли, образовавшееся твердое вещество смешали с кальцинированной содой и нагрели до плавления. После охлаждения расплава его обработали водой и к полученному раствору добавили азотную кислоту. Напишите уравнения описанных реакций.
8. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой, и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
9. Кремний сожгли в атмосфере хлора. Полученный хлорид обработали водой. выделившийся при этом осадок прокалили. Затем сплавили с фосфатом кальция и углем. Напишите уравнения описанных реакций.
10. Вещество, образующееся при сплавлении магния с кремнием обработали водой, в результате образовался и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
11. Продукт взаимодействия кремния с хлором легко гидролизуется. При сплавлении твердого продукта гидролиза как с каустической, так и кальцинированной содой образуется жидкое стекло. Напишите уравнения описанных реакций.
12. Углерод сожгли в избытке кислорода, образовавшийся газ пропустили над оксидом меди (II). Полученное вещество сплавили с серой, а продукт этой реакции сожгли в кислороде. Напишите уравнения описанных реакций.
13. Кремний сожгли в кислороде. Продукт реакции сплавили с карбонатом натрия, образовавшееся вещество обработали избытком соляной кислоты при нагревании. Осадок отфильтровали, а к фильтрату добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
14. Кремний растворили в концентрированном растворе гидроксида натрия. Через полученный раствор пропустили углекислый газ. Выпавший осадок отфильтровали, высушили и разделили на две части. Первую растворили в плавиковой кислоте, вторую сплавили с магнием. Напишите уравнения описанных реакций.
Углерод, кремний. Соединения углерода и кремния.
1. C + 2H2SO4(конц.) = CO2↑ + 2SO2↑ + 2H2O
C + 4HNO3(конц.) = CO2↑ + 4NO2↑ + 2H2O
SO2 + NO2 = SO3 + NO
SO3 + Ca(OH)2 = CaSO4↓ + H2O
CO2 + Ca(OH)2 = CaCO3↓ + H2O
2. CaO + H2O = Ca(OH)2
2NaHCO3→Na2CO3 + CO2 ↑ + H2O
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
3. С + O2 = CO2
CO2 + C = 2CO
Fe2O3 + 3CO = 2Fe + 3CO2 или
Fe3O4 + 4CO = 3Fe + 4CO2
СаО + СО2 = СаСО3
4. 2С + O2 = 2CO
CO + CuO = Cu + CO2
Cu + S = CuS
2CuS + 3O2 = 2CuO + 2SO2
5. SiO2 + 2Mg = 2MgO + Si
Si + 2NaOH + 2H2O = Na2SiO3 + 2H2↑
H2 + S = H2S
H2S + Cl2 = 2HCl + S↓
6. Mg2Si + 4HCl = 2MgCl2 + 2SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
7. SiCl4 + 2H2 = Si + 4HCl
Si + 2Mg = Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2O2 = SiO2↓ + 2H2O
8. Mg2Si + 4HCl = 2MgCl2 + 2SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3↓
9. Si + 2Mg = Mg2Si
Mg2Si + 4H2O (холл.) = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2H2O (гор.) = SiO2 + 4H2
SiO2 + 2NaOH = Na2SiO3 + H2O
10. Si + 2Cl2 = SiCl4
SiCl4 + 3H2O = H2SiO3↓ + 4HCl
H2SiO3  SiO2 + H2O
SiO2 + H2O
3SiO2 + Ca3(PO4)2 + 5C  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
11. Si + 2Mg = Mg2Si
Mg2Si + 4H2O (холл.) = 2Mg(OH)2↓ + SiH4↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
3SiH4 + 8KMnO4 = 8MnO2↓ + 3SiO2↓ + 8KOH + 2H2O
12. Si + 2Cl2 = SiCl4
SiCl4 + 2H2O = SiO2↓ + 4HCl
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
13. Si + O2 = SiO2
SiO2 + Na2CO3 = Na2SiO3 + CO2
Na2SiO3 + 2HCl = 2NaCl + SiO2↓ + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
14. Si + 2NaOH + 2H2O = Na2SiO3 + 2H2↑
Na2SiO3 + CO2 = Na2CO3 + SiO2↓
SiO2 + 4HF = SiF4 + 2H2O
SiO2 + 2Mg = Si + 2MgO
V A группа (азот, фосфор)
Азот. Соединения азота.
I.Азот.
В лаборатории получают разложением нитрита аммония:
NH4NO2  N2 + 2H2O
N2 + 2H2O
NaNO2 + NH4Cl  N2 + NaCl + 2H2O
N2 + NaCl + 2H2O
В обычных условиях азот не реагирует ни с металлами (за исключением лития – с ним N2 взаимодействует при комнатной температуре), ни с неметаллами. При нагревании химическая активность азота повышается.
При взаимодействии с металлами образуются нитриды металлов:
N2 + 6 Li = 2Li3N
N2 + 6 Na  2Na3N
2Na3N
N2 + 3Mg  Mg3N2
Mg3N2
N2 + 2Al (порошок)  2AlN
2AlN
Нитриды щелочных и щелочноземельных металлов легко разлагаются водой и растворами кислот:
Li3N + 3H2O = 3LiOH + NH3
Ca3N2 + 6HCl = 3CaCl2 + 2NH3
C неметаллами азот взаимодействует только в специальных условиях – при высокой температуре, давлении, в присутствии катализатора или при пропускании сильного электрического разряда:
N2 + 3H2 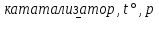 2NH3
2NH3
N2 + O2 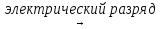 2NO
2NO
N2 + 3LiH  Li3N + NH3
Li3N + NH3
II. Соединения азота.
1.
Аммиак.
Наиболее энергично аммиак реагирует с хлором и бромом, оксидами некоторых металлов, а также (при поджигании смеси или в присутствии катализатора) с кислородом:
2NH3 + 3Cl2 = N2 + 6HCl
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 5O2 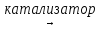 4NO + 6H2O
4NO + 6H2O
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 = N2 + 6H2O
За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием:
2NH3 + 2Na = 2NaNH2 + H2 (Na2NH, Na3N)
2NH3 + 2Al = 2AlN + 3H2
Растворение аммиака в воде сопровождается химическим взаимодействием с ней:
NH3 + H2O ↔ NH3 ∙ H2O ↔ NH4+ + OH−
При взаимодействии с кислотами образуются соли аммония:
NH3 + HCl = NH4Cl
NH3 + H2SO4 = NH4HSO4
2NH3 + H2SO4 = (NH4)2SO4
При взаимодействии аммиака с углекислым газом образуется карбамид (мочевина):
2NH3 + CO2 = (NH2)2CO + H2O
Аммиак вступает в реакции комплексообразования:
6NH3 + CuCl2 = [Cu(NH3)6]Cl2
4NH3 + Cu(OH)2 = [Cu(NH3)4](OH)2
2.
Соли аммония.
Все соли аммония проявляют общие свойства солей (взаимодействуют с растворами кислот, щелочей и других солей), а также подвергаются гидролизу и разлагаются при нагревании:
NH4Cl + KOH = KCl + NH3 + H2O (качественная реакция на NH4+ )
(NH4)2SO4 + Ba(NO3)2 = 2NH4NO3 + BaSO4↓
NH4+ + HOH ↔ NH3 ∙ H2O + H+
NH4HS + 3HNO3 = S + 2NO2 + NH4NO3 + 2H2O
Если соль не содержит аниона-окислителя, то разложение проходит без изменения степени окисления атома азота:
NH4Cl  NH3 + HCl
NH3 + HCl
NH4HCO3  NH3 + CO2 + H2O
NH3 + CO2 + H2O
(NH4)2SO4  NH4HSO4 + NH3
NH4HSO4 + NH3
NH4HS  NH3 + H2S
NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония:
NH4NO2  N2 + 2H2O
N2 + 2H2O
NH4NO3 = N2O + 2H2O (190 – 245° C)
2NH4NO3 = 2NO + 4H2O (250 – 300° C)
2NH4NO3 = 2N2 + O2 + 4H2O (выше 300° С)
(NH4)2Cr2O7  Cr2O3 + N2 + 4H2O
Cr2O3 + N2 + 4H2O
3.
Оксиды азота.
| оксид | степень окисления | цвет (н.у.) | характер оксида |
| N2O | +1 | бесцветный | несолеобразующий |
| NO | +2 | бесцветный | несолеобразующий |
| N2O3 | +3 | синий | кислотный |
| NO2 | +4 | бурый | кислотный |
| N2O5 | +5 | бесцветный | кислотный |
N2O
В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
N2O + H2 = N2 + H2O
N2O + Mg = N2 + MgO
N2O + 2Cu = N2 + Cu2O
3N2O + 2NH3 = 4N2 + 3H2O
N2O + H2O + SO2 = N2 + H2SO4
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
5N2O + 3H2SO4 + 2KMnO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O
NO NO ядовит!
В лаборатории получают взаимодействием 30%-ной азотной кислоты с некоторыми металлами:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить по реакциям:
FeCl2 + NaNO3 + 2HCl = FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI = 2NO + I2 + 2H2O
На воздухе NO практически мгновенно окисляется до NO2
2NO + O2 = 2NO2
По отношению к галогенам, озону также проявляет свойства восстановителя:
2NO + Cl2 = 2NOCl
NO + O3 = NO2 + O2
В присутствии более сильных восстановителей проявляет свойства окислителя:
2NO + 2H2 = N2 + 2H2O
2NO + 2SO2 = 2SO3 + N2
N2O3
Кислотный оксид. Ангидрид азотистой кислоты. При взаимодействии с водой дает азотистую кислоту:
N2O3 + H2O ↔ 2HNO2
При взаимодействии с растворами щелочей образуются нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O
NO2
Очень ядовит! Для NO2 характерна высокая химическая активность: он взаимодействует с неметаллами (фосфор, уголь, сера горят в оксиде азота (IV), оксид серы (IV) окисляется до оксида серы VI)). В этих реакциях NO2 – окислитель:
2NO2 + 2S = N2 + 2SO2
2NO2 + 2C = N2 + 2CO2
10NO2 + 8P = 5N2 + 4P2O5
NO2 + SO2 = SO3 + NO
Растворение NO2 в воде приводит к образованию азотной и азотистой кислот:
2NO2 + H2O = HNO3 + HNO2
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O = 2HNO3 + NO
При нагревании:
4NO2 + 2H2O = 4HNO3 + O2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 = 4HNO3
При растворении в щелочах – нитраты и нитриты:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода – нитраты:
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
N2O5
Кислотный оксид. Ангидрид азотной кислоты.
Растворяется в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
в щелочах – с образованием нитратов:
N2O5 + 2NaOH = 2NaNO3 + H2O
4) Кислоты.
HNO2 Азотистая кислота.
HNO2 существует только в разбавленных растворах, при нагревании которых она разлагается:
3HNO2 ↔ HNO3 + 2NO + H2O
Поскольку степень окисления азота в HNO2 равна +3, то азотистая кислота проявляет как окислительные свойства, так и восстановительные:
2HNO2 + 2HI = 2NO + I2 + 2H2O
5HNO3 + 2HMnO4 = 2Mn(NO3)2 + HNO3 + 3H2O
HNO2 + Cl2 + H2O = HNO3 + 2HCl
2HNO2 + O2 = 2HNO3
HNO2 + H2O2 = HNO3 + H2O
2HNO2 + 3H2SO4 + 6FeSO4 = 3Fe2(SO4)3 + N2 + 4H2O
HNO3 Азотная кислота.
При кипении (tкип. = 85°C) и при длительном стоянии она частично разлагается:
4HNO3  4NO2 + O2 + 2H2O
4NO2 + O2 + 2H2O
Азотная кислота проявляет очень высокую химическую активность. Степень окисления азота в HNO3 равна +5, поэтому азотная кислота является окислителем, причем очень сильным. В зависимости от условий (природы восстановителя, концентрации HNO3 и температуры) степень окисления атома азота в продуктах реакции может меняться от +4 до −3: NO2, NO, N2O, N2, NН4+
NO3− + 2H+ + 1e → NO2 + H2O
NO3− + 4H+ + 3e → NO + 2H2O
2NO3− + 10H+ + 8e → N2O + 5H2O
2NO3− + 12H+ + 10e → N2 + 6H2O
NO3− + 10H+ + 8e → NH4+ + 3H2O
Чем выше концентрация азотной кислоты, тем меньше электронов склонен принять анион NO3− .
Взаимодействие с металлами.
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет:
Fe + 6HNO3(конц.)  Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.)  Al(NO3)3 + 3NO2 + 3H2O
Al(NO3)3 + 3NO2 + 3H2O
Золото и платина растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему)
HNO3 + 3HCl + Au = AuCl3 + NO + 2H2O
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2 + 2H2O
8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
4HNO3 (60%) + Zn = Zn(NO3)2 + 2NO2 + 2H2O
8HNO3 (30%) + 3Zn = 3Zn(NO3)2 + 2NO + 4H2O
10HNO3 (20%) + 4Zn = 4Zn(NO3)2 + 2N2O + 5H2O
10HNO3 (3%) + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O
Взаимодействие с неметаллами.
При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот:
6HNO3 + S = H2SO4 + 6NO2 + 2H2O
5HNO3 + P = H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO
4HNO3 + C = CO2 + 4NO2 + 2H2O
10HNO3 + I2 = 2HIO3 + 10NO2 + 4H2O
Свойства окислителя НNO3 может проявлять и в реакциях со сложными веществами:
6HNO3 + HI = HIO3 + 6NO2 + 3H2O
2HNO3 + SO2 = H2SO4 + 2NO2
2HNO3 + H2S = S + 2NO2 + 2H2O
8HNO3 + CuS = CuSO4 + 8NO2 + 4H2O
4HNO3 + FeS = Fe(NO3)3 + NO + S + 2H2O
5) Соли
Соли азотистой кислоты – нитриты.
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные:
2KNO2 + O2 = 2KNO3
KNO2 + H2O2 = KNO3 + H2O
KNO2 + H2O + Br2 = KNO3 + 2HBr
5KNO2 + 3H2SO4 + 2KMnO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
2KNO2 + 2H2SO4 + 2KI = 2NO + I2 + 2K2SO4 + 2H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|