
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 6 страница
CuO + H2  Cu + H2O
Cu + H2O
12. Cu + Cl2  CuCl2
CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2  CuO + H2O
CuO + H2O
CuO + C  Cu + CO
Cu + CO
13. Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
4NO2 + O2 + 2H2O = 4HNO3
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
CuO + H2  Cu + H2O
Cu + H2O
14. 2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15. СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2  CuO + H2O
CuO + H2O
CuO + C  Cu + CO
Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16) 2Cu + I2 = 2CuI
2CuI + 4H2SO4  2CuSO4 + I2 + 2SO2 + 4H2O
2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2  CuO + H2O
CuO + H2O
17) 2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3  2CuO + CO2 + H2O
2CuO + CO2 + H2O
CuO + H2  Cu + H2O
Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
18) 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20) Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O  2Cu + O2 + 4HNO3
2Cu + O2 + 4HNO3
21) I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 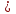 Cu(NO3)2 + 2H2O
Cu(NO3)2 + 2H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
22) Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2  CuO + H2O
CuO + H2O
3CuO + 2NH3  3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
23) CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O  2Cu + O2 + 2H2SO4
2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24) CuO + CO  Cu + CO2
Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
25) 2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O  2Cu + O2 + 2H2SO4
2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
26) H2C2O4 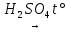 CO↑ + CO2↑ + H2O
CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
CuO + CO  Cu + CO2
Cu + CO2
27) Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl 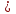 CuCl2 + 2H2O
CuCl2 + 2H2O
Марганец. Соединения марганца.
i.
Mарганец.
На воздухе марганец покрывается оксидной пленкой, предохраняющей его даже при нагревании от дальнейшего окисления, но в мелкораздробленном состоянии (порошок) он окисляется довольно легко. Марганец взаимодействует с серой, галогенами, азотом, фосфором, углеродом, кремнием, бором, образуя соединения со степенью +2:
Mn + S = MnS
3Mn + 2P = Mn3P2
3Mn + N2 = Mn3N2
Mn + Cl2 = MnCl2
2Mn + Si = Mn2Si
При взаимодействии с кислородом марганец образует оксид марганца (IV):
Mn + O2 = MnO2
4Mn + 3O2 = 2Mn2O3
2Mn + O2 = 2MnO
При нагревании марганец взаимодействует с водой:
Mn + 2H2O (пар)  Mn(OH)2 + H2
Mn(OH)2 + H2
В электрохимическом ряду напряжений марганец находится до водорода, поэтому легко растворяется в кислотах, образуя соли марганца (II):
Mn + H2SO4 = MnSO4 + H2
Mn + 2HCl = MnCl2 + H2
С концентрированной серной кислотой марганец реагирует при нагревании:
Mn + 2H2SO4(конц.)  MnSO4 + SO2 + 2H2O
MnSO4 + SO2 + 2H2O
С азотной кислотой при обычных условиях:
Mn + 4HNO3 (конц.) = Mn(NO3)2 + 2NO2 + 2H2O
3Mn + 8HNO3 (разб..) = 3Mn(NO3)2 + 2NO + 4H2O
Растворы щелочей на марганец практически не действуют, но он реагирует с щелочными расплавами окислителей, образуя манганаты (VI)
Mn + KClO3 + 2KOH  K2MnO4 + KCl + H2O
K2MnO4 + KCl + H2O
Марганец может восстанавливать оксиды многих металлов.
3Mn + Fe2O3 = 3MnO + 2Fe
5Mn + Nb2O5 = 5MnO + 2Nb
ii.
Соединения марганца (II, IV, VII)
1.
Оксиды.
Марганец образует ряд оксидов, кислотно-основные свойства которых зависят от степени окисления марганца.
Mn 2O Mn+4O2 Mn2+7O7
основный амфотерный кислотный
Оксид марганца (II)
Оксид марганца (II) получают восстановлением других оксидов марганца водородом или оксидом углерода (II):
MnO2 + Н2  MnO + H2O
MnO + H2O
MnO2 + CO  MnO + CO2
MnO + CO2
Основные свойства оксида марганца (II) проявляются в их взаимодействии с кислотами и кислотными оксидами:
MnO + 2HCl = MnCl2 + H2O
MnO + SiO2 = MnSiO3
MnO + N2O5 = Mn(NO3)2
MnO + Н2 = Mn + H2O
3MnO + 2Al = 2Mn + Al2O3
2MnO + O2 = 2MnO2
3MnO + 2KClO3 + 6KOH = 3K2MnO4 + 2KCl + 3H2O
Оксид марганца (IV)
В лаборатории оксид марганца (IV) можно получить термическим разложением соей, окислением низших или восстановлением высших соединений марганца:
Mn(NO3)2  MnO2 + 2NO2
MnO2 + 2NO2
Mn(NO3)2 + PbO2  MnO2 + Pb(NO3)2
MnO2 + Pb(NO3)2
2KMnO4 + 8MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
Оксид марганца (IV) проявляет амфотерные свойства.
При растворении MnO2 в соляной кислоте образуется хлорид марганца (II) и выделяется хлор:
4HCl + MnO2 = MnCl2 + 2H2O + Cl2↑
При нагревании в концентрированной серной кислоте MnO2 образует сульфат марганца (II) с выделением кислорода:
2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O
Кислотные свойства MnO2 проявляются при сплавлении с щелочами без доступа воздуха:
MnO2 + 2KOH  K2MnO4 + 2H2O
K2MnO4 + 2H2O
Оксид марганца (IV) в зависимости от условий реакции и веществ, с которыми он взаимодействует, проявляет либо окислительные, либо восстановительные свойства:
3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2
NaClO3 + 3MnO2 + 6NaOH = 3Na2MnO4 + NaCl + 3H2O
MnO2 + H2SO4 + H2O2 = MnSO4 + O2 + 2H2O
MnO2 + H2SO4 + KNO2 = MnSO4 + KNO3 + H2O
MnO2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + MnSO4 + 2H2O
MnO2 + SO2 = MnSO4
MnO2 + 2Fe(NO3)2 + 4HNO3 = Mn(NO3)2 + 2Fe(NO3)3 + 2H2O
Оксид марганца (VII)
Оксид марганца (VII) неустойчивое соединение, при слабом нагревании разлагается на оксид марганца (IV) и кислород:
2Mn2O7  4MnO2 + 3O2
4MnO2 + 3O2
Получить оксид марганца (VII) можно действием концентрированной серной кислоты на кристаллический перманганат калия:
2KMnO4 + H2SO4 = K2SO4 + Mn2O7 + H2O
Оксид марганца (VII) – кислотный оксид, который взаимодействует с основными оксидами и основаниями:
Mn2O7 + СaO = Ca(MnO4)2
Mn2O7 + 2KOH = 2KMnO4 + H2O
При взаимодействии с водой он образует марганцевую кислоту:
Mn2O7 + H2O = 2HMnO4
2.
Гидроксиды.
Марганец образует ряд гидроксидов, кислотно-основные свойства которых зависят от степени окисления марганца.
Mn+2(OН)2 Mn+4(OН)4 НMn+7O4
основный амфотерный кислотный
Гидроксид марганца (II)
Основные свойства гидроксида марганца (II) проявляются во взаимодействии с кислотами и кислотными оксидами:
Mn(OН)2 + 2HCl = MnCl2 + 2H2O
Mn(OH)2 + SO3 = MnSO4
Гидроксид марганца (II) на воздухе быстро темнеет, окисляясь в гидроксид марганца (IV):
2Mn(OH)2 + O2 + 2H2O → 2Mn(OH)4
Восстановительные свойства у соединений марганца (II) преобладают.
2Mn(OH)2 + 5KBrO + 2KOH = 2KMnO4 + 5KBr + 3H2O
Mn(OH)2 + H2O2 = MnO2 + 2H2O
Mn(OH)2 + Br2 = MnO2 + 2HBr
2Mn(OH)2 + Ca(ClO)2 = 2MnO2 + CaCl2 + 2H2O
Гидроксид марганца (VII) – марганцевая кислота (HMnO4).
HMnO4 устойчива лишь в растворах с концентрацией не более 20%. При больших концентрациях, она разлагается с выделением кислорода:
4HMnO4 = 4MnO2 + 2H2O + 3O2
Это сильная кислота, в водном растворе она практически полностью диссоциирована:
HMnO4 → H+ + MnO4─
Соединения марганца (VII) сильные окислители:
3PH3 + 8HMnO4 = 8MnO2 + 3H3PO4 + 4H2O
3H2S + 2HMnO4 = 2MnO2 + 3S + 4H2O
3.
Соли.
Соли марганца (II):
MnSO4 + H2O2 + 2NaOH = MnO2 + Na2SO4 + 2H2O
MnSO4 + NaClO + 2NaOH = MnO2 + NaCl + Na2SO4 + H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
Соли марганца (VII).
2KMnO4 → MnO2 + K2MnO4 + O2↑
2KMnO4 + H2SO4 = K2SO4 + H2O + Mn2O7
Перманганат калия – сильный окислитель. В зависимости от рН среды KMnO4 (точнее, ион MnO4─) может восстанавливаться до различной степени окисления.
H+ Mn2+ (бесцветный раствор)
KMnO4 (MnO4─) H2O MnO2 (бурый осадок)
OH─ MnO42─ (раствор зеленого цвета)
2KMnO4 + 5H2O2 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
10KI + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 10FeSO4 + 18H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 18H2O
KMnO4 + 5FeCl2 + 4H2SO4 = 3FeCl3 + MnSO4 + Fe2(SO4)3 + KCl + 4H2O
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2KMnO4 + 2NН3 = 2MnO2 + N2 + 2КОН + 2H2O
2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
2KMnO4 + 3KNO2 + H2O = 3KNO3 + 2MnO2 + 2KOH
2KMnO4 + 5Na2SO3 + 2KOH = 2K2MnO4 + 5Na2SO4 + H2O
3KMnO4 + Al + 4KOH = 3K2MnO4 + K[Al(OH)4]
Свойства соединений марганца (VI)
K2MnO4 + 2KI + H2O = MnO2 + I2 + 4KOH
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
3K2MnO4 + 4HСl = 2KMnO4 + MnO2 + 4KCl + 2H2O
Марганец. Соединения марганца.
1. Нитрат марганца (II) прокалили, к полученному твердому бурому веществу прилили концентрированную хлороводородную кислоту. Выделившийся газ пропустили через сероводородную кислоту. Образовавшийся раствор образует осадок с хлоридом бария. Напишите уравнения описанных реакций.
2. Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество – с раствором соляной кислоты. Напишите уравнения описанных реакций.
3. Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
1
Mn(NO3)2 K2MnO4
4 2
3
MnCl2 Mn(OH)2 10
9
12 5 11
MnO2 KMnO4
8 6
Mn 7 MnSO4
X1 (CH3COO)2Mn
MnO2 X2
X3 MnBr2
K2MnO4 → MnCl2 → Mn(OH)2 → Mn(OH)4
KMnO4
MnO2 → MnSO4 → HMnO4
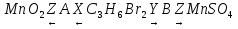
1) Mn(NO3)2  MnO2 + 2NO2
MnO2 + 2NO2
MnO2 + 4HCl = MnCl2 + Cl2 ↑ + 2H2O
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
H2SO4 + BaCl2 = BaSO4 + 2HCl
2) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
4MnO2 + 6H2SO4(конц.) = 2Mn2(SO4)3 + O2↑ + 6H2O
3O2 + 4Al = 2Al2O3
2Al2O3 + 6HCl = 2AlCl3 + 3H2O
3) 2P + 3PCl5 = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
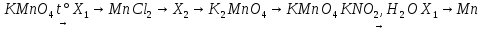
1) 2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
3) MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl
4) Mn(OH)2 + 4KMnO4 + 6KOH = 5K2MnO4 + 4H2O
5) 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
6) 2KMnO4 + 3KNO3 + H2O = 2MnO2 + 3KNO2 + 2KOH
7) 3MnO2 + 4Al  3Mn + 2Al2O3
3Mn + 2Al2O3
1
Mn(NO3)2 K2MnO4
4 2
3
MnCl2 Mn(OH)2 10
9
12 5 11
MnO2 KMnO4
8 6
Mn 7 MnSO4
1.
K2MnO4 + 4HNO2 = 2KNO2 + Mn(NO3)2 + 2H2O
2.
4KMnO4 + Mn(OH)2 + 6KOH = 5K2MnO4 + 4H2O
3.
MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
4.
MnCl2 + AgNO3 = Mn(NO3)2 + 2AgCl↓
5.
2KMnO4 + 3CH2 = CH2 + 4H2O → 3CH2(OH) − CH2(OH) + 2MnO2↓ + 2H2O
6.
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑ + 8H2O
7.
Mn + H2SO4((разб.) = MnSO4 + H2↑
8.
3MnO2 + 4Al  3Mn + 2Al2O3
3Mn + 2Al2O3
9.
2MnO2 + 4HNO2 = Mn(NO3)2 + Mn(NO2)2 + 2H2O
10.
2KMnO4 + H2O2 + 2KOH = 2K2MnO4 + O2↑ + 2H2O
11.
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4
12) 2MnCl2 + 2H2O  Mn + H2 + Mn(OH)2 + 2Cl2
Mn + H2 + Mn(OH)2 + 2Cl2
X1 (CH3COO)2Mn
MnO2 X2
X3 MnBr2
1.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
2.
MnCl2 + CH3COOAg = (CH3COO)2Mn + 2AgCl↓
3.
(CH3COO)2Mn + 2NaOH = Mn(OH)2↓ + 2CH3COONa
4.
Mn(OH)2 + 2HBr = MnBr2 + 2H2O
5.
MnBr2 + 2AgNO3 = Mn(NO3)2 + 2AgBr↓
6.
Mn(NO3)2  MnO2 + 2NO2
MnO2 + 2NO2
K2MnO4 → MnCl2 → Mn(OH)2 → Mn(OH)4
KMnO4
MnO2 → MnSO4 → HMnO4
1.
2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2.
K2MnO4 + 8HCl = MnCl2 + 2KCl + 2Cl2 + 4H2O
3.
MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
4.
2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4
5.
MnO2 + SO2 = MnSO4
6.
2MnSO4 + 8HNO3 + 5PbO = 2HMnO4 + 4Pb(NO3)2 + 2H2O + Pb(HSO4)2
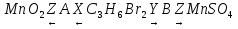
1.
CH2Br – СHBr − CH3 + Mg → MgBr2 + CH2=CH−CH3
2.
3CH2=CH−CH3 + 2KMnO4 + 4H2O → 3CH2OH – CHOH − CH3 + 2KOH + 2MnO2
3.
CH2Br – СHBr − CH3 + 2KOH(спиртовой) → CH ≡ C – CH3 + 2KBr + 2H2O
4.
5CH ≡ C – CH3 + 8KMnO4 + 12H2SO4 → 5CO2 + 5CH3COOH + 8MnSO4 + 4K2SO4 + + 12H2O
Хром. Соединения хрома.
i.
Хром.
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором:
4Cr + 3O2 = 2Cr2O3
2Cr + 3Br2 = 2CrBr3
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
2Cr + N2 = 2CrN
В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O (пар) = Cr2O3 + 3H2
В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов соляной и разбавленной серной кислоты, образуя соли хрома (II):
Cr + 2HCl = CrCl2 + H2
Cr + H2SO4 (разб.) = CrSO4 + H2
В присутствии кислорода – соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
Хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей:
Cr + CuSO4 = CrSO4 + Cu
Концентрированные серная и азотная кислоты на холоду
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|