
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 3 страница
NaNO3 + NH4Cl  NaCl + N2O + 2H2O
NaCl + N2O + 2H2O
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
13) Al2O3 + Na2CO3  2NaAlO2 + CO2
2NaAlO2 + CO2
NaAlO2 + 2H2O = Na[Al(OH)4]
Na[Al(OH)4] + SO2 = Al(OH)3↓ + NaHSO3
NaHSO3 + Br2 + H2O = NaHSO4 + HBr
NaHSO4 + NaOH = Na2SO4 + H2O
HBr + NaOH = NaBr + H2O
14) Al2S3 + 6HCl = 2AlCl3 + 3H2S↑
AlCl3 + 3(NH3 ∙ H2O) = Al(OH)3↓ + 3NH4Cl
Pb(NO3)2 + H2S = PbS↓ + 2HNO3
PbS + 4H2O2 = PbSO4 + 4H2O
15) 2Al + 3S = Al2S3
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Al(OH)3 + KOH = K[Al(OH)4]
K[Al(OH)4]  KAlO2 + 2H2O
KAlO2 + 2H2O
KAlO2 + 4HCl = AlCl3 + KCl + 2H2O
16) KClO3 + 6HCl = KCl + 3Cl2 ↑ + 3H2O
2Al + 3Cl2 = 2AlCl3
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
17) MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
2Al + 3Cl2 = 2AlCl3
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Na[Al(OH)4] + 4HCl = AlCl3 + NaCl + 4H2O
18) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + Na2CO3  2NaAlO2 + CO2↑
2NaAlO2 + CO2↑
19) Al2O3 + Na2CO3  2NaAlO2 + CO2↑
2NaAlO2 + CO2↑
NaAlO2 + 4HCl = NaCl + AlCl3 + 2H2O
AlCl3 + 3(NH3 · H2O) = Al(OH)3↓ + 3NH4Cl
Al(OH)3 + 3KOH = K3[Al(OH)6]
20) Al2O3 + 2NaOH  2NaAlO2 + H2O
2NaAlO2 + H2O
NaAlO2 + NH4Cl + H2O = NaCl + Al(OH)3↓ + NH3↑
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4  NH4HSO4 + NH3↑
NH4HSO4 + NH3↑
21) 2Al + 3S = Al2S3
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Al(OH)3 + KOH = K[Al(OH)4]
допустимо образование K3[Al(OH)6]
3K[Al(OH)4] + AlCl3 = 4Al(OH)3 + 3KCl
22) Al2(SO4)3 + 3Ba(NO3)2 = 3BaSO4↓ + 2Al(NO3)3
Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
23) Al2(SO4)3 + 3K2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 3K2SO4
3H2S + K3[Al(OH)6] = 2Al(OH)3 + 3KHS + 3H2O
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + 2NaOH  2NaAlO2 + H2O
2NaAlO2 + H2O
24) 2Al + 3S  Al2S3
Al2S3
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na[Al(OH)4]
допустимо образование Na3[Al(OH)6]
25) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
26) Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
4Al(NO3)3  2Al2O3 + 12NO2 + 3O2
2Al2O3 + 12NO2 + 3O2
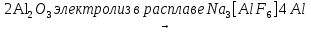 + 3O2
+ 3O2
на катоде на аноде
8Al + 3KNO3 + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4]
27) 2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
Al2O3 + Na2CO3 = 2NaAlO2 + CO2
28) 2Al + 3I2 = 2AlI3
AlI3 + 3NaOH = Al(OH)3 + 3NaI
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaCl
29) 2Al + 6HCl = 2AlCl3 + 3H2
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 6KCl + 3CO2
Al(OH)3 + 3KOH = K3[Al(OH)6]
C + CO2 = 2CO
30) 2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
Na[Al(OH)4] + 4HCl = AlCl3 + NaCl + 4H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
31) 8Al + 3Fe3O4 = 9Fe + 4Al2O3
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
2Fe + 3Cl2 = 2FeCl3
3Na[Al(OH)4] + AlCl3 = 4Al(OH)3 + 3NaCl
Железо. Соединения железа.
i.
Железо.
При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами. Активные неметаллы (фтор, хлор, бром) окисляют железо до устойчивой степени окисления +3, а менее активные (сера, иод) – до степени окисления +2:
2Fe + 3Br2 = 2FeBr3
2Fe + 3Cl2 = 2FeCl3
Fe + I2 = FeI2
Fe + S  FeS
FeS
С углеродом и кремнием железо образует сплавы или соединения:
3Fe + С  Fe3С
Fe3С
3Fe + Si  Fe3Si
Fe3Si
При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III)
3Fe + 2O2  Fe3O4
Fe3O4
Fe + Fe3O4  4FeO
4FeO
При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III)
3Fe + 4H2O(пар)  Fe3O4 + 4H2
Fe3O4 + 4H2
В воде в присутствии кислорода и во влажном воздухе железо окисляется (корродирует)
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Железо реагирует с растворами серной и соляной кислот, вытесняя из них водород и образуя соли железа (II):
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированные серная и азотная кислоты при обычной температуре пассивируют железо. При нагревании железо реагирует с концентрированной H2SO4, образуя сульфат железа (III):
2Fe + 6H2SO4(конц.)  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
а с концентрированной азотной кислотой, образуя нитрат железа (III):
Fe + 6HNO3(конц.)  Fe(NO3)3 + 3NO2↑ + 3H2O
Fe(NO3)3 + 3NO2↑ + 3H2O
Разбавленная азотная кислота в зависимости от концентрации может восстанавливаться железом до NO, N2O, N2, NH3 (NH4NO3)
Fe + 4HNO3(разб.гор.) = Fe(NO3)3 + NO + 2H2O
10Fe + 36HNO3(разб.) = 10Fe(NO3)3 + 3N2 + 18H2O
4Fe + 10HNO3(оч. разб.) = 4Fe(NO3)2 + NH4NO3 + 3H2O
Из растворов солей железо вытесняет металлы, которые располагаются правее его в электрохимическом ряду напряжений:
Fe + CuSO4 = FeSO4 + Cu
При нагревании железных опилок с щелочным расплавом сильных окислителей образуется феррат:
Fe + 2KOH + 3KNO3 = 3KNO2 + K2FeO4 + H2O
2Fe(NO3)3 + Fe = 3Fe(NO3)2
2FeCl3 + Fe = 3FeCl2
Fe2(SO4)3 + Fe = 3FeSO4
ii.
Cоединения железа.
1.
Оксиды железа.
Оксид железа (II).
Оксид железа (II) проявляет основные свойства, растворяется в кислотах, образуя соли железа (II):
FeO + H2SO4(разб.) = FeSO4 + H2O
FeO + 2H+ = Fe2+ + H2O
Оксид железа (II) проявляет окислительно-восстановительную двойственность, но восстановительные свойства преобладают.
3FeO + 10HNO3(разб.)  3Fe(NO3)3 + NO + 5H2O
3Fe(NO3)3 + NO + 5H2O
FeO + 4HNO3(конц.) = NO2 + Fe(NO3)3 + 2H2O
FeO + CO  Fe + CO2
Fe + CO2
Оксид железа (III) проявляет слабовыраженные амфотерные свойства:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Fe2O3 + Na2CO3  2NaFeO2 + CO2
2NaFeO2 + CO2
Fe2O3 + 2NaOH  2NaFeO2 + H2O
2NaFeO2 + H2O
Fe2O3 + 3NaH  3NaOH + 2Fe
3NaOH + 2Fe
Fe2O3 + KClO3 + 4KOH  2K2FeO4 + KCl + 2H2O
2K2FeO4 + KCl + 2H2O
Fe2O3 + 3KNO3 + 4KOH  2K2FeO4 + 3KNO2 + 2H2O
2K2FeO4 + 3KNO2 + 2H2O
Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
Fe2O3 + 3СO  2Fe + 3CO2
2Fe + 3CO2
Fe2O3 + Fe  3FeO
3FeO
Fe2O3 + 3Н2  2Fe + 3H2O
2Fe + 3H2O
Оксид железа (II, III)
Fe3O4 + 4H2  3Fe + 4H2O
3Fe + 4H2O
4Fe3O4 + O2(воздух)  6Fe2O3
6Fe2O3
Fe3O4 + 4CO = 3Fe + 4CO2
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Fe3O4 + 10HNO3(конц.) = NO2↑ + 3Fe(NO3)3 + 5H2O
Fe3O4 + 4H2SO4(разб.) = Fe2(SO4)3 + FeSO4 + 4Н2О
Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O
3Fe3O4 + 28HNO3(разб.) = 9Fe(NO3)3 + NO + 14H2O
3) 2Fe3O4 + 10H2SO4(конц.) = 3Fe2(SO4)3 + SO2 + 10H2O
2.
Гидроксиды железа.
Гидроксид железа (II) проявляет основные свойства.
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Свежеполученный белый осадок – гидроксид железа (II) на воздухе зеленеет, затем буреет, переходя в гидроксид железа (III):
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
2Fe(OH)2 + H2O2 = 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) = Fe2(SO4)3 + SO2 + 6H2O
При нагревании Fe(OH)2 разлагается на оксид железа (II) и воду.
Fe(OH) 2  FeO + H2O
FeO + H2O
Гидроксид железа (III)
Гидроксид железа (III) проявляет слабые амфотерные свойства
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3NaOH  Na3[Fe(OH)6]
Na3[Fe(OH)6]
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
6Fe(OH)3 + H2
2Fe3O4 + 10H2O
3.
Соли.
Соли железа (II)
2FeSO4 + Br2 + H2SO4 = Fe2(SO4)3 + 2HBr
FeBr2 + 4HNO3(конц.) = Fe(NO3)3 + 2HBr + NO2 + H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
6FeSO4 + 2KNO3 + 4H2SO4 = 3Fe2(SO4)3 + 2NO + K2SO4 + 4H2O
2FeSO4 + CuSO4 = Fe2(SO4)3 + Cu
4FeSO4 + O2 + 2H2SO4 = 2Fe2(SO4)3 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
FeCl2 + NaNO2 + 2HCl = FeCl3 + NO + NaCl + H2O
5FeCl2 + 3KMnO4 + 24HCl = 5FeCl3 + 3MnCl2 + 5Cl2 + 3KCl + 12H2O
2FeCl2 + 2H2O  Fe + H2 + 2Cl2 + Fe(OH)2↓
Fe + H2 + 2Cl2 + Fe(OH)2↓
4FeCl2 + 8NaOH + O2 + 2H2O = 4Fe(OH)3↓ + 8NaCl
2FeCl2 + Cl2 + 6NaOH = Fe(OH)3 + 6NaCl + 3H2O
FeCl2 + 4HNO3(конц.) = Fe(NO3)3 + NO2 + 2HCl↑ + H2O
3FeCl2 + 4HNO3 = Fe(NO3)3 + 2FeCl3 + NO + 2H2O
2FeCl2 + Cl2 = 2FeCl3
2FeI2 + 6H2SO4(конц.) = Fe2(SO4)3 + 2I2 + 3SO2 + 6H2O
Fe(NO3)2 + Na2S = FeS↓ + 2NaNO3
2FeS + 7Cl2 = 2FeCl3 + 2SCl4
10FeS + 6KMnO4 + 24H2SO4 = 5Fe2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O
4FeS + 7O2 = 2Fe2O3 + 4SO2
FeS + 12HNO3(конц.) = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
Солижелеза (III)
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Fe = 3FeCl2
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
2FeCl3 + Cu = 2FeCl2 + CuCl2
2FeCl3 + H2 = 2FeCl2 + 2HCl
FeCl3 + 3CH3COOAg = (CH3COO)3Fe + 3AgCl↓
4FeCl3 + 6H2O  2Fe + 3H2 + 2Fe(OH)3 + 6Cl2
2Fe + 3H2 + 2Fe(OH)3 + 6Cl2
2FeBr3 + K2S + 4KOH = 2Fe(OH)2↓ + S↓ + 6KBr
2Fe(NO3)3 + 3Zn = 2Fe + 3Zn(NO2)2
2Fe(NO3)3 + 4H2SO4(конц.) = Fe2(SO4)3 + SO2 + 4HNO3 + 2H2O
Fe(NO3)2 + Na2S = FeS↓ + 2NaNO3
Fe2(SO4)3 + 2KI = I2 + 2FeSO4 + K2SO4
Fe2(SO4)3 + 3BaI2 = 2FeI2 + 3BaSO4↓ + I2↓
Fe2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2FeCl3
2NaFeO2 + 3NaNO3 + 2NaOH  2Na2FeO4 + 3NaNO2 + H2O
2Na2FeO4 + 3NaNO2 + H2O
2K2FeO4 + 16HCl = 4KCl + 2FeCl3 + 3Cl2 + 8H2O
4Fe(NO3)3  2Fe2O3 + 12NO2↑ + 3O2↑
2Fe2O3 + 12NO2↑ + 3O2↑
При смешивании растворов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2Fe(NO3)3 + 3K2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
2FeCl3 + 3Na2SO3 + 3H2O = 2Fe(OH)3↓ + 3SO2↑ + 6NaCl
2Fe(NO3)3 + 3Na2CO3 + H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaNO3
Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2 + 3Na2SO4
Fe2(SO4)3 + Na2SO3 + H2O = Na2SO4 + 2FeSO4 + H2SO4
Железо. Соединения железа.
1. Соль, полученную при растворении железа в концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения описанных реакций.
2. Осадок, полученный при взаимодействии хлорида железа (III) и нитрата серебра отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением тепла и света. Напишите уравнения описанных реакций.
3. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой. Напишите уравнения описанных реакций.
4. Зловонную жидкость, образовавшуюся при взаимодействии бромистого водорода с перманганатом калия, отделили и нагрели с железной стружкой. Продукт реакции растворили в воде и добавили к нему раствор гидроксида цезия. Образовавшийся осадок отфильтровали и покалили. Напишите уравнения описанных реакций.
5. Вещество, полученное на катоде при электролизе раствора хлорида железа (II), сплавили с серой, и продукт этой реакции подвергли обжигу. Образовавшийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
6. Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся в качестве побочного продукта электролиза, отфильтровали и прокалили. Вещество, образовавшееся на катоде, растворили в концентрированной азотной кислоте при нагревании. Продукт, выделившийся на аноде, пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
7. На раствор хлорного железа подействовали раствором едкого натра, выпавший осадок отделили и нагрели. Твердый продукт реакции смешали с кальцинированной содой и прокалили. К оставшемуся веществу добавили нитрат и гидроксид натрия, и длительное время нагревали при высокой температуре. Напишите уравнения описанных реакций.
8. Оксид двухвалентного железа нагрели с разбавленной азотной кислотой. Раствор осторожно выпарили, твердый остаток растворили в воде, в полученный раствор внесли железный порошок и через некоторое время профильтровали. К фильтрату добавили раствор едкого кали, выпавший осадок отделили и оставили на воздухе, при этом цвет вещества изменился. Напишите уравнения описанных реакций.
9. Хлористое железо обработали при нагревании концентрированной азотной кислотой и раствор осторожно выпарили. Твердый продукт растворили в воде, добавили к полученному раствору поташ и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании газообразный водород. Напишите уравнения описанных реакций.
10. К раствору хлорного железа добавили кальцинированную соду и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании угарный газ и твердый продукт последней реакции ввели во взаимодействие с бромом. Напишите уравнения описанных реакций.
11. Железную окалину растворили в концентрированной азотной кислоте при нагревании. Раствор осторожно выпарили, и продукт реакции растворили в воде. К полученному раствору добавили железный порошок, через некоторое время раствор отфильтровали, и фильтрат обработали раствором едкого кали, в результате выделился осадок светло-зеленого цвета, который быстро темнеет на воздухе. Напишите уравнения описанных реакций.
12. К раствору хлорного железа добавили железный порошок и через некоторое время раствор профильтровали. К фильтрату добавили гидроксид натрия, выделившийся осадок отделили и обработали перекисью водорода. К полученному веществу добавили избыток раствора едкого кали и бром; в результате протекания реакции окраска брома исчезла. Напишите уравнения описанных реакций.
13. Нерастворимое вещество, образующееся при добавлении в раствор хлористого железа едкого натра, отделили и растворили в разбавленной серной кислоте. В полученный раствор добавили цинковую пыль, выделившийся осадок отфильтровали и растворили в концентрированной соляной кислоте. Напишите уравнения описанных реакций.
14. Железный порошок растворили в большом количестве разбавленной серной кислоты и через полученный раствор пропустили воздух, а затем газ с запахом тухлых яиц. Образовавшуюся нерастворимую соль отделили и растворили в горячем растворе концентрированной азотной кислоты. Напишите уравнения описанных реакций.
15. Неизвестное вещество А растворяется в концентрированной соляной кислоте, процесс растворения сопровождается выделением газа с запахом тухлых яиц; после нейтрализации раствора щелочью образуется объемный осадок белого (светло-зеленого) цвета. При обжиге вещества А образуются два оксида. Один из них – газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. Напишите уравнения описанных реакций.
16. Серебристо-серый металл, который притягивается магнитом, внесли в горячую концентрированную серную кислоту и нагрели. Раствор охладили и добавили едкий натр до прекращения образования аморфного осадка бурого цвета. Осадок отделили, прокалили и растворили в концентрированной соляной кислоте при нагревании. Напишите уравнения описанных реакций.
17. Вещество, полученное при нагревании железной окалины в атмосфере водорода, внесли в горячую концентрированную кислоту и нагрели. Полученный раствор выпарили, остаток растворили в воде и обработали раствором хлорида бария. Раствор профильтровали и в фильтрат внесли медную пластинку, которая через некоторое время растворилась. Напишите уравнения описанных реакций.
18. Раствор хлорида железа (III) подвергли электролизу. Осадок бурого цвета, образовавшийся при электролизе, отфильтровали, и растворили в растворе гидроксида натрия, после чего добавили такое количество серной кислоты, которое необходимо для образования прозрачного раствора. Продукт, выделившийся на аноде, пропустили через горячий раствор гидроксида калия. Напишите уравнения описанных реакций.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|