
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Нәруыздың бірінші реттік құрылымы
Нә руыздың бірінші реттік қ ұ рылымы
Полипептидтік тізбектегі ә ртү рлі аминқ ышқ ылдар қ алдық тарының бір-бірімен кезектесіп пептидтік байланысу ретін нә руыздың бірінші реттік қ ұ рылымы деп атайды. Кө птеген полипептидтер тізбегі 300-ден 500-ге дейін аминқ ышқ ылы қ алдығ ынан тұ рады. Алғ аш рет 1954 жылы Ф. Сенджеру нә руыз инсулин гормонының аминқ ышқ ылы қ алдығ ының реттілігін анық тады. Инсулин гормоны 51 аминқ ышқ ылынан тұ ратыны белгілі болды.
Нә руыздың екінші реттік қ ұ рылымы 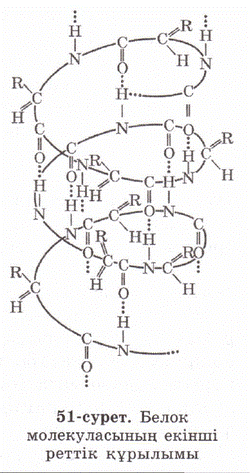
Нобель сыйлығ ының лауреаты, атақ ты ғ алым Лайнус Полинг нә руыздың екінші реттік қ ұ рылымын ашқ ан. Полипептидті тізбектің кең істіктегі оралма тә різді болып келген пішінін нә руыздың екінші реттік қ ұ рылымы деп атайды. Бұ ғ ан нә руыздың жә не тырнақ тың нә руызы кератин жатады. Нә руыздың екінші реттік қ ұ рылымы мутектік байланыстар арқ ылы орындалады. Бір орамдығ ы NH-топтары мен кө ршілес орамдығ ы CO-топтары арасындығ ы тү зілетін сутектік байланыс арқ ылы оралым ұ сталынып тұ рады. Сутектік байланыстар коваленттік байланыстардан анағ ұ рлым ә лсіз. Бірақ бірнеше рет қ айталанғ анда, олар берік байланысады. Кө птеген сутектік байланыстар арқ ылы «тігілген» полипептидті оралым берік қ ұ рылым болып келеді. Нә руызда оралмалы бө ліктерінің бар болуы, оғ ан жылжымалылық, мық тылық, серпімділік қ асиет береді.
Нә руызда цилиндр тә різді оралым бө ліктерінен басқ а аминқ ышқ ылы пролиннен тү зілетін, тізе тә різді бү гілетін бө ліктері де бар.
Нә руыздың ү шінші реттік қ ұ рылымы
Ү шінші реттік қ ұ рылымның тү зілуіне дисульфидті байланыстар ү лкен ү лес қ осады. Олар полипептидті тізбектің ә ртү рлі бө ліктерін байланыстырып, ө зіне тә н ілмектер қ ұ райлы. Бұ л кезде қ ұ рамында S атомы бар аминқ ышқ ылы – цистеиннің радикалдарының арасында байланыс тү зіледі. Бұ л ә лсіз байланыс, бірақ молекулалардың тағ ы да бү ктеліп шумақ талуының нә тижесінде беріктігі арта тү седі. Мұ ны нә руыз молекуласының ү шінші реттік қ ұ рылымы дейді.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|