
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 10 страница
Напишите уравнения описанных реакций.
24. Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
25. Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдали сначала образование осадка, а затем – его полное растворение. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
26. Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
27. Нитрит калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Напишите уравнения описанных реакций.
28. Газ, образовавшийся при взаимодействии азота и водорода, разделили на две части. Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратили в газ бурого цвета. Напишите уравнения описанных реакций.
29. Разбавленная азотная кислота прореагировала с магнием с выделением бесцветного газа. В его атмосфере сожгли графит с образованием простого и сложного вещества. простое вещество при нагревании вступило в реакцию с кальцием, а сложное прореагировало с избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
30. Аммиак поглотили азотной кислотой, полученную соль нагрели до образования только двух оксидов. Один из них прореагировал с натрием, а второй при высокой температуре прореагировал с медью. Напишите уравнения описанных реакций.
31. Оксид азота (II) доокислили кислородом. Продукт реакции поглотили раствором гидроксида калия, через полученный раствор пропускали кислород до тех пор, пока в нем не образовалась только одна соль. Напишите уравнения описанных реакций.
32. Кальций сожгли в атмосфере азота. Полученное вещество разложили кипящей водой. Выделившийся газ сожгли в кислороде в присутствии катализатора, а к суспензии прибавили раствор соляной кислоты. Напишите уравнения описанных реакций.
33. Азот при нагревании на катализаторе прореагировал с водородом. Полученный газ поглотили раствором азотной кислоты, выпарили досуха и полученное кристаллическое вещество разделили на две части. Первую разложили при температуре 190 – 240°С, при этом образовался только один газ и водяные пары. Вторую часть нагрели с концентрированным раствором едкого натра. Напишите уравнения описанных реакций.
Азот. Соединения азота.
1) (NH4)2Cr2O7  N2↑ + Cr2O3 + 4H2O
N2↑ + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
2) N2 + O2 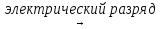 2NO
2NO
2NO + O2 = 2NO2
NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3  2NaNO2 + O2
2NaNO2 + O2
3) (NH4)2Cr2O7  N2↑ + Cr2O3 + 4H2O
N2↑ + Cr2O3 + 4H2O
3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
4NH3 + Cu(OH)2 = [Cu(NH3)4](OH)2
4) 2Hg(NO3)2 + 2H2O  2Hg + O2 + 4HNO3
2Hg + O2 + 4HNO3
4NH3 + 5O2 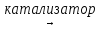 4NO + 6H2O
4NO + 6H2O
2NO + O2 = 2NO2
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
5) I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + O2 + 2H2O = 4HNO3
2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
2Cu(NO3)2  2CuO + O2 + 4NO2
2CuO + O2 + 4NO2
6) 6Li + N2 = 2Li3N
Li3N + 3H2O = 3LiOH + NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
NH4Cl + NaNO2  N2 + NaCl + 2H2O
N2 + NaCl + 2H2O
7) 10Al + 36HNO3 = 10Al(NO3)3 + 3N2↑ + 18H2O
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaNO3
2Al(OH)3  Al2O3 + 3H2O
Al2O3 + 3H2O
NaNO3 + NH4Cl  N2O + NaCl + 2H2O
N2O + NaCl + 2H2O
3N2O + 2NH3 = 4N2 + 3H2O
8) (NH4)2Cr2O7  N2 + Cr2O3 + 4H2O
N2 + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Mg3N2 + 6H2O = 2NH3↑ + 3Mg(OH)2↓
9) N2 + O2 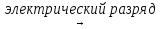 2NO
2NO
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3  2NaNO2 + O2↑
2NaNO2 + O2↑
10) газы – N2, H2, NH3
N2 + 3H2 = 2NH3
NH3 + HBr = NH4Br
NH4Br + KOH = KBr + H2O + NH3↑
4NH3 + 3O2 = 2N2 + 6H2O
11) HNO3 + NaHCO3 = NaNO3 + H2O + CO2↑
2NaNO3  2NaNO2 + O2↑
2NaNO2 + O2↑
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = NH3↑ + 4Na2[Zn(OH)4]
12) N2 + 3H2 ↔ 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3  N2O↑ + 2H2O
N2O↑ + 2H2O
N2O + Cu = CuO + N2↑
13) N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
4NH3 + 5O2 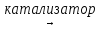 4NO + 6H2O
4NO + 6H2O
2NO + O2 = 2NO2
14) 4NH3 + 5O2 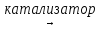 4NO + 6H2O
4NO + 6H2O
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO2 + O2 = 2NaNO3
15) 2NO2 + O2 + 2KOH = 2KNO3 + H2O
KNO3 + 4Mg + 6H2O = NH3↑ + 4Mg(OH)2↓ + KOH
NH3 + HNO3 = NH4NO3
NH4NO3  N2O + 2H2O
N2O + 2H2O
16) Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
4NO2 + O2 + 2H2O = 4HNO3
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O↑ + 5H2O или
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
17) Mg3N2 + 6H2O = 3Mg(OH)2↓ + 2NH3↑
2NH3 + 3Br2 = N2↑ + 6HBr или
8NH3 + 3Br2 = N2↑ + 6NH4Br
2KMnO4 + 2NH3 = 2MnO2 + N2↑ + 3KOH + 3H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
18) 2NH3 + 3Br2 = N2↑ + 6HBr или
8NH3 + 3Br2 = N2↑ + 6NH4Br
N2 + 3H2 ↔ 2NH3
NH3 + HCl = NH4Cl
19) 2NH3 + 3Mg = Mg3N2 + 3H2
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
NH4Br  NH3 + HBr
NH3 + HBr
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaBr
20) N2 + 3H2 = 2NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4↓
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 3H2O
21) 4NH3 + 5O2 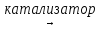 4NO + 6H2O
4NO + 6H2O
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
22) (NH4)2Cr2O7  N2↑ + Cr2O3 + 4H2O
N2↑ + Cr2O3 + 4H2O
N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
2NH3 + 3CuO = N2↑ + 3Cu + 3H2O
23) N2 + 3Ca  Ca3N2
Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
24) KNO2 + NH4Cl  KCl + N2↑ + 2H2O
KCl + N2↑ + 2H2O
N2 + 3Mg  Mg3N2
Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2 + 4NaCl
25) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu(NO3)2 + 2NH3 · H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 2NH3 · H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
26) 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3↑ + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
NH4NO3 + KOH = KNO3 + NH3↑ + H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
27) KNO3 + Pb = KNO2 + PbO
2KNO2 + 2H2SO4 + 2KI = 2K2SO4 + 2NO + I2 + 2H2O
I2 + 10HNO3  2HIO3 + 10NO2 + 4H2O
2HIO3 + 10NO2 + 4H2O
10NO2 + 4P = 2P2O5 + 10NO
28) N2 + 3H2 = 2NH3
3CuO + 2NH3 = 3Cu + N2 + 3H2O
4NH3 + 5O2 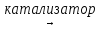 4NO + 6H2O
4NO + 6H2O
2NO + O2 = 2NO2
29) 4Mg + 10HNO3 = 4Mg(NO3)2 + N2O↑ + 5H2O
2N2O + C = 2N2↑ + CO2↑
3Ca + N2 = Ca3N2
CO2 + 2NaOH = Na2CO3 + H2O
30) NH3 + HNO3 = NH4NO3
NH4NO3  N2O + H2O
N2O + H2O
2H2O + 2Na = 2NaOH + H2
N2O + 2CuO = N2 + Cu2O
31) 2NO + O2 = 2NO2
2NO2 + 2KOH = KNO2 + KNO3 + H2O
2KNO2 + O2 = 2KNO3
2KNO3  2KNO2 + O2
2KNO2 + O2
32) 3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = Ca(OH)2 + 2NH3
4NH3 + 5O2 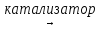 4NO + 6H2O
4NO + 6H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
33) N2 + 3H2 = 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3  N2O + 2H2O
N2O + 2H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Фосфор получают из природных фосфатов, прокаливая их с коксом и песком:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P
Наиболее типичными степенями окисления атома фосфора в соединениях являются: − 3, 0, +3, +5, т.е. фосфор способен проявлять как окислительные, так и восстановительные свойства.
Фосфор легко вступает в реакции с такими неметаллами, как галогены, кислород и сера, со щелочами и более сильными окислителями – в этом проявляются наиболее характерные для фосфора свойства восстановителя.
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P + 3O2 = 2P2O3
4P + 5O2 = 2P2O5
При взаимодействии с галогенами образуются галогениды с общей формулой PHal3 и PHal5
2P + 3Cl2 = 2PCl3
PCl3 – бесцветная, дымящая на воздухе жидкость, которая взаимодействует с водой с образованием фосфористой кислоты:
PCl3 + 3Н2О = Н3РО3 + 3НCl
PCl3 + Cl2 = PCl5
PCl5 – бесцветные кристаллы хлорангидрида фосфорной кислоты. При взаимодействии пентахлорида фосфора с водой образуется фосфорная кислота, со щелочами фосфаты:
PCl5 + 4Н2О = Н3РО4 + 5НCl
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S = P2S3
2P + 5S = P2S5
При взаимодействии с окислителями фосфор окисляется до P2O5 или H3PO4
6P + 5KClO3 = 3P2O5 + 5KCl
2P + 5Ag2O = P2O5 + 10Ag
5HNO3 + P = H3PO4 + 5NO2↑ + H2O
5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO↑
2P + 3H2SO4 = 2H3PO4 + 3SO2
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами:
2P + 3Ca = Ca3P2
2P + 3Mg = Mg3P2
P + 3Na = Na3P
Фосфиды легко разлагаются водой или кислотами с образованием фосфина:
Ca3P2 + 6H2O = 3Са(ОН)2 + 2PH3↑
Mg3P2 + 6HCl = 3MgCl2 + 2PH3↑
Для фосфора характерны также реакции диспропорционирования, в которых он выступает в роли и окислителя, и восстановителя:
4P + 3KOH + 3H2O = 3KH2PO2 + PH3↑ или
P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
дигидрогипофосфит калия (соль фосфорноватистой кислоты)
8P + 3Ca(OH)2 + 6H2O = 3Ca(H2PO2)2 + 2PH3↑
Соединения фосфора.
Фосфин.
Фосфин – ядовитый газ. На воздухе самопроизвольно самовоспламеняется.
2PH3 + 4O2 = P2O5 + 3H2O
PH3 + 2O2 = H3PO4
При взаимодействии с кислотами фосфин может давать соли фосфония (эти соли крайне неустойчивы):
PH3 + HBr = NH4Br
Фосфин является сильным восстановителем
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
PH3 + 3H2SO4 = H3PO4 + 3SO2 + 3H2O
2PH3 + 2PCl3 = 4P + 6HCl
Оксиды.
Оксид фосфора (III)
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций. Поскольку фосфор в этом оксиде проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования:
Р2О3 + О2 = Р2О5
2Р2О3 + 6Н2О (гор.) = РН3 + 3Н3РО4
С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием кислоты:
Р2О3 + 3Н2О = 2Н3РО3
а со щелочами – с образованием солей (фосфитов)
Р2О3 + 4KOH = 2K2HРО3 + H2O
Оксид фосфора (V)
Оксид фосфора (V) – это очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
P2O5 + H2SO4 = 2HPO3 + SO3
P2O5 + 2HNO3 = 2HPO3 + N2O5
P2O5 + 2CH3COOH = 2HPO3 + (CH3CO)2O
Фосфорный ангидрид является типичным кислотным оксидом, давая при взаимодействии с основными оксидами (при сплавлении) и со щелочами соли фосфорной кислоты.
P2O5 + 3H2O = 2H3PO4
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O = 2NaH2PO4
P2O5 + 4NaOH = 2Na2HPO4 + H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|