
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 8 страница
СrCl3 + HOH ↔ CrOHCl2 + HCl
Cоли, образованные катионами хрома (III) и анионом слабой или летучей кислоты, в водных растворах полностью гидролизуются:
Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
Cоединения хрома (VI)
1.
Оксид хрома (VI).
Оксид хрома (VI). Сильно ядовит!
Оксид хрома (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Na2Cr2O7 + 2H2SO4 = 2CrO3 + 2NaHSO4 + H2O
Кислотный оксид, который взаимодействует с основными оксидами, основаниями, водой:
CrO3 + Li2O → Li2CrO4
CrO3 + 2KOH → K2CrO4 + H2O
CrO3 + Н2O = Н2CrO4
2CrO3 + Н2O = Н2Cr2O7
Оксид хрома (VI) сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III)
4CrO3 → 2Cr2O3 + 3O2↑.
4CrO3 + 3S = 2Cr2O3 + 3SO2↑
Окисление солей:
2CrO3 + 3K2SO3 + 3H2SO4 = 3K2SO4 + Cr2(SO4)3 + 3H2O
Окисление органических соединений:
4CrO3 + C2H5OH + 6H2SO4 = 2Cr2(SO4)2 + 2CO2 + 9H2O
Соли.
Сильными окислителями являются соли хромовых кислот – хроматы и дихроматы. Продуктами восстановления которых являются производные хрома (III).
В нейтральной среде образуется гидроксид хрома (III):
K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
2K2CrO4 + 3(NH4)2S + 2H2O = 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
В щелочной – гидроксохроматы (III):
2K2CrO4 + 3NH4HS + 5H2O + 2KOH = 3S + 2K3[Cr(OH)6] + 3NH3 · H2O
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH = 2Na3[Cr(OH)6] + 3Na2SO4
2Na2CrO4 + 3Na2S + 8H2O = 3S + 2Na3[Cr(OH)6] + 4NaOH
В кислой – соли хрома (III):
3H2S + K2Cr2O7 + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
K2Cr2O7 + 3H2S + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
8K2Cr2O7 + 3Ca3P2 + 64HCl = 3Ca3(PO4)2 + 16CrCl3 + 16KCl + 32H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 4H2SO4 + 3KNO2 = Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 7H2O + 2KCl
K2Cr2O7 + 3SO2 + 8HCl = 2KCl + 2CrCl3 + 3H2SO4 + H2O
2K2CrO4 + 16HCl = 3Cl2 + 2CrCl3 + 8H2O + 4KCl
Продукт восстановления в различных средах можно представить схематично:
H2O Cr(OH)3 серо-зеленый осадок
K2CrO4 (CrO42– )
OH– [Cr(OH)6]3– раствор изумрудно-зеленого цвета
K2Cr2O7 (Cr2O72– ) H+ Cr3+ раствор сине-фиолетового цвета
Соли хромовой кислоты – хроматы – желтого цвета, а соли дихромовой кислоты – дихроматы – оранжевого цвета. Изменяя реакцию раствора, можно осуществлять взаимное превращение хроматов в дихроматы:
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O
2K2CrO4 + 2HCl(разб.) = K2Cr2O7 + 2KCl + H2O
2K2CrO4 + H2O + CO2 = K2Cr2O7 + KHCO3
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
кислая среда
2СrO42– + 2H+ Cr2O72– + H2O
щелочная среда
Хром. Соединения хрома.
1. Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество. К этому веществу прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрел желтое окрашивание. Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую; через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зеленый. Напишите уравнения описанных реакций.
2. После кратковременного нагревания неизвестного порошкообразного вещества оранжевого вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зеленый, выделением газа и искр. Твердый остаток смешали с едким кали и нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зеленого цвета, который растворяется в избытке кислоты. Напишите уравнения описанных реакций.
3. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при легком нагревании ее с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь, последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты желтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щелочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
4. Гидроксид трехвалентного хрома обработали соляной кислотой. В полученный раствор добавили поташ, выделившийся осадок отделили и внесли в концентрированный раствор едкого кали, в результате осадок растворился. После добавления избытка соляной кислоты был получен раствор зеленого цвета. Напишите уравнения описанных реакций.
5. При добавлении в раствор соли желтого цвета, окрашивающей пламя в фиолетовый цвет, разбавленной соляной кислоты окраска изменилась на оранжево-красную. После нейтрализации раствора концентрированной щелочью цвет раствора вернулся к первоначальному. При добавлении в полученный хлорида бария выпадает осадок желтого цвета. Осадок отфильтровали и в фильтрат добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
6. К раствору сульфата трехвалентного хрома добавили кальцинированную соду. Выделившийся осадок отделили, перенесли в раствор едкого натра, добавили бром и нагрели. После нейтрализации продуктов реакции серной кислотой раствор приобретает оранжевую окраску, которая исчезает после пропускания через раствор сернистого газа. Напишите уравнения описанных реакций.
7) Порошок сульфида хрома (III) обработали водой. Выпавший при этом серо-зеленый осадок обработали хлорной водой в присутствии гидроксида калия. К полученному желтому раствору прилили раствор сульфита калия, при этом вновь выпал серо-зеленый осадок, который прокалили до постоянства массы. Напишите уравнения описанных реакций.
8) Порошок сульфида хрома (III) растворили в серной кислоте. При этом выделился газ и образовался раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом черный осадок побелел после обработки его пероксидом водорода. Напишите уравнения описанных реакций.
9) Дихромат аммония разложили при нагревании. Твердый продукт разложения растворили в серной кислоте. К полученному раствору прилили раствор гидроксида натрия до выпадения осадка. При дальнейшем приливании гидроксида натрия к осадку он растворился. Напишите уравнения описанных реакций.
10) Оксид хрома (VI) прореагировал с гидроксидом калия. Полученное вещество обработали серной кислотой, из образовавшегося раствора выделили соль оранжевого цвета. Эту соль обработали бромоводородной кислотой. Полученное простое вещество вступило в реакцию с сероводородом. Напишите уравнения описанных реакций.
11. Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся желтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зеленым. Напишите уравнения описанных реакций.
12. Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. выделившийся при этом газ прореагировал с избытком раствора гидроксида бария с выпадением осадка белого цвета. Осадок растворили в избытке раствора соляной кислоты и в полученный раствор добавили нитрат серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
13. Калий сплавили с серой. Полученную соль обработали соляной кислотой. выделившийся при этом газ пропустили через раствор бихромата калия в серной кислоте. выпавшее вещество желтого цвета отфильтровали и сплавили с алюминием. Напишите уравнения описанных реакций.
14. Хром сожгли в атмосфере хлора. К образовавшейся соли добавили по каплям гидроксид калия до прекращения выделения осадка. Полученный осадок окислили перекисью водорода в среде едкого калия и упарили. К полученному твердому остатку добавили избыток горячего раствора концентрированной соляной кислоты. Напишите уравнения описанных реакций.
Хром. Соединения хрома.
1) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + Na2SO4 + 3S↓ + 7H2O
2) (NH4)2Cr2O7
Cr2O3 + N2↑ + 4H2O↑
Cr2O3 + 2KOH 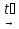 2KCrO2 + H2O
2KCrO2 + H2O
KCrO2 + H2O + HCl = KCl + Cr(OH)3↓
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
3) KNO3(тв.) + H2SO4(конц.) 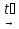 HNO3 + KHSO4
HNO3 + KHSO4
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
4) Cr(OH)3 + 3HCl = CrCl3 + 3H2O
2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 6KCl
Cr(OH)3 + 3KOH = K3[Cr(OH)6]
K3[Cr(OH)6] + 6HCl = CrCl3 + 3KCl + 6Н2О
5) 2K2CrO4 + 2HCl = K2Cr2O7 + 2KCl + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
K2CrO4 + BaCl2 = BaCrO4↓ + 2 KCl
KCl + AgNO3 = AgCl↓ + KNO3
6) Cr2(SO4)3 + 3Na2CO3 + 6H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2Cr(OH)3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + H2SO4 + 3SO2 = Cr2(SO4)3 + Na2SO4 + H2O
7) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
2K2CrO4 + 3K2SO3 + 5H2O = 2Cr(OH)2 + 3K2SO4 + 4KOH
2Cr(OH)3  Cr2O3 + 3H2O
Cr2O3 + 3H2O
8) Cr2S3 + 3H2SO4 = Cr2(SO4)3 + 3H2S↑
Cr2(SO4)3 + 6NH3 + 6H2O = 2Cr(OH)3↓ + 3(NH4)2SO4
H2S + Pb(NO3)2 = PbS + 2HNO3
PbS + 4H2O2 = PbSO4 + 4H2O
9) (NH4)2Cr2O7  Cr2O3 + N2 + 4H2O
Cr2O3 + N2 + 4H2O
Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3↓ + 3Na2SO4
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
10) CrO3 + 2KOH = K2CrO4 + H2O
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 14HBr = 3Br2 + 2CrBr3 + 7H2O + 2KBr
Br2 + H2S = S + 2HBr
11) 2Cr + 3Cl2 = 2CrCl3
2CrCl3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 3Cu2O + 10H2SO4 = 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
12) 3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
CO2 + Ba(OH)2 = BaCO3↓ + H2O
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
13) 2K + S = K2S
K2S + 2HCl = 2KCl + H2S↑
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3S + 2Al = Al2S3
14) 2Cr + 3Cl2 = 2CrCl3
CrCl3 + 3KOH = 3KCl + Cr(OH)3↓
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
2K2CrO4 + 16HCl = 2CrCl3 + 4KCl + 3Cl2 + 8H2O
Неметаллы.
IV A группа (углерод, кремний).
Углерод. Соединения углерода.
I. Углерод.
Углерод может проявлять как восстановительные, так и окислительные свойства. Восстановительные свойства углерод проявляет с простыми веществами, образованными неметаллами с большим по сравнению с ним значением электроотрицательности (галогенами, кислородом, серой, азотом), а также с оксидами металлов, водой и другими окислителями.
При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 = CO2
при недостатке кислорода можно получить СО
2C + O2 = 2CO
Аморфный углерод уже при комнатной температуре реагирует с фтором.
С + 2F2 = CF4
При нагревании с хлором:
С + 2Cl2 = CCl4
При более сильном нагревании углерод реагирует с серой, кремнием:
C + 2S = CS2
C + Si = SiC
При действии электрического разряда углерод соединяется с азотом, образуя диацин:
2С + N2 → N ≡ C – C ≡ N
В присутствии катализатора (никель) и при нагревании углерод реагирует с водородом:
С + 2Н2 = СН4
С водой раскаленный кокс образует смесь газов:
С + H2O = CO + H2
Восстановительные свойства углерода применяются в пирометаллургии:
C + CuO = Cu + CO
При нагревании с оксидами активных металлов углерод образует карбиды:
3С + СаО = СаС2 + СО
9С + 2Al2O3 = Al4C3 + 6CO
2C + Na2SO4 = Na2S + CO2
2C + Na2CO3 = 2Na + 3CO
Углерод окисляют такие сильные окислители, как концентрированные серная и азотная кислоты, другие окислители:
C + 4HNO3(конц.) = CO2 + 4NO2 + 2H2O
С + 2H2SO4 (конц.) = 2SO2 + CO2 + 2H2O
3C + 8H2SO4 + 2K2Cr2O7 = 2Cr2(SO4)3 + 2K2SO4 + 3CO2 + 8H2O
В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al = Al4C3
2C + Ca = CaC2
Карбиды подвергаются гидролизу, образуя при этом углеводороды:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
CaC2 + 2H2O = Ca(OH)2 + C2H2
II. Соединения углерода.
Оксиды.
Оксид углерода (II).
Оксид углерода (II) несолеобразующий оксид. Очень ядовит!
В лаборатории получают действием концентрированной серной кислоты на муравьиную кислоту:
НСООН 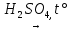 CO + H2O
CO + H2O
Химическая активность угарного газа крайне мала. При обычных условиях он не реагирует ни с водой, ни с кислотами, ни со щелочами. При высоких температурах вступает в окислительно-восстановительные реакции в роли восстановителя.
СО горит синим пламенем:
2СO + O2 = 2CO2
Восстанавливает металлы из их оксидов:
3CO + Fe2O3 = 2Fe + 3CO2
СО + CuO = Cu + CO2
СО + NiO = Ni + CO2
Взаимодействует с парами воды:
CO + H2O ↔ CO2 + H2
В присутствии катализатора или при облучении СО окисляется хлором, образуя ядовитый газ фосген:
CO + Cl2 = COCl2
СО окисляется пероксидом натрия:
CO + Na2O2 = Na2CO3
При нагревании с водородом при повышенном давлении образуется метиловый спирт:
CO + 2H2 ↔ CH3OH
При пропускании СО в расплав щелочи при высоком давлении образуется соль (формиат натрия) в результате протекания окислительно-восстановительной реакции:
CO + NaOH = HCOONa
Оксид углерода (IV).
Как кислотный оксид взаимодействует с водой (реакция обратима), основными оксидами и растворами щелочей:
CO2 + H2O ↔ H2CO3
CO2 + CaO = CaCO3
CO2 + 2NaOH (избыток) = Na2CO3 + H2O
CO2(избыток) + NaOH = NaHCO3
При пропускании СО2 через раствор карбоната образуется гидрокарбонат:
Na2CO3 + CO2 + H2O = 2NaHCO3
В реакциях СО2 способен выступать только в роли окислителя. При высоких температурах он взаимодействует с углем и с активными металлами:
CO2 + C = 2CO
CO2 + 2Mg = 2MgO + C
2CO2 + 2Na2O2 = 2Na2CO3 + O2
Na2SiO3 + 2CO2 + 2H2O = 2NaHCO3 + H2SiO3↓
Соли (карбонаты, гидрокарбонаты).
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO3  CaO + CO2
CaO + CO2
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH4)2CO3  2NH3 + 2H2O + CO2
2NH3 + 2H2O + CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3  Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Качественной реакцией на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2
Na2CO3 + 2HCl = 2NaCl + CO2 ↑ + H2O
NaHCO3 + HCl = NaCl + CO2 ↑ + H2O
При смешивании растворов будет происходить гидролиз и по аниону слабой кислоты и по катиону слабого основания:
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
Кремний. Соединения кремния.
Кремний.
При низких температурах кремний химически инертен, при высоких температурах реагирует как с неметаллами, так и с некоторыми металлами. В большинстве случаев кремний является восстановителем, в реакциях с более сильными восстановителями (активными металлами) выступает в роли окислителя.
При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 = SiO2
При взаимодействии с галогенами (с фтором при комнатной температуре), при нагревании с хлором, бромом, иодом образуются галогениды кремния:
Si + 2Cl2 = SiCl4
Si + 2Br2 = SiBr4
При температуре выше 600°С взаимодействует с серой:
Si + 2S = SiS2
При температуре около 2000°С кремний соединяется с углеродом с образованием карбида кремния (карборунда):
Si + С = SiС
При взаимодействии с активными металлами образуются силициды металлов:
Si + 2Mg = Mg2Si
Si + 2Са = Са2Si
Si + 2MgO = Mg2Si + 2SiO
Силициды щелочных, щелочноземельных металлов и магния разлагаются водой, щелочами и разбавленными кислотами с образованием силана:
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4↑
2Ca2Si + 4NaOH + 10H2O = 2Na2SiO3 + 4Ca(OH)2 + SiH4↑
Mg2Si + 4HCl = 2MgCl2 + SiH4↑
В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты :
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте:
Si + 6HF = H2[SiF6] + 2H2
(Si(тв.) + 4HF(г.) = SiF4 + 2H2)
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF = 3SiF4 + 4NO + 8H2O
Соединения кремния.
Оксиды.
Оксид кремния (IV). Как кислотный оксид, SiO2 при сплавлении взаимодействует с твердыми щелочами, основными оксидами и карбонатами с образованием солей кремниевой кислоты (силикатов):
SiO2 + 2KOH  K2SiO3 + H2O (растворы щелочей также действуют на SiO2)
K2SiO3 + H2O (растворы щелочей также действуют на SiO2)
SiO2 + CaO  CaCO3
CaCO3
SiO2 + K2CO3  K2SiO3 + CO2
K2SiO3 + CO2
Взаимодействует с плавиковой кислотой:
SiO2 + 6HF = H2[SiF6] + 2H2O
При нагревании смеси SiO2 с углеродом образуется карбид кремния:
SiO2 + 3С  SiС + 2СО
SiС + 2СО
SiO2 + 2Mg  2MgO + Si
2MgO + Si
3SiO2 + Ca3(PO4)2 + 5C  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
Водородное соединение. Силан.
Силан – ядовитый бесцветный газ. На воздухе силан горит с образованием SiO2 и H2O, водой и щелочами разлагаются с выделением водорода:
SiH4 + 2O2 = SiO2 + 2H2O
SiH4 + 2H2O = SiO2 + 4H2
SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2
Тетрахлорид кремния.
SiCl4 + 3H2O = H2SiO3↓ + 4HCl
SiCl4 + 2H2 = Si + 4HCl
Углерод, кремний. Соединения углерода и кремния.
1. Газы, которые выделяются при нагревании угля в концентрированной азотной и серной кислотах, смешали друг с другом. Продукты реакции пропустили через известковое молоко. Напишите уравнения описанных реакций.
2. Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при нагревании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение. Напишите уравнения описанных реакций.
3. Газ, образовавшийся при сгорании кокса, длительное время соприкасался с раскаленным углем. Продукт реакции последовательно пропустили через слой железной руды и негашеную известь. Напишите уравнения описанных реакций осадка.
4. Одно из веществ, образующихся при сплавлении оксида кремния с магнием, растворяется в щелочи. Выделяющийся газ ввели в реакцию с серой, а продукт их взаимодействия обработали хлором. Напишите уравнения описанных реакций.
5. Силицид магния обработали раствором хлороводородной кислоты и выделяющийся газ сожгли. Твердый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали некоторое время. После охлаждения продукт реакции (используется под названием «жидкое стекло») растворили в воде и обработали раствором серной кислотой. Напишите уравнения описанных реакций.
6. Хлорид кремния (IV) нагрели в смеси с водородом. Продукт реакции смешали с магниевым порошком, нагрели и обработали водой, одно из образующихся веществ самовоспламеняется на воздухе. Напишите уравнения описанных реакций.
7. Силицид магния обработали раствором соляной кислоты, продукт реакции сожгли, образовавшееся твердое вещество смешали с кальцинированной содой и нагрели до плавления. После охлаждения расплава его обработали водой и к полученному раствору добавили азотную кислоту. Напишите уравнения описанных реакций.
8. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой, и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
9. Кремний сожгли в атмосфере хлора. Полученный хлорид обработали водой. выделившийся при этом осадок прокалили. Затем сплавили с фосфатом кальция и углем. Напишите уравнения описанных реакций.
10. Вещество, образующееся при сплавлении магния с кремнием обработали водой, в результате образовался и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
11. Продукт взаимодействия кремния с хлором легко гидролизуется. При сплавлении твердого продукта гидролиза как с каустической, так и кальцинированной содой образуется жидкое стекло. Напишите уравнения описанных реакций.
12. Углерод сожгли в избытке кислорода, образовавшийся газ пропустили над оксидом меди (II). Полученное вещество сплавили с серой, а продукт этой реакции сожгли в кислороде. Напишите уравнения описанных реакций.
13. Кремний сожгли в кислороде. Продукт реакции сплавили с карбонатом натрия, образовавшееся вещество обработали избытком соляной кислоты при нагревании. Осадок отфильтровали, а к фильтрату добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
14. Кремний растворили в концентрированном растворе гидроксида натрия. Через полученный раствор пропустили углекислый газ. Выпавший осадок отфильтровали, высушили и разделили на две части. Первую растворили в плавиковой кислоте, вторую сплавили с магнием. Напишите уравнения описанных реакций.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|