
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 9 страница
Углерод, кремний. Соединения углерода и кремния.
1. C + 2H2SO4(конц.) = CO2↑ + 2SO2↑ + 2H2O
C + 4HNO3(конц.) = CO2↑ + 4NO2↑ + 2H2O
SO2 + NO2 = SO3 + NO
SO3 + Ca(OH)2 = CaSO4↓ + H2O
CO2 + Ca(OH)2 = CaCO3↓ + H2O
2. CaO + H2O = Ca(OH)2
2NaHCO3→Na2CO3 + CO2 ↑ + H2O
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
3. С + O2 = CO2
CO2 + C = 2CO
Fe2O3 + 3CO = 2Fe + 3CO2 или
Fe3O4 + 4CO = 3Fe + 4CO2
СаО + СО2 = СаСО3
4. 2С + O2 = 2CO
CO + CuO = Cu + CO2
Cu + S = CuS
2CuS + 3O2 = 2CuO + 2SO2
5. SiO2 + 2Mg = 2MgO + Si
Si + 2NaOH + 2H2O = Na2SiO3 + 2H2↑
H2 + S = H2S
H2S + Cl2 = 2HCl + S↓
6. Mg2Si + 4HCl = 2MgCl2 + 2SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
7. SiCl4 + 2H2 = Si + 4HCl
Si + 2Mg = Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2O2 = SiO2↓ + 2H2O
8. Mg2Si + 4HCl = 2MgCl2 + 2SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3↓
9. Si + 2Mg = Mg2Si
Mg2Si + 4H2O (холл.) = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2H2O (гор.) = SiO2 + 4H2
SiO2 + 2NaOH = Na2SiO3 + H2O
10. Si + 2Cl2 = SiCl4
SiCl4 + 3H2O = H2SiO3↓ + 4HCl
H2SiO3  SiO2 + H2O
SiO2 + H2O
3SiO2 + Ca3(PO4)2 + 5C  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
11. Si + 2Mg = Mg2Si
Mg2Si + 4H2O (холл.) = 2Mg(OH)2↓ + SiH4↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
3SiH4 + 8KMnO4 = 8MnO2↓ + 3SiO2↓ + 8KOH + 2H2O
12. Si + 2Cl2 = SiCl4
SiCl4 + 2H2O = SiO2↓ + 4HCl
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
13. Si + O2 = SiO2
SiO2 + Na2CO3 = Na2SiO3 + CO2
Na2SiO3 + 2HCl = 2NaCl + SiO2↓ + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
14. Si + 2NaOH + 2H2O = Na2SiO3 + 2H2↑
Na2SiO3 + CO2 = Na2CO3 + SiO2↓
SiO2 + 4HF = SiF4 + 2H2O
SiO2 + 2Mg = Si + 2MgO
V A группа (азот, фосфор)
Азот. Соединения азота.
I.Азот.
В лаборатории получают разложением нитрита аммония:
NH4NO2  N2 + 2H2O
N2 + 2H2O
NaNO2 + NH4Cl  N2 + NaCl + 2H2O
N2 + NaCl + 2H2O
В обычных условиях азот не реагирует ни с металлами (за исключением лития – с ним N2 взаимодействует при комнатной температуре), ни с неметаллами. При нагревании химическая активность азота повышается.
При взаимодействии с металлами образуются нитриды металлов:
N2 + 6 Li = 2Li3N
N2 + 6 Na  2Na3N
2Na3N
N2 + 3Mg  Mg3N2
Mg3N2
N2 + 2Al (порошок)  2AlN
2AlN
Нитриды щелочных и щелочноземельных металлов легко разлагаются водой и растворами кислот:
Li3N + 3H2O = 3LiOH + NH3
Ca3N2 + 6HCl = 3CaCl2 + 2NH3
C неметаллами азот взаимодействует только в специальных условиях – при высокой температуре, давлении, в присутствии катализатора или при пропускании сильного электрического разряда:
N2 + 3H2 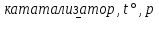 2NH3
2NH3
N2 + O2 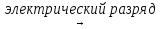 2NO
2NO
N2 + 3LiH  Li3N + NH3
Li3N + NH3
II. Соединения азота.
1.
Аммиак.
Наиболее энергично аммиак реагирует с хлором и бромом, оксидами некоторых металлов, а также (при поджигании смеси или в присутствии катализатора) с кислородом:
2NH3 + 3Cl2 = N2 + 6HCl
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 5O2 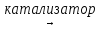 4NO + 6H2O
4NO + 6H2O
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 = N2 + 6H2O
За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием:
2NH3 + 2Na = 2NaNH2 + H2 (Na2NH, Na3N)
2NH3 + 2Al = 2AlN + 3H2
Растворение аммиака в воде сопровождается химическим взаимодействием с ней:
NH3 + H2O ↔ NH3 ∙ H2O ↔ NH4+ + OH−
При взаимодействии с кислотами образуются соли аммония:
NH3 + HCl = NH4Cl
NH3 + H2SO4 = NH4HSO4
2NH3 + H2SO4 = (NH4)2SO4
При взаимодействии аммиака с углекислым газом образуется карбамид (мочевина):
2NH3 + CO2 = (NH2)2CO + H2O
Аммиак вступает в реакции комплексообразования:
6NH3 + CuCl2 = [Cu(NH3)6]Cl2
4NH3 + Cu(OH)2 = [Cu(NH3)4](OH)2
2.
Соли аммония.
Все соли аммония проявляют общие свойства солей (взаимодействуют с растворами кислот, щелочей и других солей), а также подвергаются гидролизу и разлагаются при нагревании:
NH4Cl + KOH = KCl + NH3 + H2O (качественная реакция на NH4+ )
(NH4)2SO4 + Ba(NO3)2 = 2NH4NO3 + BaSO4↓
NH4+ + HOH ↔ NH3 ∙ H2O + H+
NH4HS + 3HNO3 = S + 2NO2 + NH4NO3 + 2H2O
Если соль не содержит аниона-окислителя, то разложение проходит без изменения степени окисления атома азота:
NH4Cl  NH3 + HCl
NH3 + HCl
NH4HCO3  NH3 + CO2 + H2O
NH3 + CO2 + H2O
(NH4)2SO4  NH4HSO4 + NH3
NH4HSO4 + NH3
NH4HS  NH3 + H2S
NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония:
NH4NO2  N2 + 2H2O
N2 + 2H2O
NH4NO3 = N2O + 2H2O (190 – 245° C)
2NH4NO3 = 2NO + 4H2O (250 – 300° C)
2NH4NO3 = 2N2 + O2 + 4H2O (выше 300° С)
(NH4)2Cr2O7  Cr2O3 + N2 + 4H2O
Cr2O3 + N2 + 4H2O
3.
Оксиды азота.
| оксид | степень окисления | цвет (н.у.) | характер оксида |
| N2O | +1 | бесцветный | несолеобразующий |
| NO | +2 | бесцветный | несолеобразующий |
| N2O3 | +3 | синий | кислотный |
| NO2 | +4 | бурый | кислотный |
| N2O5 | +5 | бесцветный | кислотный |
N2O
В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
N2O + H2 = N2 + H2O
N2O + Mg = N2 + MgO
N2O + 2Cu = N2 + Cu2O
3N2O + 2NH3 = 4N2 + 3H2O
N2O + H2O + SO2 = N2 + H2SO4
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
5N2O + 3H2SO4 + 2KMnO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O
NO NO ядовит!
В лаборатории получают взаимодействием 30%-ной азотной кислоты с некоторыми металлами:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить по реакциям:
FeCl2 + NaNO3 + 2HCl = FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI = 2NO + I2 + 2H2O
На воздухе NO практически мгновенно окисляется до NO2
2NO + O2 = 2NO2
По отношению к галогенам, озону также проявляет свойства восстановителя:
2NO + Cl2 = 2NOCl
NO + O3 = NO2 + O2
В присутствии более сильных восстановителей проявляет свойства окислителя:
2NO + 2H2 = N2 + 2H2O
2NO + 2SO2 = 2SO3 + N2
N2O3
Кислотный оксид. Ангидрид азотистой кислоты. При взаимодействии с водой дает азотистую кислоту:
N2O3 + H2O ↔ 2HNO2
При взаимодействии с растворами щелочей образуются нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O
NO2
Очень ядовит! Для NO2 характерна высокая химическая активность: он взаимодействует с неметаллами (фосфор, уголь, сера горят в оксиде азота (IV), оксид серы (IV) окисляется до оксида серы VI)). В этих реакциях NO2 – окислитель:
2NO2 + 2S = N2 + 2SO2
2NO2 + 2C = N2 + 2CO2
10NO2 + 8P = 5N2 + 4P2O5
NO2 + SO2 = SO3 + NO
Растворение NO2 в воде приводит к образованию азотной и азотистой кислот:
2NO2 + H2O = HNO3 + HNO2
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O = 2HNO3 + NO
При нагревании:
4NO2 + 2H2O = 4HNO3 + O2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 = 4HNO3
При растворении в щелочах – нитраты и нитриты:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода – нитраты:
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
N2O5
Кислотный оксид. Ангидрид азотной кислоты.
Растворяется в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
в щелочах – с образованием нитратов:
N2O5 + 2NaOH = 2NaNO3 + H2O
4) Кислоты.
HNO2 Азотистая кислота.
HNO2 существует только в разбавленных растворах, при нагревании которых она разлагается:
3HNO2 ↔ HNO3 + 2NO + H2O
Поскольку степень окисления азота в HNO2 равна +3, то азотистая кислота проявляет как окислительные свойства, так и восстановительные:
2HNO2 + 2HI = 2NO + I2 + 2H2O
5HNO3 + 2HMnO4 = 2Mn(NO3)2 + HNO3 + 3H2O
HNO2 + Cl2 + H2O = HNO3 + 2HCl
2HNO2 + O2 = 2HNO3
HNO2 + H2O2 = HNO3 + H2O
2HNO2 + 3H2SO4 + 6FeSO4 = 3Fe2(SO4)3 + N2 + 4H2O
HNO3 Азотная кислота.
При кипении (tкип. = 85°C) и при длительном стоянии она частично разлагается:
4HNO3  4NO2 + O2 + 2H2O
4NO2 + O2 + 2H2O
Азотная кислота проявляет очень высокую химическую активность. Степень окисления азота в HNO3 равна +5, поэтому азотная кислота является окислителем, причем очень сильным. В зависимости от условий (природы восстановителя, концентрации HNO3 и температуры) степень окисления атома азота в продуктах реакции может меняться от +4 до −3: NO2, NO, N2O, N2, NН4+
NO3− + 2H+ + 1e → NO2 + H2O
NO3− + 4H+ + 3e → NO + 2H2O
2NO3− + 10H+ + 8e → N2O + 5H2O
2NO3− + 12H+ + 10e → N2 + 6H2O
NO3− + 10H+ + 8e → NH4+ + 3H2O
Чем выше концентрация азотной кислоты, тем меньше электронов склонен принять анион NO3− .
Взаимодействие с металлами.
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет:
Fe + 6HNO3(конц.)  Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.)  Al(NO3)3 + 3NO2 + 3H2O
Al(NO3)3 + 3NO2 + 3H2O
Золото и платина растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему)
HNO3 + 3HCl + Au = AuCl3 + NO + 2H2O
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2 + 2H2O
8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
4HNO3 (60%) + Zn = Zn(NO3)2 + 2NO2 + 2H2O
8HNO3 (30%) + 3Zn = 3Zn(NO3)2 + 2NO + 4H2O
10HNO3 (20%) + 4Zn = 4Zn(NO3)2 + 2N2O + 5H2O
10HNO3 (3%) + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O
Взаимодействие с неметаллами.
При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот:
6HNO3 + S = H2SO4 + 6NO2 + 2H2O
5HNO3 + P = H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO
4HNO3 + C = CO2 + 4NO2 + 2H2O
10HNO3 + I2 = 2HIO3 + 10NO2 + 4H2O
Свойства окислителя НNO3 может проявлять и в реакциях со сложными веществами:
6HNO3 + HI = HIO3 + 6NO2 + 3H2O
2HNO3 + SO2 = H2SO4 + 2NO2
2HNO3 + H2S = S + 2NO2 + 2H2O
8HNO3 + CuS = CuSO4 + 8NO2 + 4H2O
4HNO3 + FeS = Fe(NO3)3 + NO + S + 2H2O
5) Соли
Соли азотистой кислоты – нитриты.
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные:
2KNO2 + O2 = 2KNO3
KNO2 + H2O2 = KNO3 + H2O
KNO2 + H2O + Br2 = KNO3 + 2HBr
5KNO2 + 3H2SO4 + 2KMnO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
2KNO2 + 2H2SO4 + 2KI = 2NO + I2 + 2K2SO4 + 2H2O
3KNO2 + Cr2O3 + KNO3 = 2K2CrO4 + 4NO
Соли азотной кислоты – нитраты.
Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
1.
Соли щелочных и щелочноземельных металлов (до Mg) разлагаются до нитрита и кислорода:
2NaNO3 2NaNO2 + O2
2.
Соли тяжелых металлов (от Mg до Cu) – до оксида металла, оксида азота (IV) и кислорода:
2Cu(NO3)2  2CuO + 4NO2 + O
2CuO + 4NO2 + O
3.
Соли малоактивных металлов (правее Cu) – до металла, оксида азота (IV) и кислорода
2AgNO3  2Ag + 2NO2 + O2
2Ag + 2NO2 + O2
Смесь 75% KNO3, 15% C и 10% S называют «черным порохом»
2KNO3 + 3C + S = N2 + 3CO2 + K2S +Q
Азот. Соединения азота.
1. Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании её с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
2. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрасился в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
3. В результате термического разложения дихромата аммония получили газ, который пропустили над нагретым магнием. Образовавшееся вещество поместили в воду. образовавшийся при этом газ пропустили через свежеосажденный гидроксид меди (II). Напишите уравнения описанных реакций.
4. Газ, выделившийся на аноде при электролизе нитрата ртути (II), был использован для каталитического окисления аммиака. Получившийся в результате реакции бесцветный газ мгновенно вступил в реакцию с кислородом воздуха. Образовавшийся бурый газ пропустили через баритовую воду. Напишите уравнения описанных реакций.
5. Йод поместили в пробирку с концентрированной горячей азотной кислотой. выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
6. Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели. Напишите уравнения описанных реакций.
7. Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций.
8. Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании ее с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
9. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
10. Смесь двух бесцветных, не имеющих цвета и запаха, газов А и Б пропустили при нагревании над катализатором, содержащим железо, и образующимся при этом газом В нейтрализовали раствором бромоводородной кислоты. Раствор выпарили и остаток нагрели с едким кали, в результате выделился бесцветный газ В с резким запахом. При сжигании газа В на воздухе образуется вода и газ А. Напишите уравнения описанных реакций.
11. Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
12. Азотоводородную смесь нагрели до температуры 500º С и под высоким давлением пропустили над железным катализатором. Продукты реакции пропустили через раствор азотной кислоты до его нейтрализации. Образовавшийся раствор осторожно выпарили, твердый остаток прокалили и выделившийся при этом газ пропустили над медью при нагревании, в результате образовалось вещество черного цвета. Напишите уравнения описанных реакций.
13. Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшееся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
14. Газовую смесь аммиака и большого избытка воздуха пропустили при нагревании над платиной и продукты реакции через некоторое время поглотили раствором едкого натра. После выпаривания раствора был получен единственный продукт. Напишите уравнения описанных реакций.
15. Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели; выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
16. Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
17. Нитрид магния обработали избытком воды. При пропускании выделившегося газа через бромную воду или через нейтральный раствор перманганата калия, так и при его сжигании образуется один и тот же газообразный продукт. Напишите уравнения описанных реакций.
18. Один из продуктов взаимодействия аммиака с бромом – газ, входящий в состав атмосферы, смешали с водородом и нагрели в присутствии платины. Образовавшуюся смесь газов пропустили через раствор соляной кислоты и к полученному раствору добавили при небольшом нагревании нитрит калия. Напишите уравнения описанных реакций.
19. Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагревали до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
20. Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария и после отделения выпавшего осадка – известковое молоко и нагрели. Напишите уравнения описанных реакций.
21. Аммиак смешали с большим избытком воздуха, нагрели в присутствии платины и через некоторое время поглотили водой. Медная стружка, добавленная в полученный раствор растворяется с выделением бурого газа. Напишите уравнения описанных реакций.
22. При нагревании вещества оранжевого цвета оно разлагается; среди продуктов разложения – бесцветный газ и твердое вещество зеленого цвета. Выделившийся газ реагирует с литием даже при небольшом нагревании. Продукт последней реакции взаимодействует с водой, при этом выделился газ с резким запахом, который может восстанавливать металлы, например медь из их оксидов. Напишите уравнения описанных реакций.
23. Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|