
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 5 страница
3. 2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
2Fe + 3Cl2 = 2FeCl3
2FeCl3 + 3Na2S = S↓ + 2FeS↓ + 6NaCl
S + 6HNO3(конц. гор.) = H2SO4 + 6NO2 + 2H2O
4. 2KMnO4 + 16HBr = 2MnCl2 + 2KCl + 5Br2 + 8H2O
2Fe + 3Br2 = 2FeBr3
FeBr3 + 3CsOH = Fe(OH)3↓ + 3CsBr
2Fe(OH)3
Fe2O3 + 3H2O
5. 2FeCl2 + 2H2O 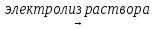 Fe + H2 + Fe(OH)2 + 2Cl2
Fe + H2 + Fe(OH)2 + 2Cl2
Fe + S  FeS
FeS
4FeS + 7О2  2Fe2O3 + 4SO2
2Fe2O3 + 4SO2
Ba(OH)2 + SO2 = BaSO3 + H2O
6. 4FeCl3 + 6H2O 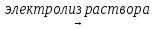 2Fe + 3H2 + 2Fe(OH)3 + 6Cl2
2Fe + 3H2 + 2Fe(OH)3 + 6Cl2
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe + 6HNO3(конц.)  Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O
Сl2 + 2KOH(холодный) = KClO + KCl + H2O
7. FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + Na2CO3  2NaFeO2 + CO2
2NaFeO2 + CO2
2NaFeO2 + 3NaNO3 + 2NaOH  2Na2FeO4 + 3NaNO2 + H2O
2Na2FeO4 + 3NaNO2 + H2O
8. 3FeO + 10HNO3(разб.)  3Fe(NO3)3 + NO + 5H2O
3Fe(NO3)3 + NO + 5H2O
2Fe(NO3)3 + Fe = 3Fe(NO3)2
Fe(NO3)2 + 2KOH = Fe(OH)2 + 2KNO3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
9. FeCl2 + 4HNO3(кнц.) = Fe(NO3)3 + NO2 + 2HCl + H2O
2Fe(NO3)3 + 3K2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 3Н2  2Fe + 3H2O
2Fe + 3H2O
10. 2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 3CO  2Fe + 3CO2
2Fe + 3CO2
2Fe + 3Br2 = 2FeBr3
11. Fe3O4 + 10HNO3(конц.) = 3Fe(NO3)3 + NO2 + 5H2O
2Fe(NO3)3 + Fe = 3Fe(NO3)2
Fe(NO3)2 + 2KOH = Fe(OH)2 + 2KNO3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
12. 2FeCl3 + Fe = 3FeCl2
FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
2Fe(OH)2 + H2O2 = 2Fe(OH)3↓
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
13. FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
FeSO4 + Zn = ZnSO4 + Fe
Fe + 2HCl = FeCl2 + H2
14. Fe + H2SO4(разб.) = FeSO4 + H2
4FeSO4 + O2 + 2H2SO4 = 2Fe2(SO4)3 + 2H2O
Fe2(SO4)3 + 2H2S = FeSO4 + 2S + FeS + 2H2SO4
FeS + 12HNO3(конц.) = Fe(NO3)3 + 9NO2 + H2SO4 + 5H2O
15. FeS + 2HCl = FeCl2 + H2S↑
FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
4FeS + 7O2 = 2Fe2O3 + 4SO2
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
16. 2Fe + 6H2SO4(конц.)  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 6HCl  2FeCl3 + 3H2O
2FeCl3 + 3H2O
17. Fe3O4 + 4H2  3Fe + 4H2O
3Fe + 4H2O
2Fe + 6H2SO4(конц.)  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + BaCl2 = FeCl3 + BaSO4↓
2FeCl3 + Cu = 2FeCl2 + CuCl2
18. 4FeCl3 + 6H2O 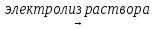 2Fe + 3H2 + 2Fe(OH)3 + 6Cl2
2Fe + 3H2 + 2Fe(OH)3 + 6Cl2
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6]
2Na3[Fe(OH)6] + 6H2SO4 = Fe2(SO4)3 + 3Na2SO4 + 12H2O
3Cl2 + 6KOH(гор.) = KClO3 + 5KCl + 3H2O
19. 2Fe + 3Cl2 = 2FeCl3
2FeCl3 + Fe = 3FeCl2
FeCl2 + Na2S = FeS↓ + 2NaCl
FeS + H2SO4 = FeSO4 + H2S↑
20. SO2 + 2H2S = 3S↓ + 2H2O
Fe + S  FeS
FeS
4FeS + 7O2  2Fe2O3 + 4SO2
2Fe2O3 + 4SO2
Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
21. Fe2O3 + Na2CO3  2NaFeO2 + CO2
2NaFeO2 + CO2
NaFeO2 + 2H2O = Fe(OH)3 + NaOH
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
22. 3Cl2 + 6KOH (гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6 HCl = KCl + 3Cl2 + 3H2O
2Fe + 3Cl2 = 2FeCl3
2FeCl3 + Fe = 3FeCl2
23. 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
SO2 + 2H2S = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
24. Fe + H2SO4 = FeSO4 + H2
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3↓
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
25. 2NaCl + 2H2O 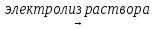 H2 + 2NaOH + Cl2
H2 + 2NaOH + Cl2
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 6HI(конц.) = 2FeI2 + I2 + 3H2O
26. 2KClO3  2KCl + 3O2
2KCl + 3O2
3Fe + 2O2 = Fe3O4
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
6FeCl2 + Na2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2NaCl + 7H2O
27. 2Fe + 3Cl2 = 2FeCl3
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2 ↑ + 6NaCl
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
28. Fe + S  FeS
FeS
FeS + 2HCl = FeCl2 + H2S↑
2H2S + 3O2 = 2SO2 + 2H2O
Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4
29. C + O2  2CO
2CO
Fe2O3 + 3CO  2Fe + 3CO2
2Fe + 3CO2
2Fe + 6H2SO4  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3K2S = 2FeS + S + 3K2SO4
30. 2Fe + 3Cl2 = 2FeCl3
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
31. Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO↑ + 2H2O
( в качестве продукта восстановления HNO3 принимается также N2O и N2)
2Fe(NO3)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 6NaNO3 + 3CO2
2HNO3 + Na2CO3 = 2NaNO3 + CO2 + H2O
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
32. Fe + S  FeS
FeS
FeS + 2HCl = FeCl2 + H2S↑
FeCl2 + 2KOH = Fe(OH)2↓ + 2KCl
Fe(OH)2  FeO + H2O
FeO + H2O
33. 2Fe + 3Cl2 = 2FeCl3
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O
H2 + I2 = 2HI
34. Fe + 2HCl = FeCl2 + H2↑
FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3↓
Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
35. Fe2(SO4)3 + 3Ba(NO3)2 = 3BaSO4↓ + 2Fe(NO3)3
Fe(NO3)3 + 3NaOH = Fe(OH)3↓ + 3NaNO3
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Fe2O3 + 6HCl  2FeCl3 + 3H2O
2FeCl3 + 3H2O
Цинк. Соединения цинка.
i.
Цинк.
Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует с простыми веществами (исключением является азот):
2Zn + О2  2ZnО
2ZnО
Zn + Сl2  ZnCl2
ZnCl2
3Zn + 2Р  Zn3Р2
Zn3Р2
Zn + S  ZnS
ZnS
а также с оксидами неметаллов и аммиаком:
3Zn + SO2  2ZnO + ZnS
2ZnO + ZnS
Zn + CO2  ZnO + CO
ZnO + CO
3Zn + 2NH3  Zn3N2 + 3H2
Zn3N2 + 3H2
При нагревании цинк окисляется под действием водяных паров:
Zn + H2O (пар)  ZnO + H2
ZnO + H2
Цинк реагирует с растворами кислот серной и соляной кислот, вытесняя из них водород:
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
Как активный металл цинк реагирует с кислотами-окислителями:
Zn + 2H2SO4(конц.) = ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S + 4H2O
Zn + 4HNO3(конц.)→ Zn(NO4)2 + 2NO2 + 2H2O
4Zn + 10HNO3(оч. разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
При сплавлении цинка с щелочами образуется цинкат:
Zn + 2NаОН(крист.)  Nа2ZnО2 + Н2
Nа2ZnО2 + Н2
Цинк хорошо растворяется в растворах щелочей:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + 4NH3 + 2H2O = [Zn(NH3)4](OH)2 + H2
Цинк восстанавливает многие металлы из растворов их солей:
CuSO4 + Zn = Zn SO4 + Cu
Pb(NO3)2 + Zn = Zn(NO3)2 + Pb
4Zn + KNO3 + 7KOH = NН3 + 4K2ZnO2 + 2H2O
4Zn + 7NaOH + 6H2O + NaNO3 = 4Na2[Zn(OH)4] + NH3
3Zn + Na2SO3 + 8HCl = 3ZnCl2 + H2S + 2NaCl + 3H2O
Zn + NaNO3 + 2HCl = ZnCl2 + NaNO2 + H2O
ii.
Соединения цинка (соединения цинка ядовиты).
1.
Оксид цинка.
Оксид цинка обладает амфотерными свойствами.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH  Na2ZnO2 + H2O
Na2ZnO2 + H2O
ZnO + Na2O  Na2ZnO2
Na2ZnO2
ZnO + SiO2  ZnSiO3
ZnSiO3
ZnO + BaCO3  BaZnO2 + СО2
BaZnO2 + СО2
Цинк восстанавливают из оксидов действием сильных восстановителей:
ZnO + С(кокс)  Zn + СО
Zn + СО
ZnO + СО  Zn + СО2
Zn + СО2
2.
Гидроксид цинка.
Гидроксид цинка обладает амфотерными свойствами.
Zn(OН)2 + 2HCl = ZnCl2 + 2H2O
Zn(OН)2 + 2NaOH  Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O
Zn(OН)2 + 2NaOH = Na2[Zn(OH)4]
2Zn(OН)2 + СО2 = (ZnOH)2СО3 + H2O
Zn(OН)2 + 4(NH3· H2O) = [Zn(NH3)4](OH)2
Гидроксид цинка термически неустойчив:
Zn(OН)2  ZnO + H2O
ZnO + H2O
3.
Соли.
СaZnO2 + 4HCl (избыток) = CaCl2 + ZnCl2 + 2H2O
Na2ZnO2 + 2H2O = Zn(OH)2 + 2NaHCO3
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2NaHCO3
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
2ZnSO4  2ZnO + 2SO2 + O2
2ZnO + 2SO2 + O2
2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
Zn(NO3)2 + Mg = Zn + Mg(NO3)2
ZnS + 4H2SO4(конц.) = ZnSO4 + 4SO2 + 4H2O
ZnS + 8HNO3(конц.) = ZnSO4 + 8NO2 + 4H2O
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Цинк. Соединения цинка.
1. Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щелочи, при этом осадок полностью растворился. нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
2. Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щелочи, получив прозрачный раствор. Напишите уравнения описанных реакций.
3. Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при температуре 800°С. Твердый продукт реакции обработали концентрированным раствором щелочи, и через полученный раствор пропустили углекислый газ. Напишите уравнения описанных реакций.
4. Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился. Напишите уравнения описанных реакций.
5. Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели. Напишите уравнения описанных реакций.
6. Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили. Напишите уравнения описанных реакций.
7. В концентрированную серную кислоту добавили металлический цинк. образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
8. Сульфид цинка подвергли обжигу. Полученное твердое вещество полностью прореагировало с раствором гидроксида калия. Через полученный раствор пропустили углекислый газ до выпадения осадка. Осадок растворили в соляной кислоте. Напишите уравнения описанных реакций.
9. Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения описанных реакций.
10. Цинк растворили в растворе гидроксида калия. Выделившийся газ прореагировал с литием, а к полученному раствору по каплям добавили соляную кислоту до прекращения выпадения осадка. Его отфильтровали и прокалили. Напишите уравнения описанных реакций.
1) ZnO + 2HCl = ZnCl2 + H2O
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2HNO3(недостаток) = Zn(OH)2↓ + 2NaNO3 + 2H2O
2) 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
HNO3 + NaOH = NaNO3 + H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
3) ZnO + H2SO4 = ZnSO4 + H2O
2ZnSO4  2ZnO + 2SO2 + O2
2ZnO + 2SO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
4) 2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
Zn(OH)2 + 4(NH3 · H2O) = [Zn(NH3)4](OH)2 + 4H2O
5) 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
NH4NO3  N2O + 2H2O
N2O + 2H2O
ZnO + C  Zn + CO
Zn + CO
6) Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Na2[Zn(OH)4] + 2HNO3 = Zn(OH)2↓ + 2NaNO3 + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
7) 4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
ZnSO4 + Ba(NO3)2 = Zn(NO3)2 + BaSO4
Zn(NO3)2 + Mg = Zn + Mg(NO3)2
2Mg(NO3)2  2Mg(NO2)2 + O2↑
2Mg(NO2)2 + O2↑
8) 2ZnS + 3O2 = 2ZnO + 2SO2↑
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + CO2 = Zn(OH)2 + Na2CO3 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
9) ZnS + 2HCl = ZnCl2 + H2S↑
2ZnS + 3O2 = 2ZnO + 2SO2↑
2H2S + SO2 = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
10) Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
H2 + 2Li = 2LiH
K2[Zn(OH)4] + 2HCl = 2KCl + Zn(OH)2↓
Zn(OH)2  ZnO + H2O
ZnO + H2O
Медь и соединения меди.
i.
Mедь.
Медь – химически малоактивный металл, в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II).
2Cu + H2O + CO2 = (CuOH)2CO3
При нагревании медь реагирует с достаточно сильными окислителями,
с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 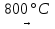 2Cu2О 2Cu + О2
2Cu2О 2Cu + О2 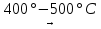 2CuО
2CuО
С галогенами , серой:
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Cu + S 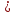 CuS
CuS
Медь растворяется в кислотах-окислителях:
при нагревании в концентрированной серной кислоте:
Cu + 2H2SO4(конц.)  CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
без нагревания в азотной кислоте:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб..) = 3Cu(NO3)2 + 2NO2 + 4H2O
3Cu + 2HNO3 + 6HCl = 3CuCl2 + 2NO + 4H2O
Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|