
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 7 страница
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
25) 2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O  2Cu + O2 + 2H2SO4
2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
26) H2C2O4 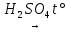 CO↑ + CO2↑ + H2O
CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2  2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
CuO + CO  Cu + CO2
Cu + CO2
27) Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl 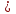 CuCl2 + 2H2O
CuCl2 + 2H2O
Марганец. Соединения марганца.
i.
Mарганец.
На воздухе марганец покрывается оксидной пленкой, предохраняющей его даже при нагревании от дальнейшего окисления, но в мелкораздробленном состоянии (порошок) он окисляется довольно легко. Марганец взаимодействует с серой, галогенами, азотом, фосфором, углеродом, кремнием, бором, образуя соединения со степенью +2:
Mn + S = MnS
3Mn + 2P = Mn3P2
3Mn + N2 = Mn3N2
Mn + Cl2 = MnCl2
2Mn + Si = Mn2Si
При взаимодействии с кислородом марганец образует оксид марганца (IV):
Mn + O2 = MnO2
4Mn + 3O2 = 2Mn2O3
2Mn + O2 = 2MnO
При нагревании марганец взаимодействует с водой:
Mn + 2H2O (пар)  Mn(OH)2 + H2
Mn(OH)2 + H2
В электрохимическом ряду напряжений марганец находится до водорода, поэтому легко растворяется в кислотах, образуя соли марганца (II):
Mn + H2SO4 = MnSO4 + H2
Mn + 2HCl = MnCl2 + H2
С концентрированной серной кислотой марганец реагирует при нагревании:
Mn + 2H2SO4(конц.)  MnSO4 + SO2 + 2H2O
MnSO4 + SO2 + 2H2O
С азотной кислотой при обычных условиях:
Mn + 4HNO3 (конц.) = Mn(NO3)2 + 2NO2 + 2H2O
3Mn + 8HNO3 (разб..) = 3Mn(NO3)2 + 2NO + 4H2O
Растворы щелочей на марганец практически не действуют, но он реагирует с щелочными расплавами окислителей, образуя манганаты (VI)
Mn + KClO3 + 2KOH  K2MnO4 + KCl + H2O
K2MnO4 + KCl + H2O
Марганец может восстанавливать оксиды многих металлов.
3Mn + Fe2O3 = 3MnO + 2Fe
5Mn + Nb2O5 = 5MnO + 2Nb
ii.
Соединения марганца (II, IV, VII)
1.
Оксиды.
Марганец образует ряд оксидов, кислотно-основные свойства которых зависят от степени окисления марганца.
Mn 2O Mn+4O2 Mn2+7O7
основный амфотерный кислотный
Оксид марганца (II)
Оксид марганца (II) получают восстановлением других оксидов марганца водородом или оксидом углерода (II):
MnO2 + Н2  MnO + H2O
MnO + H2O
MnO2 + CO  MnO + CO2
MnO + CO2
Основные свойства оксида марганца (II) проявляются в их взаимодействии с кислотами и кислотными оксидами:
MnO + 2HCl = MnCl2 + H2O
MnO + SiO2 = MnSiO3
MnO + N2O5 = Mn(NO3)2
MnO + Н2 = Mn + H2O
3MnO + 2Al = 2Mn + Al2O3
2MnO + O2 = 2MnO2
3MnO + 2KClO3 + 6KOH = 3K2MnO4 + 2KCl + 3H2O
Оксид марганца (IV)
В лаборатории оксид марганца (IV) можно получить термическим разложением соей, окислением низших или восстановлением высших соединений марганца:
Mn(NO3)2  MnO2 + 2NO2
MnO2 + 2NO2
Mn(NO3)2 + PbO2  MnO2 + Pb(NO3)2
MnO2 + Pb(NO3)2
2KMnO4 + 8MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
Оксид марганца (IV) проявляет амфотерные свойства.
При растворении MnO2 в соляной кислоте образуется хлорид марганца (II) и выделяется хлор:
4HCl + MnO2 = MnCl2 + 2H2O + Cl2↑
При нагревании в концентрированной серной кислоте MnO2 образует сульфат марганца (II) с выделением кислорода:
2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O
Кислотные свойства MnO2 проявляются при сплавлении с щелочами без доступа воздуха:
MnO2 + 2KOH  K2MnO4 + 2H2O
K2MnO4 + 2H2O
Оксид марганца (IV) в зависимости от условий реакции и веществ, с которыми он взаимодействует, проявляет либо окислительные, либо восстановительные свойства:
3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2
NaClO3 + 3MnO2 + 6NaOH = 3Na2MnO4 + NaCl + 3H2O
MnO2 + H2SO4 + H2O2 = MnSO4 + O2 + 2H2O
MnO2 + H2SO4 + KNO2 = MnSO4 + KNO3 + H2O
MnO2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + MnSO4 + 2H2O
MnO2 + SO2 = MnSO4
MnO2 + 2Fe(NO3)2 + 4HNO3 = Mn(NO3)2 + 2Fe(NO3)3 + 2H2O
Оксид марганца (VII)
Оксид марганца (VII) неустойчивое соединение, при слабом нагревании разлагается на оксид марганца (IV) и кислород:
2Mn2O7  4MnO2 + 3O2
4MnO2 + 3O2
Получить оксид марганца (VII) можно действием концентрированной серной кислоты на кристаллический перманганат калия:
2KMnO4 + H2SO4 = K2SO4 + Mn2O7 + H2O
Оксид марганца (VII) – кислотный оксид, который взаимодействует с основными оксидами и основаниями:
Mn2O7 + СaO = Ca(MnO4)2
Mn2O7 + 2KOH = 2KMnO4 + H2O
При взаимодействии с водой он образует марганцевую кислоту:
Mn2O7 + H2O = 2HMnO4
2.
Гидроксиды.
Марганец образует ряд гидроксидов, кислотно-основные свойства которых зависят от степени окисления марганца.
Mn+2(OН)2 Mn+4(OН)4 НMn+7O4
основный амфотерный кислотный
Гидроксид марганца (II)
Основные свойства гидроксида марганца (II) проявляются во взаимодействии с кислотами и кислотными оксидами:
Mn(OН)2 + 2HCl = MnCl2 + 2H2O
Mn(OH)2 + SO3 = MnSO4
Гидроксид марганца (II) на воздухе быстро темнеет, окисляясь в гидроксид марганца (IV):
2Mn(OH)2 + O2 + 2H2O → 2Mn(OH)4
Восстановительные свойства у соединений марганца (II) преобладают.
2Mn(OH)2 + 5KBrO + 2KOH = 2KMnO4 + 5KBr + 3H2O
Mn(OH)2 + H2O2 = MnO2 + 2H2O
Mn(OH)2 + Br2 = MnO2 + 2HBr
2Mn(OH)2 + Ca(ClO)2 = 2MnO2 + CaCl2 + 2H2O
Гидроксид марганца (VII) – марганцевая кислота (HMnO4).
HMnO4 устойчива лишь в растворах с концентрацией не более 20%. При больших концентрациях, она разлагается с выделением кислорода:
4HMnO4 = 4MnO2 + 2H2O + 3O2
Это сильная кислота, в водном растворе она практически полностью диссоциирована:
HMnO4 → H+ + MnO4─
Соединения марганца (VII) сильные окислители:
3PH3 + 8HMnO4 = 8MnO2 + 3H3PO4 + 4H2O
3H2S + 2HMnO4 = 2MnO2 + 3S + 4H2O
3.
Соли.
Соли марганца (II):
MnSO4 + H2O2 + 2NaOH = MnO2 + Na2SO4 + 2H2O
MnSO4 + NaClO + 2NaOH = MnO2 + NaCl + Na2SO4 + H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
Соли марганца (VII).
2KMnO4 → MnO2 + K2MnO4 + O2↑
2KMnO4 + H2SO4 = K2SO4 + H2O + Mn2O7
Перманганат калия – сильный окислитель. В зависимости от рН среды KMnO4 (точнее, ион MnO4─) может восстанавливаться до различной степени окисления.
H+ Mn2+ (бесцветный раствор)
KMnO4 (MnO4─) H2O MnO2 (бурый осадок)
OH─ MnO42─ (раствор зеленого цвета)
2KMnO4 + 5H2O2 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
10KI + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 10FeSO4 + 18H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 18H2O
KMnO4 + 5FeCl2 + 4H2SO4 = 3FeCl3 + MnSO4 + Fe2(SO4)3 + KCl + 4H2O
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2KMnO4 + 2NН3 = 2MnO2 + N2 + 2КОН + 2H2O
2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
2KMnO4 + 3KNO2 + H2O = 3KNO3 + 2MnO2 + 2KOH
2KMnO4 + 5Na2SO3 + 2KOH = 2K2MnO4 + 5Na2SO4 + H2O
3KMnO4 + Al + 4KOH = 3K2MnO4 + K[Al(OH)4]
Свойства соединений марганца (VI)
K2MnO4 + 2KI + H2O = MnO2 + I2 + 4KOH
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
3K2MnO4 + 4HСl = 2KMnO4 + MnO2 + 4KCl + 2H2O
Марганец. Соединения марганца.
1. Нитрат марганца (II) прокалили, к полученному твердому бурому веществу прилили концентрированную хлороводородную кислоту. Выделившийся газ пропустили через сероводородную кислоту. Образовавшийся раствор образует осадок с хлоридом бария. Напишите уравнения описанных реакций.
2. Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество – с раствором соляной кислоты. Напишите уравнения описанных реакций.
3. Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
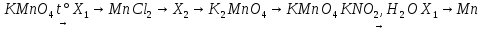
1
Mn(NO3)2 K2MnO4
4 2
3
MnCl2 Mn(OH)2 10
9
12 5 11
MnO2 KMnO4
8 6
Mn 7 MnSO4
X1 (CH3COO)2Mn
MnO2 X2
X3 MnBr2
K2MnO4 → MnCl2 → Mn(OH)2 → Mn(OH)4
KMnO4
MnO2 → MnSO4 → HMnO4
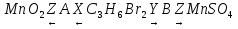
1) Mn(NO3)2  MnO2 + 2NO2
MnO2 + 2NO2
MnO2 + 4HCl = MnCl2 + Cl2 ↑ + 2H2O
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
H2SO4 + BaCl2 = BaSO4 + 2HCl
2) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
4MnO2 + 6H2SO4(конц.) = 2Mn2(SO4)3 + O2↑ + 6H2O
3O2 + 4Al = 2Al2O3
2Al2O3 + 6HCl = 2AlCl3 + 3H2O
3) 2P + 3PCl5 = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
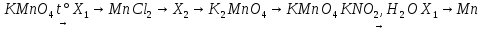
1) 2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
3) MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl
4) Mn(OH)2 + 4KMnO4 + 6KOH = 5K2MnO4 + 4H2O
5) 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
6) 2KMnO4 + 3KNO3 + H2O = 2MnO2 + 3KNO2 + 2KOH
7) 3MnO2 + 4Al  3Mn + 2Al2O3
3Mn + 2Al2O3
1
Mn(NO3)2 K2MnO4
4 2
3
MnCl2 Mn(OH)2 10
9
12 5 11
MnO2 KMnO4
8 6
Mn 7 MnSO4
1.
K2MnO4 + 4HNO2 = 2KNO2 + Mn(NO3)2 + 2H2O
2.
4KMnO4 + Mn(OH)2 + 6KOH = 5K2MnO4 + 4H2O
3.
MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
4.
MnCl2 + AgNO3 = Mn(NO3)2 + 2AgCl↓
5.
2KMnO4 + 3CH2 = CH2 + 4H2O → 3CH2(OH) − CH2(OH) + 2MnO2↓ + 2H2O
6.
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑ + 8H2O
7.
Mn + H2SO4((разб.) = MnSO4 + H2↑
8.
3MnO2 + 4Al  3Mn + 2Al2O3
3Mn + 2Al2O3
9.
2MnO2 + 4HNO2 = Mn(NO3)2 + Mn(NO2)2 + 2H2O
10.
2KMnO4 + H2O2 + 2KOH = 2K2MnO4 + O2↑ + 2H2O
11.
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4
12) 2MnCl2 + 2H2O  Mn + H2 + Mn(OH)2 + 2Cl2
Mn + H2 + Mn(OH)2 + 2Cl2
X1 (CH3COO)2Mn
MnO2 X2
X3 MnBr2
1.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
2.
MnCl2 + CH3COOAg = (CH3COO)2Mn + 2AgCl↓
3.
(CH3COO)2Mn + 2NaOH = Mn(OH)2↓ + 2CH3COONa
4.
Mn(OH)2 + 2HBr = MnBr2 + 2H2O
5.
MnBr2 + 2AgNO3 = Mn(NO3)2 + 2AgBr↓
6.
Mn(NO3)2  MnO2 + 2NO2
MnO2 + 2NO2
K2MnO4 → MnCl2 → Mn(OH)2 → Mn(OH)4
KMnO4
MnO2 → MnSO4 → HMnO4
1.
2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2.
K2MnO4 + 8HCl = MnCl2 + 2KCl + 2Cl2 + 4H2O
3.
MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
4.
2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4
5.
MnO2 + SO2 = MnSO4
6.
2MnSO4 + 8HNO3 + 5PbO = 2HMnO4 + 4Pb(NO3)2 + 2H2O + Pb(HSO4)2
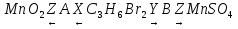
1.
CH2Br – СHBr − CH3 + Mg → MgBr2 + CH2=CH−CH3
2.
3CH2=CH−CH3 + 2KMnO4 + 4H2O → 3CH2OH – CHOH − CH3 + 2KOH + 2MnO2
3.
CH2Br – СHBr − CH3 + 2KOH(спиртовой) → CH ≡ C – CH3 + 2KBr + 2H2O
4.
5CH ≡ C – CH3 + 8KMnO4 + 12H2SO4 → 5CO2 + 5CH3COOH + 8MnSO4 + 4K2SO4 + + 12H2O
Хром. Соединения хрома.
i.
Хром.
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором:
4Cr + 3O2 = 2Cr2O3
2Cr + 3Br2 = 2CrBr3
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
2Cr + N2 = 2CrN
В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O (пар) = Cr2O3 + 3H2
В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов соляной и разбавленной серной кислоты, образуя соли хрома (II):
Cr + 2HCl = CrCl2 + H2
Cr + H2SO4 (разб.) = CrSO4 + H2
В присутствии кислорода – соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
Хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей:
Cr + CuSO4 = CrSO4 + Cu
Концентрированные серная и азотная кислоты на холоду
пассивируютхром, однако при сильном нагревании они растворяют хром с образованием солей хрома (III):
2Cr + 6H2SO4  Cr2(SO4)3 + 3SO2 + 6H2O
Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3  Cr(NO3)3 + 3NO2 + 3H2O
Cr(NO3)3 + 3NO2 + 3H2O
Растворы щелочей на хром практически не действуют. Но хром реагирует с щелочными расплавами окислителей. В качестве окислителей используют нитраты калия и натрия, хлорат калия и другие окислители.
Cr + KClO3 + 2KOH  K2CrO4 + KCl + H2O
K2CrO4 + KCl + H2O
2Cr + KClO3 = Cr2O3 + KCl
2Cr + 3KNO3 = Cr2O3 + 3KNO2
ii.
Соединения хрома.
Соединения хрома (II).
1.
Оксид, гидроксид, соли.
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
При высоких температурах оксид хрома (II) диспропорционирует:
3CrO 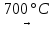 Cr + Cr2O3
Cr + Cr2O3
Все соединения хрома (II) – сильные восстановители, уже кислородом воздуха окисляются до соединений хрома (III):
4CrO + O2 = 2Cr2O3
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
4CrCl2 + O2 + 20KOH + 2H2O = 4K3[Cr(OH)6] + 8KCl
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl2 + 4H2SO4(конц) = Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
Оксид и гидроксид хрома (II) растворяются в кислотах:
CrO + 2HCl = CrCl2 + H2O
CrO + H2SO4 = CrSO4 + H2O
Cr(OН)2 + 2HCl = CrCl2 + 2H2O
Соединения хрома (III).
1.
Оксид хрома (III).
Оксид хрома можно получить:
Термическим разложением дихромата аммония:
(NH4)2C2O7  Cr2O3 + N2 + 4H2O
Cr2O3 + N2 + 4H2O
Восстановлением дихромата калия углеродом (коксом) или серой:
2K2Cr2O7 + 3C  2Cr2O3 + 2K2CO3 + CO2
2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S  Cr2O3 + K2SO4
Cr2O3 + K2SO4
Оксид хрома (III) обладает амфотерными свойствами.
C кислотами оксид хрома (III) образует соли:
Cr2O3 + 6HCl = 2CrCl3 + 3H2O
При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хроматы (III), (хромиты):
Сr2O3 + Ba(OH)2  Ba(CrO2)2 + H2O
Ba(CrO2)2 + H2O
Сr2O3 + Na2CO3  2NaCrO2 + CO2
2NaCrO2 + CO2
C щелочными расплавами окислителей – хроматы (VI) (хроматы)
Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
Cr2O3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 5H2O
Сr2O3 + O3 + 4KOH = 2K2CrO4 + 2H2O
Cr2O3 + 3O2 + 4Na2CO3 = 2Na2CrO4 + 4CO2
Сr2O3 + 3NaNO3 + 2Na2CO3  2Na2CrO4 + 2CO2 + 3NaNO2
2Na2CrO4 + 2CO2 + 3NaNO2
Cr2O3 + KClO3 + 2Na2CO3 = 2Na2CrO4 + KCl + 2CO2
2.
Гидроксид хрома (III)
Гидроксид хрома (III) обладает амфотерными свойствами.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
2Cr(OH)3 = Cr2O3 + 3H2O
2Cr(OH)3 + 3Br2 + 10KOH = 2K2CrO4 + 6KBr + 8H2O
3.
Соли хрома (III)
2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O
2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 3Br2 + 16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O.
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O
2K3[Cr(OH)6] + 3Br2 + 4KOH = 2K2CrO4 + 6KBr + 8H2O
2KCrO2 + 3PbO2 + 8KOH = 2K2CrO4 + 3K2PbO2 + 4H2O
Cr2S3 + 30HNO3(конц.) = 2Cr(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
2CrCl3 + Zn = 2CrCl2 + ZnCl2
Хроматы (III) легко реагируют с кислотами:
NaCrO2 + HCl (недостаток) + H2O = Cr(OH)3 + NaCl
NaCrO2 + 4HCl (избыток) = CrCl3 + NaCl + 2H2O
K3[Cr(OH)6] + 3CO2 = Cr(OH)3↓ + 3NaHCO3
В растворе подвергаются полному гидролизу
NaCrO2 + 2H2O = Cr(OH)3↓ + NaОН
Большинство солей хрома хорошо растворимы в воде, но легко подвергаются гидролизу:
Сr3+ + HOH ↔ CrOH2+ + H+
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|