
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Таблица 1.2
А = ε bc
При описании спектра обычно приводят только положения максимумов поглощения, а также соответствующие значения e.
Пример:
lмаксгексан = 235 нм (e 5400). Указывают и растворитель, поскольку он может влиять и на l, и на e.
1. 3 Способы изображения электронных спектров
Электронные спектры поглощения записываются в виде зависимости поглощения от длины волны (ангстрем, нанометр) или частоты (см-1). Величина поглощения может быть выражена процентом поглощения [(I0 − I)/ I0 х 100% ], процентом пропускания [(I/I0) х 100%], оптической плотностью А (А = lg I0/I), коэффициентом молярного поглощения (ε ) или его логарифмом (lgε ). Вид спектра поглощения зависит от выбора координат (рис. 1. 2. )
. 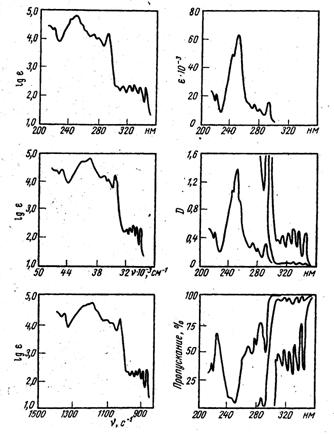
Рис. 1. 2. Электронный спектр поглощения фенантрена в различных координатах.
Приведем несколько важных замечаний относительно условий получения рабочей спектральной кривой А = f(λ ). Выше было отмечено, что электронные спектры могут быть получены для любого агрегатного состояния вещества. Тем не менее, для решения обычной структурной задачи средствами электронной спектроскопии обычно используют технику съемки растворов веществ. Для спектрофотометрического анализа в УФ-области пригодны многие растворители, в том числе вода, спирты, хлороформ, низшие углеводороды, эфиры, разбавленные растворы аммиака, едкого натра, хлористоводородной или серной кислоты. Следует использовать растворители, не содержащие примесей, поглощающих в данной спектральной области; для спектрофотометрии выпускаются специальные растворители, гарантирующие отсутствие примесей. Ниже в таблице 1. 2 приведены области поглощения органических растворителей, наиболее часто используемых в УФ-спектроскопии.
Таблица 1. 2
Области поглощения растворителей, наиболее часто используемых в УФ-спектроскопии
| Растворитель | Область поглощения, нм |
| ацетонитрил | |
| вода | |
| циклогексан | |
| гексан | |
| метанол | |
| этанол | |
| диэтиловый эфир | |
| хлористый метилен | |
| хлороформ | |
| четыреххлористый углерод |
Так, для соединения с молекулярным весом ~100, имеющим ε ~ 10000, условию А = 0. 5 (при b = 1 см) соответствует концентрация раствора порядка 0. 005 г/л. Учитывая, что для исследования используются кюветы, объем которых, как правило, не превышает 5мл, получаем для навески вещества такого объема раствора величину порядка 0. 025 мг. Поэтому обычно предварительно готовят раствор, концентрация которого в 10 − 100 раз превышает необходимую концентрацию. Затем, используя пипетки и мерные колбы, проводят разбавление до требуемой концентрации. Следует помнить, что:
Сведения о концентрации раствора и толщины кюветы всегда должны сопровождать выдаваемый прибором спектр А = f(λ ).
1. 4 Взаимосвязь электронных спектров и структуры органических молекул. Хромофоры и ауксохромы
Простая функциональная группа, ответственная за поглощение с характеристическими величинами e и l, называется хромофором.
Обычно предполагают, что спектры веществ сходны, если их молекулы содержат одинаковые хромофоры. Если молекула содержит два хромофора, разделенных более чем одной простой связью, спектр соединения представляет собой сумму спектральных характеристик индивидуальных хромофоров. Если, однако, два хромофора разделены только одной простой связью (т. е., хромофоры находятся в сопряжении), спектр соединения уже не будет суммой спектров индивидуальных хромофоров. В этом случае две простые группы образуют новый, хромофор с новыми спектральными характеристиками.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|