
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Таблица 1.1
Предисловие
Уважаемый читатель, Вы держите в руках учебное пособие, предназначенное для тех, кто уже сделал первый шаг в области органического синтеза и ощутил важность не только умения получить нужное вещество с высоким выходом, но и однозначно доказать его структуру, определить чистоту и количественное содержание.
Для решения этих задач наиболее значимыми являются методы УФ-, ИК-, ЯМР-спектроскопии и масс-спектрометрии. В настоящее время наблюдаются серьезные качественные изменения в этих областях: быстрыми темпами происходит обновление приборов и внедрение в практику новых методик проведения анализов. Это в свою очередь требует обновление соответствующих учебных материалов.
Недавно издательством БИНОМ было выпущено несколько замечательных изданий: А. Т. Лебедев Масс-спектрометиря в органической химии, 2003 г., Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений (таблицы спектральных данных), 2006 г. и Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрометрическая идентификация органических соединений, 2011 г. Эти книги, безусловно, должны быть на полке у тех, кто решил серьезно заняться проблемой синтеза и доказательства структуры органических веществ.
Предлагаемое учебное пособие задумывалось не как альтернатива, а как проводник, помощник для освоения указанных учебных пособий. Прежде всего, мы попытались сконцентрировать Ваше внимание на проблемах интерпретации полученных экспериментальных данных, хотя там, где это было крайне необходимо, кратко затрагивался вопрос теоретических основ методов и их аппаратурного оформления.
Пособие состоит из двух частей. В первой − освещены методы УФ- и ИК-спектроскопии, во второй части − спектроскопия ЯМР на ядрах 1Н, 13С и масс-спектрометрия. Такое разделение обусловлено лишь удобством использования учебного пособия в работе. В начале каждой главы кратко изложена суть метода, даны основные определения. Теоретическая часть иллюстрирована экспериментальными данными, заимствованными из указанных выше учебных пособий, спектральных баз данных, открытых для свободного доступа и данных, полученных в ходе собственных исследований авторов.
Древние говорили: «Уча, мы сами учимся», а потому с благодарностью будут приняты все замечания и пожелания читателей. Надеемся, мы не зря потратили свое время.
С уважением, авторы
| СОДЕРЖАНИЕ: | стр. | |
| Введение. | ||
| Глава 1. Электронная, или УФ-спектроскопия | ||
| 1. 1. Возбуждение и релаксация | ||
| 1. 2. Закон Бера-Бугера-Ламберта | ||
| 1. 3. Способы изображения электронных спектров | ||
| 1. 4. Взаимосвязь электронных спектров и структуры органических молекул. Хромофоры и ауксохромы | ||
| 1. 5. Применение УФ-спектроскопии для количественно определения органических веществ. | ||
| Вопросы и задания для самоконтроля. | ||
| Глава 2. Инфракрасная спектроскопия | ||
| 2. 1. Основные принципы метода ИК-спектроскопии | ||
| 2. 2. Подготовка образцов для снятия ИК-спектров | ||
| 2. 3. Важнейшие характеристические полосы поглощения в области основных частот колебаний органических молекул | ||
| Алкильные группы | ||
| Этенильные группы | ||
| Ацетиленовые группы | ||
| Фенильная группа | ||
| Гидроксильная группа | ||
| Простая эфирная группа | ||
| Карбонильная группа | ||
| Карбоксильная группа | ||
| Карбоксилат-анион | ||
| Сложноэфирная группа | ||
| Галоиодангидридная группа | ||
| Ангидридная группа | ||
| Амидная группа | ||
| Аминогруппа | ||
| Нитрильная группа | ||
| Азо-группа | ||
| Нитрогруппа | ||
| Сульфанильная групппа | ||
| Функциональные группы, содержащие связь S=O | ||
| Функциональная группа, содержащая связь С-Hal | ||
| Вопросы и задания для самоконтроля | ||
| Список литературы | ||
Введение
Синтез органического вещества заданной структуры – основная задача химиков-синтетиков. Однако не менее важным является доказательство структуры и определение количества синтезированного продукта. Для этих целей наиболее часто используют следующие инструментальные методы: электронная, или ультрафиолетовая (УФ) спектроскопия, инфракрасная (ИК) спектроскопия, спектроскопия ядерного магнитного резонанса (ЯМР-спектроскопия) и масс-спектрометрия. Эти методы можно использовать по отдельности, хотя чаще они используются в комплексе, дополняя друг друга.
По объективным причинам данное пособие не претендует на детальное рассмотрение указанных методов, но вместе с тем отражает их основные положения, а также включает некоторые специфические вопросы, не рассмотренные в традиционных пособиях по физико-химическим методам анализа органических веществ. Для детального ознакомления с методами ИК-, ЯМР-спектроскопией, масс-спектрометрией мы рекомендуем литературу, указанную в конце пособия.
Среди многообразных физических методов, которые применяются при исследовании строения органических молекул, наибольший интерес представляет взаимодействие вещества с электромагнитным излучением в широком интервале частот, начиная с радиоволн и заканчивая γ -лучами, т. е. по всему электромагнитному спектру. При этом происходит изменение энергии молекул:
Δ Е = Ек − Ен
где Δ Е − изменение энергии системы;
Ек и Ен − энергия системы в конечном и начальном состояниях.
Если энергия конечного состояния выше энергии начального состояния (Ек > Ен), т. е. Δ Е положительно, то это соответствует поглощению излучения и, наоборот, при отрицательном значении Δ Е (т. е. Ек < Ен) происходит излучение энергии. В первом случае мы имеем дело со спектрами поглощения, во втором − с эмиссионными спектрами.
Электромагнитный спектр состоит из нескольких различных «типов» излучения, которые различаются по своим длинам волн (расстояниям между двумя соседними гребнями волны) и по своим частотам (числу волн, проходящих через данную точку в единицу времени).
Скорость распространения электромагнитных волн является константой и обычно обозначается как ( с). Численное значение этой константы, т. е. скорость света в вакууме, составляет 3∙ 1010 см/с. Хотя скорость света постоянна, его частота и длина волны могут быть переменными. Если частота выражена как число «колебаний» в секунду, или в герцах, то справедливо следующее соотношение между скоростью света, его частотой и длиной волны:
с = λ ν
где с − скорость света (3 х 1010 см/с),
λ − длина волны [см],
ν − частота (в циклах за секунду [с-1], или в герцах [Гц]).
Из этого уравнения следует, что существует обратно пропорциональная зависимость между частотой и длиной волны:
С увеличением частоты излучения длина волны уменьшается.
Данной частоте электромагнитного излучения отвечает энергия, определяемая следующим уравнением:
Е = h ν
где, h − постоянная Планка, (9. 534∙ 10-14 ккал·с/моль),
ν − частота [Гц].
Отсюда следует, что энергия электромагнитного излучения находится в прямой зависимости от его частоты.
С увеличением частоты излучения возрастает его энергия.
С увеличением длины волны излучения его энергия падает.
Излучения, соответствующие различным областям электромагнитного спектра, характеризуются разными длинами волн (и частотами). Поэтому эти излучения должны иметь разные энергии. Приведем некоторые обозначения и единицы, используемые для описания электромагнитного излучения.
Длина волны (λ ):
Ǻ (ангстрем); 1 Ǻ = 10-10м
мкм (микрометр) (прежнее название − микрон) 1 мкм = 10-6 м = 104 Ǻ
нм (нанометр) (прежнее название миллимикрон) 1нм = 10-9м = 10Ǻ.
Частота (ν ):
Гц (герц) (прежнее название − циклы за секунду)
см-1 (волновое число; равно величине, обратной длине волны, измеренной в сантиметрах, т. е., числу волн, укладывающихся в 1 см).
Энергии переходов между двумя энергетическими уровнями измеряют в электроновольтах (эв), калориях (кал) или Джоулях (Дж). В таблице 1. 1. показаны основные области электромагнитного спектра и процессы, происходящие с органическим веществом при поглощении или излучении радиации.
Таблица 1. 1
Электромагнитный спектр [6]
| Излучение | λ, см | Е, эв | Процессы, происходящие при поглощении или излучении |
| γ -Лучи | 10-11 − 10-8 | ~ 107 | Изменения в энергетичес-ком состоянии ядер (спект-роскопия γ -резонанса) |
| Рентгеновские лучи | 10-8 − 10-6 | ~ 105 | Изменения в энергетичес-ком состоянии внутренних электронов атомов (рентгеновская спектроскопия) |
| Ультрафиолетовое и видимое | 10-6 − 10-4 | ~ 10 | Изменение энергетического состояния внешних элект-ронов (электронная спектроскопия) |
| Инфракрасное | 10-4 − 10-2 | ~ 10-1 | Колебание атомов в молекуле (ИК-спектроскопия) |
| Микроволновое | 10-1 − 10 | ~ 10-3 | Колебание атомов в кристаллической решетке; изменение вращательного энергетического состояния |
| Радиоволны | > 10 | ~ 10-6 | Изменение энергетического состояния спинов ядер и электронов (спектроскопия ЯМР и ЭПР) |
Глава 1. Электронная, или УФ-спектроскопия
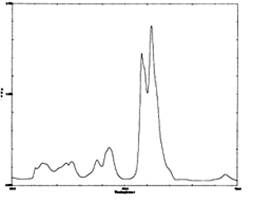 Электронные спектры поглощения наблюдаются в результате поглощения веществом ультрафиолетового и видимого излучения; при этом происходит переход (возбуждение) валентных электронов на более высокие энергетические уровни. По типу поглощаемого излучения электронную спектроскопию часто называют спектроскопией в ультрафиолетовой и видимой области, или УФ-спектроскопией.
Электронные спектры поглощения наблюдаются в результате поглощения веществом ультрафиолетового и видимого излучения; при этом происходит переход (возбуждение) валентных электронов на более высокие энергетические уровни. По типу поглощаемого излучения электронную спектроскопию часто называют спектроскопией в ультрафиолетовой и видимой области, или УФ-спектроскопией.
Из всего спектра электромагнитного излучения глаз человека способен воспринимать лишь его небольшую «видимую» часть с длинами волн от 400 до 800 нм. Ультрафиолетовая область спектра простирается от 1 до 400 нм, однако, поскольку компоненты земной атмосферы поглощают излучение с длиной волны ниже 200 нм, под термином «ультрафиолетовые лучи» обычно понимают излучение с длиной волны 200-400 нм (более правильное название « ближняя ультрафиолетовая област ь»).
Для изучения области спектра от 1 до 200 нм необходимо использовать вакуумные устройства («область вакуумного ультрафиолетового излучения», « дальняя ультрафиолетовая область »).
Термины «ближняя и дальняя области» характеризуют положение по отношению к видимой области электромагнитного спектра. Солнечная радиация состоит в основном из опасного для жизни «вакуумного ультрафиолетового излучения», поэтому поглощение атмосферой излучения с длиной волны ниже 200 нм сохраняет жизнь на поверхности Земли.
1. 1 Возбуждение и релаксация
При поглощении энергии в ультрафиолетовой области электромагнитного спектра электроны связывающих s- или p-орбиталей, а также несвязывающих орбиталей (n-электроны) могут перейти на различные разрыхляющие орбитали.
Таковы переходы n®p*, p®p*, и n®s*, где первая буква означает основное состояние, а вторая – возбужденное.
Для перехода s®s* требуется больше энергии, чем для указанных выше, и такой переход можно наблюдать лишь в коротковолновой области вакуумного ультрафиолета. Относительные энергии всех переходов указаны на рис. 1. 1.
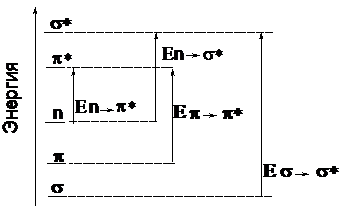
Рис. 21. 1. Относительные энергии электронных переходов.
Молекула, переведенная в возбужденное электронное состояние, может потерять избыток энергии любым из перечисленных ниже путей.
1. Разрыв связи: обычно приводит к необратимой химической реакции.
2. Испускание: излучается радиация той же частоты, что и поглощенная.
3. Флуоресценция: после возбуждения наблюдается излучение с длиной волны больше, чем поглощенная. Флуоресценция происходит быстро, часто за время менее 10-6с после поглощения.
4. Фосфоресценция: после возбуждения излучается более длинноволновая радиация, чем поглощенная. Испускание может продолжаться несколько часов после возбуждения.
5. Безизлучательные переходы: некоторые молекулы, поглотив энергию УФ-излучения, могут потерять эту энергию в результате процессов, не сопровождающихся излучением.
Способность поглощать электромагнитное излучение является общим свойством всех молекул. Поглощение избирательно, т. е. излучение определенной длины волны данной молекулой сильно поглощается, тогда как излучение других длин волн поглощается слабо или совсем не поглощается.
Область поглощения называется полосой; совокупность полос поглощения данной молекулы – спектр ее поглощения.
1. 2 Закон Бера-Бугера-Ламберта
Спектрофотометрические измерения в ультрафиолетовой и видимой областях чаще всего проводят для растворов, хотя такие измерения могут быть проведены и для чистых веществ, находящихся в парообразном, жидком и твердом состоянии. Спектрофотометрический анализ по непосредственному измерению оптической плотности может быть проведен для органических веществ, обладающих лишь определенными особенностями строения (ароматические соединения, соединения с сопряженными кратными связями, соединения ряда металлов и др. ).Величина поглощенного излучения прямо пропорциональна числу молекул растворенного вещества и поэтому возрастает с увеличением концентрации и/или толщины слоя образца (т. е., с длиной оптического пути в кювете).
При любой длине волны интенсивность света, выходящего из раствора (I), связана с интенсивностью света, входящего в раствор (Iо), соотношением, называемым законом Бера-Бугера-Ламберта:
lg (I0/I) = a b c
где а − коэффициент поглощения, константа, зависящая от длины волны, но не зависящая от концентрации;
b − длина оптического пути;
c − концентрация.
При с, выраженной в молях на литр раствора и b – в сантиметрах, a принимает значение молярного коэффициента поглощения (e) (в старых работах молярный коэффициент экстинкции)Если концентрация выражена в граммах на 100 мл раствора, то а принимает значение удельного коэффициента поглощения (Е1%1см). Таким образом: Молярный коэффициент поглощения (e) − оптическая плотность одномолярного раствора вещества при толщине слоя 1 см. Удельный коэффициент поглощения (Е1%1см) − оптическая плотность раствора, содержащего 1 г вещества в 100 мл раствора при той же толщине слоя. Переход от удельного показателя поглощения к молярному осуществляется по формуле: e = Е1% 1см х·М/10 где М - молекулярная масса Величина молярного коэффициента поглощения пропорциональна вероятности определенного электронного перехода.Для переходов с низкой вероятностью этот коэффициент имеет незначительную величину (от 10 до 103), для переходов с высокой вероятностью − около 105.
Величину радиации, поглощенной раствором, можно охарактеризовать поглощением ( А ) (в старых работах «оптическая плотность, D») или пропусканием (Т), которые связаны соотношениями:
А = lg (I0/ I)
Т = I/I0
А = - lgТ
C учетом сказанного математическая запись закона светопропускания может быть представлена в следующем виде:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|