
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Вступ. Лабораторна робота №4-5. Лабораторна робота №12
Тема: кількісне визначення фруктози
Мета: визначити масову концентрацію фруктози
Визначення фруктози засновано на реакції Селіванова. Швидкість утворення оксиметилфурфуролу в реакції фруктози з соляною кислотою при нагріванні у багато разів більша, ніж для альдогексоз, що зумовлює специфічність реакції Селіванова для фруктози.
Величину екстинкції розчину, що містить продукт конденсації утвореного з фруктози оксиметилфурфуролу з резорцином, визначають колориметрично. Для кількісного визначення вмісту фруктози готують стандартний розчин фруктози (контроль).
Об'єкт дослідження: розчин фруктози (10- 100 мг/ см3),
Обладнання і посуд: пробірки, фотоелектроколориметр, водяна баня, піпетки, бюретки, штатив для пробірок, термометр лабораторний, годинник, пробірки з пришліфованим повітряним зворотним холодильником
Реактиви: стандартний розчин фруктози (25 мг/ см3), 0, 1% розчин резорцину в 96 % етиловому спирті, 30% розчин хлоридної кислоти.
Методика виконання роботи
В одну пробірку з пришліфованим зворотним холодильником вносять 2см3 досліджуваного розчину фруктози (проба), в другу - 2 см3 стандартного розчину фруктози (контроль). Потім в обидві пробірки додають по 2 см3 розчини резорцину і по 6 см3 розчину хлоридної кислоти. Вміст пробірок перемішують і нагрівають на водяній бані протягом 8 хв при температурі 80°С. Після нагрівання розчини охолоджують і колориметрують при 490 нм. Екстинкцію вимірюють, використовуючи реактиви, замінюючи 2 см3 розчини фруктози 2 см3 дистильованої води.
Масову концентрацію фруктози в досліджуваній пробі (мкг/ см3) обчислюють за формулою:
C = Q · Е1/Eо,
де Е1 і Ео - екстинкція досліджуваного і стандартного розчинів відповідно;
Q - коефіцієнт, який є відношенням масової концентрації в стандартній пробі до об'єму проби.
Цим методом можна визначити також масову концентрацію фосфорних ефірів фруктози - фруктозо-1, 6-дифосфату і фруктозо-6-фосфату.
Зробити висновок до роботи.
Лабораторна робота №13
Тема: визначення глюкози у присутності фруктози
Мета: визначити масову концентрацію глюкози у присутності фруктози
В основі цього методу лежить здатність молекулярного йоду в лужному середовищі окислювати тільки альдегідоспирти, не впливаючи на кетоспирти. Рівняння реакції для глюкози має вигляд
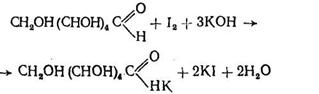
Це рівняння є результатом двох реакцій
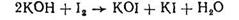
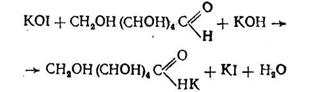
При внесенні надлишку йоду йод, що не прореагував, можна визначити в кислому середовищі титруванням натрій тіосульфатом (індикатор - розчин крохмалю). Ця реакція протікає в дві стадії

Обладнання і посуд: скляні палички, колби конічні (об'єм 50 см3), піпетки, крапельниці, бюретка, годинник.
Реактиви: розчин тіосульфату натрію 0, 05 моль/дм3, розчин йоду 0, 05 моль/ дм3, розчин гідроксиду калію 0, 5 моль/ дм3, 10 % розчин соляної кислоти, розчин крохмалю 1 %, розчин гідролізату сахарози, що містить до 100см3 глюкози або інвертний цукор (5 г цукру розчиняють в 50 см3 хлоридної кислоти і кип'ятять на водяній бані 30 хв, після охолодження розчин нейтралізують, додаючи 1 см3 1 моль/ дм3 розчину гідроксиду калію і розбавляють до об'єму 500 см3)
Методика виконання роботи
У дві колби вносять по 50 см3 розчину йоду. В одну з них (проба) додають 10 см3 досліджуваного розчину (гідролізат сахарози або інвертний цукор), а в іншу (контроль) - 10 см3 дистильованої води. Потім додають краплями, перемішуючи, по 10 см3 розчину гідроксиду калію і залишають стояти при кімнатній температурі протягом 15 хв. Після закінчення цього часу в обидві колби додають по 10 см3 розчину соляної кислоти і 2-3 краплі розчину крохмалю. Вміст колб титрують розчином тіосульфату натрію до зникнення синього забарвлення, що з'явилося після додавання крохмалю.
Масову концентрацію глюкози в досліджуваній суміші (мг/см3) розраховують за формулою:
С = (В - А) · f · Q · V0/V1
де А і В - об'єм розчину тіосульфату натрію, який необхідний для титрування проби і контролю відповідно;
f - коефіцієнт поправки на титр 0, 05 моль/ дм3 розчину тіосульфату;
Q - маса глюкози (9 міліграм), еквівалентна 1 см3 0, 05 моль/ дм3 розчину тіосульфату натрію;
Vo - загальний об'єм проби;
V1 - об'єм досліджуваної суміші, узятої для аналізу.
Зробити висновок до роботи.
Лабораторна робота №14
Тема: визначення глюкози за допомогою реакції відновлення оксиду купруму в геміоксид
Мета: визначити масову концентрацію глюкози за допомогою реакції відновлення оксиду купруму в геміоксид
В основі методу лежить реакція Троммера - здатність солей купрум (II) в певних умовах кількісно окислювати глюкозу.
У реакції Троммера відбувається утворення як альдонових кислот, так і купрум (II) гідроксиду, що указує на відсутність кількісного зв'язку між глюкозою і геміоксидом купруму. Проте якщо до реакційної суміші додають сегнетову сіль, то утворюється комплекс, в якому мідь реагує з глюкозою в стехіометричному співвідношенні
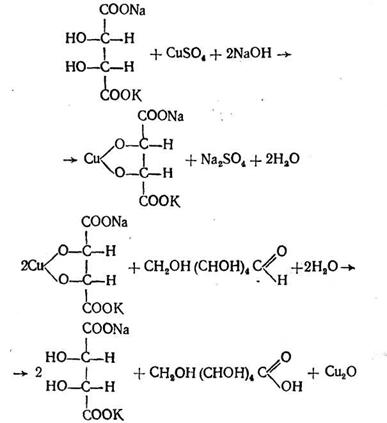
Кількість купрум (І) оксиду (Сu2О), еквівалентну окисленій глюкозі, визначають йодометричним методом:
Сu2O + I2 → CuO + CuI2
Ця реакція у присутності солей щавлевої або винної кислот протікає практично до кінця.
Кількість йоду в надлишку, яка не прореагувала з геміоксидом купруму, можна визначити титруванням тіосульфатом натрію (індикатор - розчин крохмалю):
2 Na2S2O3 + I2 → 2 NaI + Na2S4O6
Реактиви: 1. Досліджуваний розчин глюкози (1 - 4 мг/ см3), реактив Фелінга I, реактив Фелінга II, насичений розчин щавлевої кислоти, 0, 05 моль/л розчин йоду, 0, 05 моль/ дм3 розчин тіосульфату натрію, 1 %розчин крохмалю
Методика виконання роботи
В дві колби поміщають по 5 см3 реактиву Фелінга I і ІІ. В одну з колб (проба) додають 10 см3 досліджуваного розчину глюкози, а в іншу (контроль) - 10 см3 дистильованої води. Вміст обох колб нагрівають до кипіння, кип'ятять 5 хв, і потім охолоджують. Після цього в обидві колби наливають по 10 см3 насиченого розчину щавлевої кислоти, по 10 см3 розчину йоду і після перемішування відстоюють протягом 5 хв. Після закінчення цього часу в колби вносять по 5 крапель розчину крохмалю і титрують розчином тіосульфату до зникнення забарвлення, що утворилося після додавання крохмалю.
Масову концентрацію глюкози в досліджуваному розчині (мг/ см3) розраховують за формулою:
C = (B - A) · f · Q · V0/V1,
де А і В - об'єм розчину тіосульфату натрію, витраченого на титрування проби і контролю відповідно;
f - коефіцієнт поправки на титр 0, 05 моль/ дм3 розчину тіосульфату натрію;
Q - маса глюкози (3, 52 мг), еквівалентна 1 мл 0, 05 моль/ дм3 розчину тіосульфату натрію;
Vо - загальний об'єм проби;
V1 - об'єм досліджуваного розчину, узятого до аналізу.
Зробити висновок до роботи.
Лабораторна робота № 15
Тема: визначення кількості сирої клейковини в пшениці
Мета: визначити кількість та якість клейковини в пшениці.
Вміст клейковини виражають в масових частках (%) до узятої наважки розмеленого зерна. Розрізняють клейковину сиру – (маса клейковини з поглинутою водою) і суху - (після висушування).
Залежно від місту клейковини в зерні прийнята наступна класифікація пшениці
| Категорія | Вміст сирої клейковини в зерні, % |
| Високий вміст клейковини | Більше 30 |
| Середній вміст клейковини | 26 – 29, 9 |
| Вміст клейковини нижчий за середнє | 20 – 25, 9 |
| Низький вміст клейковини | Нижче 20 |
Зерно сильної пшениці повинне містити сирої клейковини не менше 28%, за якістю не нижче І групи. Якість сирої клейковини характеризується пружними властивостями. Стандартом не передбачено але в практиці іноді визначають водо поглинальну здатність клейковини, її колір(світла, сіра, темна).
Метод визначення вмісту клейковини заснований на нерозчинності білків клейковини зерна пшениці (гліадіну і глютеніну) у воді.
Об'єкт дослідження: зерно
Обладнання і посуд: лабораторний млин, фарфорова чашка з товкачем, капронове або шовкове сито.
Методика виконання роботи
Розмолоте зерно (шрот) ретельно перемішують і виділяють наважку масою 25 г або більшу з таким розрахунком, щоб забезпечити вихід сирої клейковини не менше 4 г. Шрот поміщають у фарфорову ступку або чашку і заливають водою. Об’єм води для замісу залежно від маси наважки повинен бути наступним:
| Маса зразка, г | Об’єм води, см3 |
| 14, 0 | |
| 17, 0 | |
| 20, 0 | |
| 22, 0 |
Після цього товкачем або шпателем замішують тісто, поки воно не стане однорідним. Частинки, що пристали до товкача або ступки, приєднують до шматка тесту і добре переминають руками.
Сформоване в кульку тісто поміщають в чашку і прикривають склом (або іншою чашкою) на 20 хв для того, щоб частинки розмолотого зерна просочилися водою і білки, створюючи клейковину, набубнявіли. Потім відмивають клейковину під слабким струменем водопровідної води над густим шовковим або капроновим ситом, злегка розминаючи тісто пальцями. Спочатку відмивання ведуть обережно, не допускаючи, щоб разом з крохмалем і оболонками відривалися шматочки клейковини, після видалення крохмалю і оболонок – енергійніше. Випадково шматочки клейковини, що відірвалися, збирають і приєднують до загальної маси клейковини. Тісто у воді розминають руками. Закінчення відмивання встановлюють, коли оболонки будуть повністю видалені, до цього часу вода, що стікає при віджиманні клейковини, стає майже прозорою. Якщо клейковина не відмивається, в результатах аналізу записують: що не «відмивається ». Закінчивши відмивання клейковини її віджимають між долонями, які час від часу досуха витирають рушником.
При цьому клейковину кілька разів вивертають пальцями, кожного разу витираючи долоні рушником. Поступають так до тих пір, поки клейковина не стане злегка прилипати до рук.
Віджату клейковину зважують, ще раз промивають протягом 2…3 хв, знов віджимають і знов зважують. Відмивання клейковини вважають закінченим при різниці в масі між двома зважуваннями не більше 0, 1 г. Сиру клейковину виражають в масових частках (%) до наважки подрібненого зерна (шроту).
Розбіжності у визначенні кількості сирої клейковини при контрольних і арбітражних аналізах не більше ± 2%.
Для замісу тесту, відмивання і визначення якості клейковини застосовують звичайну водопровідну воду, температура якої повинна бути 18 ± 2оС.
Зробити висновок до роботи.
Лабораторна робота № 16
Тема: визначення якості сирої клейковини.
Мета: визначити кількість та якість клейковини в пшениці.
Об'єкт дослідження: клейковина
Обладнання і посуд: прилад ІДК -1
Методика виконання роботи
З відмитої клейковини відбирають наважку масою 4 г, обминають її 3-4 рази пальцями, після чого формують кульку і поміщають її на 15 хв в посудину з водою, температура якої повинна бути 18± 5оС. Якщо клейковина після відмивання стає губчатоподібною, легкою масою, що рветься, і не формує кульку, то її відносять до ІІІ групи без визначення якості на приладі.
При недостатній масі клейковина (менше 4 г) збільшує наважку муки і заново відмиває клейковину.
Після 15-хвилинного перебування у воді, кульку клейковини поміщають в центр столика приладу і натискають кнопку включення реле часу «Пуск», яку тримають в натиснутому стані 1.. 2 с. Пуансон вільно опускається на клейковину і здійснює її стиснення.
Через 30 с переміщення пуансона автоматично припиняється і запалюється лампочка «Робота». На шкалі приладу стрілка показує величину пружності і випробовуваного зразка клейковини в умовних одиницях шкали.
Покази приладу записують з точністю до одного розподілу шкали (5 умовних одиниць), після чого включається гальмівний механізм і вантаж повертається в початкове крайнє верхнє положення. Зразок клейковини знімають із столика приладу, який протирають як і пуансон сухою тканиною для того, щоб видалити вологу і залишки клейковини.
Прилад ІДК – 1 рекомендується протягом всього робочого дня тримати включеним.
При паралельних контрольних і арбітражних аналізах допускається відхилення 5 умовних одиниць приладу (один розподіл шкали).
Характеристику клейковини за якістю дають відповідно таблиці
| Покази приладу ІДК – 1 (в ум. одиницях) | Група якості | Характеристика клейковини |
| від 0 до 15 | ІІІ | Незадовільна клейковина |
| від 20 до 40 | ІІ | Задовільна клейковина |
| від 45 до 75 | І | Добра - гарна |
| від 80 до 100 | ІІ | Задовільна клейковина |
| від 105 до 120 | ІІІ | Незадовільна клейковина |
Зробити висновок до роботи.
Приклади розв'язування задач
1. Розрахуйте товщину гідратних оболонок частинок золю Со2О3 з масовою часткою 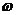 = 10, 5%, якщо в'язкість золю дорівнює 1, 15 • 10-3 Па • с. Прийняти, що густина дисперсної фази золю становить 3, 5г. см-3, а густина і в’язкість середовища відповідно дорівнюють 1 г-см-3 і 1. 10-3Па. с Частинки золю мають сферичну форму, їх радіус r=5 • 10-7 м.
= 10, 5%, якщо в'язкість золю дорівнює 1, 15 • 10-3 Па • с. Прийняти, що густина дисперсної фази золю становить 3, 5г. см-3, а густина і в’язкість середовища відповідно дорівнюють 1 г-см-3 і 1. 10-3Па. с Частинки золю мають сферичну форму, їх радіус r=5 • 10-7 м.
Розв'язання. Залежність в'язкості даного золю від концентрації дисперсної фази описується рівнянням Ейнштейна:
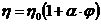 ,
,
де 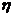 і
і 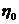 - відповідно в’язкість золю і дисперсійного середовища;
- відповідно в’язкість золю і дисперсійного середовища; 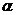 - коефіцієнт форми (для сферичних частинок
- коефіцієнт форми (для сферичних частинок 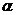 =2. 5);
=2. 5); 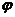 - концентрація дисперсної фази з гідратними оболонками дорівнює:
- концентрація дисперсної фази з гідратними оболонками дорівнює:
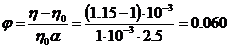 .
.
Об'ємна частка дисперсної фази без гідратних оболонок 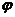 ' складає;
' складає;
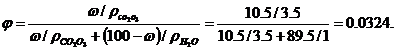
Об'єм частинки без гідратної оболонки дорівнює 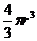 , а з урахуванням гідратної оболонки
, а з урахуванням гідратної оболонки 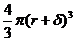 , де
, де 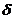 - товщина гідратної оболонки. Нехай в одиниці об’єму дисперсної фази міститься n частинок, тоді співвідношення між
- товщина гідратної оболонки. Нехай в одиниці об’єму дисперсної фази міститься n частинок, тоді співвідношення між 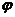 і
і 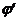 становить:
становить:
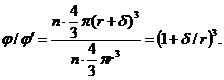
Звідси находимо величин 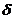 .
.
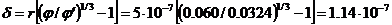 м
м
2. Розрахуйте швидкість розвитку деформації в ньютонівській
рідині з в'язкістю 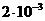 Па•с при напруженні зсуву 12 Н•м -2.
Па•с при напруженні зсуву 12 Н•м -2.
Розв'язання. Для ньютонівських рідин, згідне із законом Ньютона, між напруженням зсуву і швидкістю розвитку деформації (швидкістю течії) виконується співвідношення:
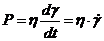 ,
,
де 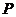 - напруження зсуву;
- напруження зсуву; 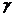 і
і 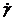 - відповідно деформація і швидкість деформації.
- відповідно деформація і швидкість деформації.
Звідки: 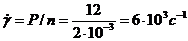
3. Визначте час витікання 5 мл ньютонівської рідини з в'язкістю 1, 5•10-3 Па•с у капілярному віскозиметрі з капіляром довжиною 10 см і діаметром 0, 82 мм, якщо різниця тиску на кінцях капіляра становить 200 Н • м-2.
Розв'язання. В'язкість рідини при вимірюваннях за допомогою капілярного віскозиметра розраховують за рівнянням Пуа-зейля:
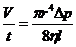 ,
,
де 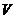 - об'єм рідини, що витікає з капіляра радіусом
- об'єм рідини, що витікає з капіляра радіусом  і довжиною 1 за час
і довжиною 1 за час 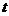 ;
; 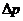 - різниця тиску на кінцях капіляра;
- різниця тиску на кінцях капіляра; 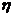 - в'язкість рідини.
- в'язкість рідини.
Звідки: 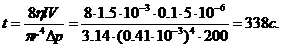
4. При дослідженні кінетики набухання полімеру в толуолі за допомогою приладу ЛДУ встановлено, що через 1 годину спостережень маса зразка збільшується вдвічі, а через три години спостережень рівень рідини в приладі перестає змінюватися, причому маса зразка збільшується в три рази. Розрахуйте константу швидкості набухання досліджуваного ВМС у толуолі. У скільки разів збільшилась маса зразка через 30 хвилин спостережень.
Розв'язання. Позначимо масу сухого зразка ВМС — т0, тоді через 1 годину набухання його маса 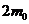 , а через три години спостережень зразок досягне граничного ступеня набухання, а його маса, відповідно,
, а через три години спостережень зразок досягне граничного ступеня набухання, а його маса, відповідно, 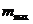 =
= 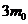 . Маса зразка через 30 хв. спостережень збільшиться в х разів і стане хт0. Константу швидкості процесу набухання розраховують за рівнянням:
. Маса зразка через 30 хв. спостережень збільшиться в х разів і стане хт0. Константу швидкості процесу набухання розраховують за рівнянням:
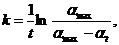
де 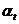 — ступінь набухання за час
— ступінь набухання за час 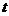 ,
, 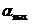 — граничний ступінь набухання.
— граничний ступінь набухання.
Ступінь набухання полімеру 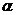 визначають як відношення маси поглиненої рідини
визначають як відношення маси поглиненої рідини 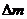 до маси полімеру
до маси полімеру 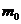 :
:
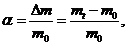
де т, — маса полімеру на момент часу t.
Таким чином, ступінь набухання зразка для кожного із зазначених в умові інтервалів часу складає:
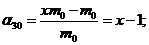
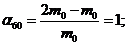
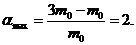
Підстановка значень 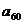 і
і 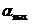 у рівнянні для константи швидкості набухання дає:
у рівнянні для константи швидкості набухання дає:
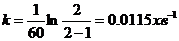
Відповідно для 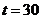 хв.
хв.
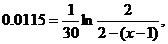 звідки
звідки 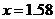 разів.
разів.
5. Розрахуйте молекулярну масу полі метилметакрилату, якщо характеристична в'язкість його розчину в хлороформі при 293 К складає 0, 86 л • г -1. Молярні маси двох ВМС, що належать до того ж гомологічного ряду, та значення характеристичної в'язкості їх розчинів у хлороформі при 293 К дорівнюють відповідно: М1 = 50000; М2 = 500000; [ 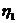 ] = 0, 349 л • г -1; [
] = 0, 349 л • г -1; [ 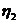 ]= 2, 308 л • г-1.
]= 2, 308 л • г-1.
Розв'язання. Молекулярна маса полімеру може бути розрахована за рівнянням Марка-Куна-Хаувінка:
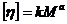
де 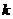 і
і 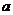 - постійні для даного гомологічного ряду і розчинника. Постійні к і а знаходимо, використовуючи дані визначення молекулярних мас двох ВМС. Рівняння Марка-Куна-Хаувінка в логарифмічній формі має вигляд:
- постійні для даного гомологічного ряду і розчинника. Постійні к і а знаходимо, використовуючи дані визначення молекулярних мас двох ВМС. Рівняння Марка-Куна-Хаувінка в логарифмічній формі має вигляд:
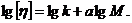
Відповідно:
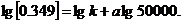
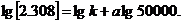
З сумісного рішення двох рівнянь знаходимо к = 4, 9 • 10~5; а = 0, 82.
Тоді
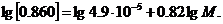
Звідки М=150000.
6. Визначте молекулярну масу ВМС за даними визначення осмотичного тиску розчину полімеру при 273 К, що наведено у
таблиці:
| |||||||
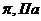
|
Розв'язання. Концентраційну залежність осмотичного тиску можна представити у лінійній формі:
 ,
,
де А2 — другий віріальний коефіцієнт, що є мірою спорідненості між ВМС і розчинником, с — масова концентрація розчину ВМС у кг м-3.
При нескінченному розведенні А2 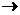 0, відповідно
0, відповідно
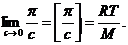
Для визначення молекулярної маси будують залежність у координатах 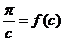 ,
,
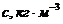
| |||||||
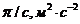
|
Екстраполяцією до с=0 визначають величину 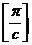 , яка відповідає відрізку, що відсікається на вісі ординат.
, яка відповідає відрізку, що відсікається на вісі ординат.
Для даної умови 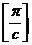 =40 м2 с-2, звідки
=40 м2 с-2, звідки 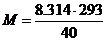 =60, 90 кг або 60900 вуглецевих одиниць.
=60, 90 кг або 60900 вуглецевих одиниць.
Задачі для самостійного розв'язування
1. Визначте в'язкість золю 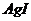 з масовою часткою дисперсної фази 10 %, приймаючи, що частинки золю мають сферичну форму, густина
з масовою часткою дисперсної фази 10 %, приймаючи, що частинки золю мають сферичну форму, густина 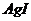 дорівнює 6, 1
дорівнює 6, 1 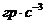 , а густина і в'язкість дисперсійного середовища складають 1 г • см-3 і 1• 10-3 Па • с., відповідно.
, а густина і в'язкість дисперсійного середовища складають 1 г • см-3 і 1• 10-3 Па • с., відповідно.
Відповідь: 1, 045 • 10-3 Па • с.
2. Визначте концентрацію (у мас. частках) дисперсної фази золю А12О3, частинки якого мають сферичну форму, якщо в'язкість золю дорівнює 1, 05 • 10-3 Па-с, густина А12О3 складає 4 г • см-3. В'язкість і густина дисперсійного середовища відповідно складають і 1 • 10-3 Па • с і 1 г • см--3.
Відповідь: 0, 075.
3. Розрахуйте концентрацію (у мас. частках) гідрозолю SіО2, частинки якого мають сферичну форму, їх густина складає 2, 7 г•см-3, якщо відомо, що в'язкість золю на 10 % більша за в'язкість дисперсійного середовища, густина середовища 1 г • см-3.
Відповідь: 0, 10.
4. Розрахуйте товщину гідратних оболонок частинок золю SіО2 якщо в'язкість золю з вмістом силіцій (ІV) оксид 15 % (мас. ) складає 1, 3 • 10-3 Па • с, діаметр сферичних частинок силіцій (ІV) оксид складає 16 нм. Густина частинок дисперсної фази і середовища відповідно дорівнюють 2, 7 і 1 г•см-3, в'язкість середовища 1 • 10-3 Па • с.
Відповідь: 2, 0 • 10-9 м.
5. Розрахуйте радіус гідратованої частинки золю, що містить 1016 частинок у 1 м3, якщо відомо, що в'язкість колоїдного розчину і середовища відповідно дорівнюють 1, 125 • 10-3 і 1 • 10-3 Па • с, а частинки мають сферичну форму.
Відповідь: 1 • 10-6м.
6. Розрахуйте радіус сферичних частинок золю з концентрацією 15 % (мас), якщо його в'язкість складає 1, 2 • 10-3Па•с, густина частинок дисперсної фази і дисперсійного середовища відповідно дорівнюють 3 г • см-3 і 1 г • см-3, в'язкість дисперсійного середовища 1 • 10-3Па• с. Прийняти, що товщина гідратних оболонок складає 2 нм.
Відповідь: 1, 5- 10-8м.
7. Розрахуйте кількість частинок дисперсної фази в 1 м3 золю з дисперсністю 0, 005 нм-1 за умови що частинки мають сферичну форму, а в'язкість золю і середовища відповідно складають 1, 005 • 10-3 і 1 • 10-3 Па • с (гідратацію не враховувати).
Відповідь: 4, 8 • 1017 частинок у 1 м3.
8. У результаті реологічних досліджень встановлено, що золь А12O3 з масовою часткою 12 % і дисперсністю частинок 5• 107м-1 є ньютонівською рідиною з в'язкістю 1, 18•10-3Па•с. Розрахуйте товщину гідратних оболонок золю, якщо густина частинок дисперсної фази дорівнює 4 г • см-3, густина і в'язкість дисперсійного середовища відповідно складають 1 г•см-3 і 1 • 10-3 Па•с, форма частинок сферична.
Відповідь: 2, 97 • 10-9м.
9. Визначте кількість гідратованих частинок дисперсної фази в 1 м3 золю, діаметр яких складає 200 нм, якщо відомо, що частинки мають сферичну форму, а в'язкість золю і середовища відповідно дорівнюють 1, 015 • 10-3 і 1 • 10-3 Па • с.
Відповідь: 1, 4- 1018 частинок.
10. Розрахуйте радіус міцел ПАР у водному середовищі за наступними даними: коефіцієнт дифузії міцел при 313 К дорівнює 0, 69 • 10 -11 м2 • с -1, форма частинок сферична. Визначте в'язкість цього міцелярного розчину, якщо в 1 м3 міститься 1 • 1020 частинок. Прийняти, що в'язкість середовища дорівнює 8 • 10-4 Па • с.
Відповідь: 4, 15 • 10-8 м; 8, 6 • 10 -4 Па • с.
11. Розрахуйте в'язкість колоїдного розчину ПАР у водному середовищі, об'ємна частка дисперсної фази в якому складає 0, 5, якщо при дії на нього напруженні зсуву 18 Н • м-2 швидкість розвитку деформації у складає 5, 5•103с-1. Визначте значення коефіцієнта форми частинок а у рівнянні Ейнштейна. Прийняти, що в'язкість середовища складає 1 • 10-3 Па • с.
Відповідь: 3, 27 • 10-3 Па • с; 4, 5.
12. Розрахуйте, яка швидкість розвитку деформації в ньютонівській рідини при напруженні зсуву 10 Н • м-2, якщо в'язкість рідини дорівнює 1, 62 • 10-3 Па • с.
Відповідь: 6, 1 • 103 с -1.
13. Яким повинно бути напруження зсуву, якщо при в'язкості ньютонівської рідини 3 • 10-3 Па • с швидкість розвитку деформації складає 4 • 10-3 с -1.
Відповідь: 12 Н • м-2.
14. Розрахуйте швидкість розвитку деформації, якщо до водного розчину колоїдної ПАР з об'ємною часткою дисперсної фази 0, 45 прикладено напруження зсуву 20 Н•м-2. Прийняти, що коефіцієнт форми частинок дорівнює 4, а в'язкість середовища 1 • 10-3 Па•с.
Відповідь: 7, 14 • 103с.
15. Визначте діаметр перетину капілярного віскозиметра з довжиною капіляра 5 см, якщо 3 мл ньютонівської рідини з в'язкістю 1 • 10 -3 Па • с протікають через нього за 8 хвилин під тиском 200 Н • м-2.
Відповідь: 0, 5 мм.
16. Визначите в'язкість машинної олії, якщо через капіляр довжиною 6 см і діаметром 1 мм вона протікає зі швидкістю 2, 04•10-3 см3 • с -1 під тиском 100 Па.
Відповідь: 2 • 10 -2 Па • с.
17. Визначте, якою повинна бути різниця тиску на кінцях капіляра, щоб 1, 5 мл ньютонівської рідини з в'язкістю 1, 16 • 10 -3 Па • с протікали через капіляр довжиною 5 см і діаметром 0, 72 мм за 120 с.
Відповідь: 110 Па.
18. Визначте час витікання 1 мл ньютонівської рідини в капілярному віскозиметрі за наступних умов: в'язкість рідини 1, 02• 10-3Па•с; діаметр капіляра 0, 56 мм, довжина капіляра 7 см, різниця тиску на кінцях капіляра 150 Н • м-2.
Відповідь: 197 с.
19. Розрахуйте, за який час зразок полімеру масою 2 г у процесі набухання поглинає 1 г розчинника, якщо константа швидкості набухання даного ВМС складає 0, 01 хв-1, а максимальний ступінь набухання аmax = 90 %.
Відповідь: 81 хв.
20. За 3 години спостережень полімер масою 4 г при 20 °С поглинає 4 мл толуолу. Граничний ступінь набухання даного ВМС у толуолі при цій температурі складає 140 %. Визначте, за який час зразок поглинає вдвічі менший об'єм розчинника. Густина толуолу 0, 86 г•см-3.
Відповідь: 69 хв.
21. Який об'єм розчинника з густиною 0, 8 г • см-3 поглинає полімер масою 5 г через годину спостережень, якщо 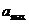 в цьому розчиннику дорівнює 120 %, а константа швидкості набухання дорівнює 0, 02 хв-1?
в цьому розчиннику дорівнює 120 %, а константа швидкості набухання дорівнює 0, 02 хв-1?
Відповідь: 5, 24 см3.
22. Визначте граничний ступінь набухання ВМС в органічному розчиннику, якщо константа швидкості набухання дорівнює 0, 01 хв-1, а за 1 годину спостережень маса полімеру збільшується в 2 рази. У скільки разів збільшується маса зразка приграничному набряканні в порівнянні з масою сухого зразка?
Відповідь: 221 %, у 3, 2 рази.
23. Процес набухання полімеру в бензолі припинився через 4 години, коли маса полімеру збільшилася на 90 %. Який обсяг бензолу був поглинений полімером через 2 години після початку досліду, якщо константа швидкості набухання даного ВМС у бензолі складає 0, 015 хв-1, маса сухого зразка 10 г, густина бензолу 0, 88 г • см-3.
Відповідь: 8, 52 см3.
24. Два однакових зразки каучуку масою по 10 г кожний поміщені в діетиловий ефір і ацетон. Константи швидкості набухання каучуку в діетиловому ефірі й ацетоні дорівнюють відповідно 0, 013 хв. -1 і 0, 0075 хв. -1, граничні ступені набухання в цих же розчинниках дорівнюють 3, 58 і 1, 22. Визначте, за який час зразок, що знаходиться в ацетоні, поглинає таку ж масу розчинника, яку полімер, поміщений в ефір, поглинає за 30 хвилин.
Відповідь: 381 хв.
25. Характеристична в'язкість  розчину полівінілацетату в ацетоні при 30 °С дорівнює 0, 0526 м3 • кг. Розрахуйте середню молекулярну масу полімеру. Постійні рівняння Марка—Куна—Хау-вінка
розчину полівінілацетату в ацетоні при 30 °С дорівнює 0, 0526 м3 • кг. Розрахуйте середню молекулярну масу полімеру. Постійні рівняння Марка—Куна—Хау-вінка 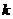 =2, 8 • 10-5 і а =0, 67.
=2, 8 • 10-5 і а =0, 67.
Відповідь: 70000.
26. Молекулярні маси двох ВМС, що належать до одного гомологічного ряду, було визначено на підставі вимірювання в'язкості їх розчинів в органічному розчиннику и склали відповідно 55000 і 80000, значення характеристичної в'язкості  розчинів цих ВМС у тому самому розчиннику дорівнюють відповідно 0, 587 м3• кг-1 і 0, 796 м3• кг-1. Визначте постійні рівняння Марка—Куна—Хаувінка для даного гомологічного ряду і розчинника.
розчинів цих ВМС у тому самому розчиннику дорівнюють відповідно 0, 587 м3• кг-1 і 0, 796 м3• кг-1. Визначте постійні рівняння Марка—Куна—Хаувінка для даного гомологічного ряду і розчинника.
Відповідь: к =8, 5 • 10-5; а = 0, 81.
27. Визначте молекулярну масу целюлози, якщо характеристична в'язкість  мідно-аміачного розчину целюлози дорівнює 0, 90 м3 • кг-1, постійні рівняння Марка—Куна—Хаувинка
мідно-аміачного розчину целюлози дорівнює 0, 90 м3 • кг-1, постійні рівняння Марка—Куна—Хаувинка 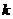 = 8, 5•10 -5 а = 0, 81.
= 8, 5•10 -5 а = 0, 81.
Відповідь: 93100.
28. Молекулярні маси двох зразків каучуку, що належать до одного гомологічного ряду, визначені вискозиметрическим методом, дорівнюють 80000 і 200000, значення характеристичної в’язкості  розчинів цих ВМС у бензолі рівні відповідно 0, 96 л•г-1 і 1, 78 л•г-1. Визначите молекулярну масу каучуку, для якого в бензолі
розчинів цих ВМС у бензолі рівні відповідно 0, 96 л•г-1 і 1, 78 л•г-1. Визначите молекулярну масу каучуку, для якого в бензолі  =1, 47 л • г-1.
=1, 47 л • г-1.
Відповідь: 150000.
29. Розрахуйте молекулярну масу полістиролу, якщо характеристична в'язкість  його розчину в бензолі при 293 К складає 0, 739 л•г-1, використовуючи дані для двох ВМС того ж гомологічного ряду; Мі = 50000; М2 = 100000;
його розчину в бензолі при 293 К складає 0, 739 л•г-1, використовуючи дані для двох ВМС того ж гомологічного ряду; Мі = 50000; М2 = 100000; 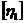 = 0, 366 л•г-1;
= 0, 366 л•г-1; 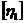 = 0, 570 л•г-1.
= 0, 570 л•г-1.
Відповідь: 150100.
30. Розрахуйте молекулярну масу поліметилметакрилату, якщо відомо, що приведений осмотичний тиск Росм/с його розчину в хлороформі при нескінченному розведенні ( 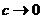 ) складає 50, 0 м2 • с-2 при температурі 298 К.
) складає 50, 0 м2 • с-2 при температурі 298 К.
Відповідь: 49550.
Теоретичні питання до самостійної роботи
1. У чому суть явищ тиксотропії і реопексії?
2. Яким рівнянням описується залежність в'язкості рідких агрегативно стійких дисперсних систем від концентрації дисперсної фази? За яких умов воно застосовне?
3. Речовини з яким значенням молекулярної маси прийнято відносити до ВМС? Які типи ВМС вам відомі?
4. Що таке сегмент макромолекули? Що таке конформація?
5. Назвіть відомі вам природні ВМС.
6. Чому істинні (молекулярні) розчини ВМС відносять до колоїдних систем («молекулярних колоїдів»)?
7. Що являє собою статистичний клубок ВМС у розчині? Що таке глобула?
8. Що таке поліелектроліти? Які класифікації поліелектролітів вам відомі?
9. Чим відрізняється стан полііона в безсольовому розбавленому розчині від стану відповідної електронейтральної макромолекули в тому ж середовищі?
10. Напишіть рівняння Ньютона для течії рідин і поясніть фізичний зміст параметрів, що входять до нього. Які рідини називають ньютонівськими?
11. Що називають відносною, питомою і характеристичною в'язкістю?
12. Для чого введене поняття «ефективної в'язкості»?
13. Чому в'язкість розчинів поліамфолітів мінімальна при рН = pНIЕT?
14. Як залежить в'язкість розчинів полімерів від їх концентрації, молекулярної маси, форми макромолекул та їх спорідненості з розчинником?
15. Напишіть рівняння Хаггінса і поясніть фізичний зміст величин, які входять до нього.
16. Якими методами можна виміряти в'язкість рідин?
17. Поясніть принцип дії капілярного віскозиметра. Напишіть рівняння Пуазейля. За допомогою якого рівняння розраховують в'язкість у методі капілярної віскозиметрії?
18. У чому суть явища набухання ВМС?
19. У чому полягає різниця між обмеженим та необмеженим набуханням?
20. Що характеризує ступінь набухання? Від впливу яких факторів залежить ступінь набухання ВМС?
21. Що таке тиск набухання?
22. Як експериментально визначають ступінь набухання та константу швидкості набухання?
23. Яке явище зветься контракцією? Внаслідок яких причин це явище відбувається?
24. Що являють собою драглі? Як відбувається процес утворення драглів в розчинах ВМС?
25. Яке значення мають драглі та процес утворення драглів для біології та медицини?
26. В чому полягають особливості структурно-механічних властивостей драглів?
27. Що таке синерезис? Як пояснити це явище? Наведіть приклади синерезису.
28. Які чинники сприяють синерезису?
Глосарій
Агрегативна стійкість – здатність системи до збереження постійної дисперсності. Для колоїдних систем специфічна агрегативна нестійкість, так як ліофобні системи володіють більшим запасом вільної енергії на межі поділу фаз, тому завжди можливий процес агрегації (злипання) частинок та зменшення загальної поверхні дисперсної фази. Для надання агрегативної стійкості потрібне введення стабілізатора, роль яких виконують ВМС та ПАР.
Біополімери – клас полімерів, що зустрічаються в природі і входять до складу живих організмів: білки, нуклеїнові кислоти, полісахариди. Біополімери складаються з однакових (або різних) ланок - мономерів.
Броунівський рух – тривимірний випадковий рух частинок в результаті нескомпенсованих ударів молекул дисперсійного середовища по їхній поверхні.
Вільна енергія змочування – зміна вільної енергії при змочуванні твердого тіла. Рідина розтікається та змочує поверхню, якщо при цьому вільна енергія системи зменшується.
Високомолекулярні сполуки (ВМС) - це сполуки, молекули яких складаються з великої кількості елементарних комірок. ВМС характеризуються ступенем полімеризації та молекулярною (молярною) масою. Ступінь полімеризації визначає число елементарних ланок, що містить одна макромолекула полімеру. Молекулярна маса - це маса однієї макромолекули, виражена в а. о. м. Молярна маса полімеру - це маса моля макромолекул (6, 02•1023 макромолекул) і виражена в г/моль.
Дифузія – процес самовільного вирівнювання концентрації частинок в об’ємі системи в результаті їх броунівського руху.
Дублення – поширений різновид структурування біополімерів. Воно представляє цікавість не тільки при структуруванні білків у виробництві натуральної шкіри, але і при використанні білкових клеїв, шкір, картонів та ін.
Енергетичний бар’єр ентропійної природи – бар’єр, який виникає при перекритті адсорбційних шарів довголанцюгових ПАР та ВМС в наслідок зниження конформаційної ентропії за рахунок більш впорядкованого розміщення гнучких молекул в зазорі між частинками при їх наближенні.
Захисне число – число міліграмів високомолекулярної сполуки, яке необхідно додати до 10 мл стандартного золю для того, щоб не допустити його коагуляцію при введенні 1 мл 10%-ного розчину NaCl. При використанні в якості стандартного золю золота, захисне число називають золотим.
Захисні колоїди– високомолекулярні речовини, здатні стабілізувати дисперсійні системи, перешкоджаючи коагуляції та седиментації частинок шляхом утворення на поверхні частинок дисперсної фази.
Змочувальна здатність– здатність рідини змочувати тверду поверхню чи розтікатися по ній.
Змочування– явище, яке виникає на трифазній межі поділу при зіткненні рідини з поверхнею твердого тіла. Воно проявляється при повному чи частковому розтіканні рідини по поверхні, внаслідок сильної міжмолекулярної взаємодії поверхні та рідини. Змочування характеризується величиною крайового кута змочування чи кута змочування.
Ізоелектрична точка білка– стан, при якому електрокінетичний потенціал дорівнює 0.
Коагулятори – речовини, які викликають процес коагуляції. Найбільш часто – електроліти. Коагулююча здатність характеризується кількістю коагулятора, необхідним для коагуляції стандартного золю.
Коагуляція – явище наближення, злипання частинок дисперсної фази в дисперсній системі під дією будь-яких зовнішніх або внутрішніх сил, в результаті чого дисперсна система розділяється на дві неперервні фази. Коагуляція може відбуватися при нагріванні, заморожуванні, інтенсивному перемішуванні, пропусканні електричного струму, додаванні електролітів або інших яких не будь систем. В будь-якому випадку коагуляція пов’язана з порушенням стабілізуючого подвійного шару або адсорбційно-сольватаційного шару.
Коалесценція – процес самовільного зменшення площі рідкої поверхні поділу (в емульсіях та пінах), що супроводжується зникненням деякої частини поверхні в результаті злипання частинок (капель).
Колоїдний захист – це підвищення стійкості ліофобних золів і грубодисперсних систем по відношенню до електролітів. Він досягається шляхом додавання до таких систем високомолекулярних сполук і, перш за все, білків, молекули яких адсорбуються на поверхні міцел золів або частинок грубодисперсних систем, сольватуються, що і надає стійкості дисперсним системам.
Ліофільність та ліофобність (критерії ліофільності Ребіндера)– класифікація ліозолей на ліофільні та ліофобні заснована на величині питомої вільної міжфазної енергії. В якості критерію використовується граничне значення міжфахного натягу при температурі 25 º С дорівнює 0, 1 мДж/м2. системи, які мають велике значення міжфазного натягу відносяться до ліофобних, менше – до ліофільних.
Ліофобні системи потребують для свого існування введення стабілізатора. Ліофільні системи, як правило утворюються самовільно та стійкі без введення стабілізатора.
Мономери білків– амінокислоти, нуклеїнових кислот - нуклеотиди, полісахаридів - моносахариди.
Набухання – це самочинний процес поглинання низькомолекулярної рідини високомолекулярною речовиною, що супроводжується збільшенням її маси і об'єму.
Онкотичний тиск– тиск, що обумовлений присутністю білків та інших ВМС в розчині.
Осмометрія – метод визначення розмірів колоїдних частинок та молекулярної маси полімерів, заснований на вимірюванні осмотичного тиску.
Полімери– речовини, молекули яких складаються з великого числа повторюваних ланок (мономерів) і тому називаються також макромолекулами. Це високомолекулярні сполуки, що володіють великою молекулярною масою (103 - 109 Дальтон).
Правило Журкова – ефект пластифікації полярного полімеру, що оцінюється величиною зниження Тс, визначається числом молей полярного пластифікатора, введеного у полімер, незалежно від його хімічної природи та розмірів молекул.
Правило Мок-Марешаля – при нuзьких концентраціях noліелектроліту активність противойонів в розчині в nрисутності солі дорівнює їх активності у відсутності солі nлюс активність однойменно заряджених іонів у відсутності noліелектролітів.
Розчинник добрий – це такий розчинник, що інтенсивно взаємодіє з полімерами, утворює розчини зі значним зниженням тиску пари та позитивним другим віріальним коефіцієнтом А2.
Розчинник квазіідеальний, або θ (тета) – розчинник має другий віріальний коефіцієнт А2=0.
Розчинник поганий – зниження тиску пари незначне, а другий віріальний коефіцієнт має негативне значення.
Седиментація – осідання або випливання частинок під впливом сили тяжіння або доцентрової сили з утворенням осаду.
Сенсибілізація – агрегація частинок при введенні полімерів та колоїдних ПАР в кількості недостатній для захисту дисперсій. Це явище має місце при низькому вмісті макромолекул в середовищі та пояснюється стягуючою дією. До цього призводять молекули полімеру, який одночасно адсорбується на двох різних частинках («місток»). Використовується при очищенні стічних вод від дисперсних частинок.
Стабілізація– процес створення захисних іонних чи молекулярних шарів на міжфазних межах, які надають системі агрегативну стійкість.
Стабілізуюча здатність– здатність розчинів речовин (зазвичай ПАР або полімерів) забезпечувати стійкість дисперсійної системи проти агрегації та седиментації шляхом утворення на поверхні частинок дисперсної фази захисного адсорбційного шару. Такі речовини називають стабілізаторами.
Флокуляція – коагуляція з утворенням щільно сольватованих пластівців (часто спостерігається у суспензій).
Література
Основна
1. Анохин В. В. Химия и физико-химия полимеров / Владимир Викторович Анохин. – Киев: «Вища школа», 1987 – 400с.
2. Костаржицький А. І. Фізична та колоїдна хімія / Костаржицький А. І., Калінков О. Ю., Тіщенко В. М. – Київ: Центр учбової літератури, 2008. – 496с.
3. Білий О. В. Фізична хімія / Білий Олександр Володимирович. – Київ: ЦУЛ, 2002 – 364с.
4. Болдырев А. И. Физическая и коллоидная химия / Александр Иванович Болдырев. – М.: Высшая школа, 1983. – 405с.
5. Равич-Щербо М. И. Физическая и коллоидная химия / М. И. Равич-Щербо, В. В. Новиков – М.: Высшая школа, 1985. – 250с.
Додаткова
1. Захаренко В. Н. Коллоидная химия / Виктор Николаевич Захаренко М.: Высшая школа, 1989. – 273с.
2. Писаренко А. П. Курс коллоидной химии / Писаренко А. П., Поспелова К. А., Яковлєв А. Р. – М.: Высшая школа, 1979. – 240с.
3. Усков І. А. Колоїдна хімія / Іван Антонович Усков – К.: Вища школа, 1988. – 250с.
4. Мороз А. С. Фізична та колоїдна хімія / А. С. Мороз, А. Г. Ковальова – Львів. “Світ”, 1994.
5. Колоїдна хімія / [Мчедлов-Петросян М. О., Лебідь В. І., Глазкова О. М. та ін. ]. – Харків.: Фоліо, 2005. – 300с.
Навчально методичне видання
(українською мовою)
Омельянчик Людмила Олександрівна
Гаврилова Лідія Олександрівна
Лашко Наталія Петрівна
Коваленко Данило Сергійович
ФІЗИЧНА ХІМІЯ БІОПОЛІМЕРІВ
Навчально-методичний посібник для самопідготовки та лабораторних робіт студентів біологічного факультету напряму підготовки “Хімія” денної форми навчання
Рецензент Г. О. Чаусовський
Відповідальний за випуск М. П. Завгородній
Коректор О. В. Ткачук
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|