
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторна робота №4-5 6 страница
При мінералізації органічних речовин уникають бурхливого кипіння рідини.
Після того, як всі органічні речовини окислилися, про що свідчить стійке знебарвлення рідини, вміст пробірки кількісно переносять в мірну колбу на 100см3, охолоджують і обережно (по стінці! ) додають 15 см3 дистильованої води (попередньо перевіреної за допомогою реактиву Несслера на відсутність аміаку), 2 краплі розчину метилового червоного і приєднують до апарату для мікровизначення нітрогену.
Апарат для мікровизначення нітрогену складається з пароутворювача 1, запобіжної судини 3, колби К'ельдаля 5, краплепоглинача 11, холодильника 10 і приймача - конічної колби 12. Пароутворювачем служить звична плоскодонна колба, в яку наливають дистильовану воду, що підкислена сірчаною або фосфорною кислотою. Колбу-пароутворювач забезпечують запобіжною скляною трубкою 2, яка доходить до дна. Для рівномірного кипіння на дно колби кладуть декілька шматочків пемзи або скляних капілярів.
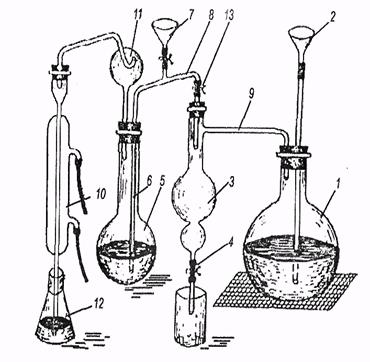
Рис. 1 - Апарат для мікровизначення нітрогену (по К. П. Петрову),
Оптичну густину фільтрату кожної проби досліджують на фотоелектроколориметрі. Як стандартний розчин використовують лимоннокислий розчин барвнику оранж Ж, розведений дистильованою водою у співвідношенні 25: 20.
У приймальну колбу 12 піпеткою вносять 20 см3 0, 01 н розчину сульфатної кислоти. Колбу встановлюють так, щоб форштос був занурений в кислоту на 2... 3 мм (щоб уникнути втрат аміаку).
У колбу К'ельдаля через лійку 7 наливають 33 % розчин натрій гідроксиду (з розрахунку 5-6 см3 розчину лугу на 1 см3 концентрованої сульфатної кислоти, узятої для спалювання) до зміни забарвлення індикатора у жовтий, після чого негайно ж закривають затискач на лійці 7. Відкривають затискач 13 (одночасно закриваючи затискач 4 на запобіжній судині) і починають пропускати пару. Відгонку амоніаку продовжують 10... 15 хвилин. В останні хвилини відгонки кінець-форштоса виймають з розчину кислоти (щоб уникнути засмоктування рідини). Закінчивши відгонку, змивають форштос 2... 3см3 дистильованої води, приєднуючи їх до розчину в приймач, у який додають 2.. . 3 краплі розчину метилового червоного і відтитровують надлишок кислоти, 0, 01 н розчином натрій гідроксиду до появи жовтого забарвлення.
Загальний процентний вміст нітрогену в досліджуваному матеріалі Х1 розраховують за формулою:
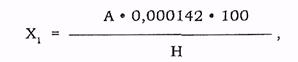
де А - кількість 0, 01 н розчину сульфатної кислоти, що зв'язалася з амоніаком (см3);
Н - наважка продукту (г).
Зробити висновок до роботи.
Лабораторна робота №8
Тема: спектрофотометричний метод визначення білка в харчовій сировині
Мета: визначити вміст білка в харчовій продукції методом спектрофотометрії
Із амінокислот, що входять до складу білків, лише триптофан, тирозин і у меншій мірі фенілаланін володіють помітним поглинанням в ультрафіолетовій області спектру. Оптична густина розчинів білків, що містять ці амінокислоти, при 280 нм прямо пропорційна їх концентрації в розчині. Оскільки більшість білків містять залишки тирозину, вимірювання поглинання при 280 нм за допомогою спектрофотометра є швидким і зручним способом визначення вмісту білка в розчині.
Цей метод дає добрі результати з гетерогенною сумішшю білків, а також з препаратами індивідуальних білків, молярна абсорбція яких (коефіцієнт оптичної густини) може бути точно виміряна або обчислена виходячи з амінокислотного складу. Коефіцієнт оптичної густини даного білка залежить від вмісту в ньому триптофану, тирозину, фенілаланіну.
Об'єкт дослідження: розчин білка.
Обладнання і посуд: штатив з пробірками, мірні піпетки, спектрофотометр.
Методика виконання роботи
1. Безбарвний, абсолютно прозорий розчин білка поміщають в кювету спектрофотометра з товщиною шару 1 см і визначають його оптичну густину при довжині хвилі 280 нм.
Концентрацію білка розраховують, виходячи з відомого коефіцієнта оптичної густини, або визначають за допомогою заздалегідь побудованої калібрувальної кривої.
2. Якщо коефіцієнт невідомий, можна скористатися номограмою Адамса (рис. 1).
На номограмі на шкалах 2 і 3 відкладені значення оптичної густини розчинів білка відповідно при 280 і 260 нм, а на шкалі 1 - концентрація білка (в мг/ см3).
Визначають оптичну густину досліджуваного розчину білка при 280 і 260нм. Через відповідні точки на шкалах 2 і 3 проводять уявну пряму. Точка її перетину зі шкалою 1 дає концентрацію білка в досліджуваному розчині.
Використання номограми Адамса зручне ще і тому, що при цьому враховується забруднення розчину білка нуклеїновими кислотами, які мають максимум поглинання при 260 нм.

Рисунок 1 - Номограма для визначення концентрації білка.
Зробити висновок до роботи.
Лабораторна робота № 9
Тема: визначення концентрації лактози та білка в молоці.
Мета: визначити кількісний вміст лактози та білку в молоцітитриметричним методом.
Об'єкт дослідження: молоко
Обладнання і посуд: піпетки, колби мірні (об'єм 50 см3), колби конічні з притертим корком (об'єм 100 см3), лійки скляні, бюретки, крапельниці, складчасті паперові фільтри.
Реактиви: розчин сульфату міді 7%, розчин гідроксиду натрію 2%, розчин фториду натрію 5 %, розчин йоду 0, 005 моль/л, розчин соляної кислоти 5 %, розчин тіосульфату натрію 0, 005 моль/л, розчин крохмалю 1 %.
Методика виконання роботи
1. Лактоза молока
В основі методу лежить здатність альдегідної групи лактози в лужному середовищі окислюватись молекулярним йодом:
C12H22O11 + І2 + 2NaOH = C12H22O12 + 2NaI + H2O
Надлишкову кількість йоду, що не вступила в реакцію, визначають титруванням тіосульфатом натрію, використовуючи як індикатор крохмаль.
В дві мірні колби вносять по 5 см3 розчину міді сульфату, по 5 см3 розчину натрію гідроксиду і по 2, 5 см3 розчини фториду натрію. В одну з них (проба) додають 5 см3 молока, в іншу (контроль) - 5 см3 дистильованої води, перемішують і доводять дистильованої водою до об'єму 50 см3, через 30 хв фільтрують. Потім в конічні колби переносять по 20 см3 фільтрату проби і контролю, вливають по 20 см3 розчину йоду і, безперервно перемішуючи, по 10см3 розчину гідроксиду натрію. Ретельно закривають.
Через 20 хв до вмісту колб додають по 10 см3 розчину соляної кислоти, по 3 краплі розчину крохмалю і титрують розчином тіосульфату натрію до зникнення забарвлення, що утворилося при додаванні крохмалю.
Масову концентрацію лактози в молоці (мг/ см3) розраховують за формулою:
С = (В - А) · f · Q · V0/V1· V2
де А і В - об'єм розчину тіосульфату натрію, витрачений на титрування проби і контролю;
f - коефіцієнт поправки на титр 0, 05 моль/дм3 розчину тіосульфату натрію;
Q - маса лактози (18, 01 міліграм), еквівалентна 1 мл 0, 05 міль/дм3 розчину тіосульфату натрію;
Vo - загальний об'єм проби;
V1 і V2, - об'єми фільтрату і молока відповідно, узяті для досліджень.
2. Білки молока
Визначення масової частки білка методом формального титрування.
Підготовка до аналізу. Розчин кобальт (ІІ) сульфату (2, 5%-ий) готують наступним чином: 2, 5 г кобальт (ІІ) сульфату вносять у мірну колбу ємністю 100 см3 та доводять до мітки дистильованою водою. Термін зберігання розчину кобальт (ІІ) сульфату 6 місяців.
Формалін нейтралізують 1Н розчином натрій гідрооксиду при наявності 0, 25 см3 1%-ого спиртового розчину фенолфталеїну до слаборожевого забарвлення. Розчин готують перед початком аналізу.
Проведення аналізу. У хімічну склянку діаметром 55-56 мм відміряють піпеткою 2 см3 молока, 0, 25 см3 2%-ого розчину фенолфталеїну та титрують 0, 1н розчином гідрооксиду натрію до появи слаборожевого забарвлення, відповідної контрольному еталону. Потім вносять 4 см3 нейтралізованого 36-40%-ого формаліну і вдруге титрують до такого ж інтенсивного забарвлення, як і при першому титруванні.
Роблять обов’язково не менше трьох паралельних визначень. Допускається розбіжність при титруванні між двома паралельними визначеннями не більше 0, 05 см3 лугу.
Для приготування контрольного еталону забарвлення у склянку відміряють 20 см3 молока та 0, 5 см3 2, 5%-ого розчину кобальт (ІІ) сульфату.
Обробка результатів. Масову частку білка в молоці (Х) у відсотках розраховують за формулою:
Х=0, 959·А, де
А – кількість 0, 1Н розчину гідрооксиду натрію, використаного на титрування в присутності формаліну, см3;
0, 959 – коефіцієнт перерахунку.
Зробити висновок до роботи.
Лабораторна робота № 10
Тема: визначення вмісту вуглеводів методом тонкошарової хроматографії
Мета: визначити кількісний вміст вуглеводів методом тонкошарової хроматографії
При проведенні хроматографічного розділення вуглеводів методом тонкошарової хроматографії пластинку з тонким шаром пористого носія (наприклад, пластинку Silufol), на яку нанесені розчини вуглеводів, поміщають в розчинник, який, просуваючись за рахунок капілярних сил, переміщає вуглевод. По завершенню хроматографії проводять обробку пластинки, що дозволяє виявити плями вуглеводу, і розрахунковим методом визначають масу вуглеводу в досліджуваному розчині.
Матеріали і реактиви: пластинки Silufol або Silufol-UV, досліджуваний і стандартний (10 мкг в пробі) розчин вуглеводу (глюкоза, галактози, фруктоза, сахарози, мальтоза), розчинник - суміш бутанол - ацетон - вода (4: 5: 1), у разі використання пластинок Silufol нафторезорциновий, реактив (свіжоприготовлена суміш рівних об'ємів 20 % водного розчину трихлороцтової кислоти і 0, 2% спиртного розчину нафторезорцину).
Обладнання і посуд: мікропіпетки, пульверизатор у разі використання пластинок Silufol або джерело ультрафіолетового світла у разі використання пластинок Silufol-UV, хроматографічна камера, лінійка, простий олівець, планіметр, сушильна шафа.
Методика виконання роботи
На пластинці на відстані 2 см від нижнього краю (лінія старту) акуратно намічають олівцем три точки нанесення розчинів вуглеводів. За допомогою мікропіпетки в намічених місцях наносять рівні об'єми досліджуваного розчину вуглеводу (5- 20 мкг в пробі), розбавленого досліджуваного розчину вуглеводу і стандартного розчину вуглеводу так, щоб одержати плями одного діаметру.
Після висушування плям пластинку поміщають в хроматографічну камеру, на дні якій знаходиться розчинник - суміш бутанол - ацетон - вода (4: 5: 1). Висота шару розчинника - 1 см. Хроматографію проводять до проходження розчинником 10 см від лінії старту. Після цього хроматограму висушують і проявляють. При використовуванні пластинок Silufol хроматограму обробляють з пульверизатора розчином нафторезорцину і сушать в сушильній шафі 5-10 хв при температурі 90-100° С для прояву плям вуглеводу. Плями глюкози і галактози мають синьо-фіолетовий колір, фруктоза - червоно-чорний, сахарози і мальтози - червоний, лактози - червоно-фіолетовий, рамнози - зелений, ксилози - світло-сірий, манози - світло-синій, арабінози - синьо-зелений.
У разі використання пластинок Silufol-UV плями вуглеводу виявляють під ультрафіолетовим світлом.
За допомогою планіметра визначають площу плям. Масу вуглеводу в пробі досліджуваного розчину (мкг) розраховують за формулою:
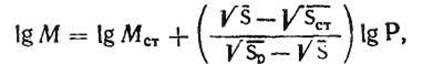
де МСТ - маса вуглеводу в пробі стандартного розчину;
SСТ, S, SР - площі плями стандарту; досліджуваного розчину і розбавленого досліджуваного розчину;
Р - фактор розведення.
Зробити висновок до роботи.
Лабораторна робота №11
Тема: кількісне визначення глюкози за допомогою антронового реактиву
Мета: визначити вміст глюкози за допомогою антронового реактиву
Гексози, дегідратуються у присутності концентрованої сірчаної кислоти при нагріванні, утворюють похідні фурфуролу, які при взаємодії з антроном перетворюються на сполуки, забарвлені в синій колір. Реакцію для глюкози можна представити у вигляді:
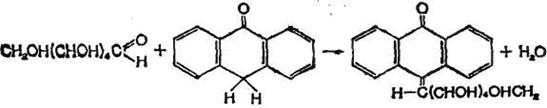
Визначаючи інтенсивність забарвлення на фотоелектроколориметрі стандартного і досліджуваного розчинів після проведення реакції, можна розрахувати вміст гексози в останньому.
Об'єкт дослідження: досліджуваний розчин глюкози (3- 30 мкг/см3)
Обладнання і посуд: пробірки, скляні палички, водяна баня, піпетки, бюретки, штатив для пробірок, термометр лабораторний, фотоелектроколориметр, годинник, ємність для льоду.
Реактиви: стандартний розчин глюкози (20 мкг/ см3), антроновий реактив (0, 2 г антрону, розчиненого в 100 см3 95 %-ного розчину сульфатної кислоти), крига.
Методика виконання роботи
В одну з пробірок поміщають 2, 5 см3 досліджуваного розчину глюкози, в другу - 2, 5 см3 стандартні розчини глюкози, а в третю - 2, 5 см3 дистильованої води. Вміст пробірок охолоджують, ставлячи їх на кригу. Потім в кожну пробірку вносять по 5 см3 свіжоприготовленого антронового реактиву, кип'ятять на водяній бані протягом 10 хв і знову охолоджують, опускаючи у воду (t 0-4 °С). Одержані розчини синього кольору в першій і другій пробірках колориметрують проти розчину реактиву (вміст третьої пробірки).
Масову концентрацію (мкг/ см3) розраховують за формулою:
С = С0 · E1/(E2 · V)
де E1 і Е2- екстинкція досліджуваного і стандартного розчинів;
С - масова концентрація глюкози в стандартному розчині;
V - об'єм досліджуваної проби.
Цей метод може бути використаний для визначення масової концентрації глікогену. Проводять реакцію гідролізу і концентрацію глюкози в досліджуваній пробі з глікогеном розраховують так само, як і у випадку глюкози, але для визначення масової концентрації глікогену одержане значення для глюкози необхідно помножити на 0, 9 (молекулярна маса залишку глюкози в глікогені - 162, 1; а глюкози- 180, 1; таким чином, 162, 1: 180, 1 = 0, 8999 = 0, 9).
Зробити висновок до роботи.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|