
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторна робота №4-5 1 страница
Державний вищий навчальний заклад
“Запорізький національний університет”
Міністерства освіти і науки, молоді та спорту України
ФІЗИЧНА ХІМІЯ БІОПОЛІМЕРІВ
Навчально-методичний посібник до самопідготовки та лабораторних робіт студентів біологічного факультету напряму підготовки “Хімія” денної форми навчання
Затверджено
вченою радою ЗНУ
Протокол №
від травня 2012
Запоріжжя
УДК
Фізична хімія біополімерів: Навчально-методичний посібник до самопідготовки та лабораторних робіт студентів біологічного факультету напряму підготовки “Хімія” денної форми навчання / Укладачі: Л. О. Омельянчик, Л. О. Гаврилова, Н. П. Лашко, Д. С. Коваленко. – Запоріжжя: ЗНУ, 2012. – 88 с.
Навчально-методичний посібник містить теоретичний матеріал, лабораторні роботи та запитання і задачі для самопідготовки студентів з фізичної хімії біополімерів.
Призначені для студентів біологічного факультету напряму підготовки “Хімія” денної форми навчання.
Рецензент Г. О. Чаусовський
Відповідальний за випуск М. П. Завгородній
Зміст
Вступ_ 5
Тема 1. Властивості розчинів біополімерів, як високомолекулярних сполук_ 6
Тема 2. В’язкість розчинів ВМС_ 15
Тема 3. Набухання високомолекулярних сполук_ 21
Тема 4. Термодинаміка розчинення високомолекулярних речовин_ 31
Тема 5. Дублення 35
Лабораторна робота № 1_ 52
Лабораторна робота № 2_ 53
Лабораторна робота №3_ 55
Лабораторна робота №4-5_ 57
Лабораторна робота №6_ 60
Лабораторна робота №7_ 62
Лабораторна робота №8_ 64
Лабораторна робота № 9_ 66
Лабораторна робота № 10_ 67
Лабораторна робота №11_ 69
Лабораторна робота №12_ 70
Лабораторна робота №13_ 71
Лабораторна робота №14_ 72
Лабораторна робота № 15_ 74
Лабораторна робота № 16_ 76
Приклади розв'язування задач_ 77
Задачі для самостійного розв'язування 80
Теоретичні питання до самостійної роботи_ 83
Глосарій_ 85
Література 88
Вступ
Фізична хімія займає провідне місце серед хімічних дисциплін. Разом з тим, фізична хімія тісно пов’язана з повсякденною практикою проведення технологічних процесів в різних галузях промисловості (хімічної, харчової, металургійної та ін. ).
В пропонованому навчально-методичному посібнику викладені теоретичні та практичні основи з курсу «Фізична хімія біополімерів» для студентів напряму підготовки «Хімія», в якому розглянуті такі розділи: властивості розчинів біополімерів, в’язкість розчинів високомолекулярних сполук, термодинаміка розчинення високомолекулярних речовин, дублення і та ін.
Мета навчально-методичного посібника з фізичної хімії біополімерів – навчити студентів на основі знань головних розділів фізичної хімії зв’язувати хімічні і фізичні явища; вміти оцінювати вплив зовнішнього середовища на властивості речовин, на швидкість протікання хімічних реакцій; навчити фізико-хімічним методам аналізу і вмінню за формулами, виведеними в різних розділах, вести розрахунки величин, що характеризують ту чи іншу систему.
Навчально-методичний посібник містить теоретичні, розрахункові та лабораторні розробки згідно навчальних планів І та ІІ модулів, з урахуванням сучасних тенденцій розвитку. Навчально-методичний посібник підготовлений для студентів з урахуванням їх хімічної та фізико-математичної підготовки. Теоретичний матеріал полегшує засвоєння курсу фізичної хімії біополімерів, та супроводжується тематично підібраними розв’язаними задачами і задачами для самостійного рішення.
Кожна тема також включає лабораторні роботи, які сприяють опануванню практичних навичок та закріпленню набутих теоретичних знань.
Тема 1. Властивості розчинів біополімерів, як високомолекулярних сполук
План:
1. 1. Природні біополімери.
1. 2. Одержання біополімерів.
1. 3. Деякі властивості високомолекулярних сполук (ВМС).
1. 4. Набухання та розчинення полімерів.
1. 5. Молекулярно-масові розподілення біополімерів.
1. 6. Драглі полімерів.
1. 7. Пластифікація полімерів.
1. 1. Природні біополімери
Полімери (від грец. Polys – багато, численний, і meros - частка, частина) - речовини, молекули яких складаються з великого числа повторюваних ланок (мономерів) і тому називаються також макромолекулами (від грецького слова makros - великий).
Це високомолекулярні сполуки, що володіють великою молекулярною масою (103 - 109 Дальтон).
Високомолекулярні сполуки (ВМС) - це сполуки, молекули яких складаються з великої кількості елементарних комірок. ВМС характеризуються ступенем полімеризації та молекулярною (молярною) масою. Ступінь полімеризації визначає число елементарних ланок, що містить одна макромолекула полімеру. Молекулярна маса - це маса однієї макромолекули, виражена в а. о. м. Молярна маса полімеру - це маса моля макромолекул (6, 02•1023 макромолекул) і виражена в г/моль.
Розміри макромолекул ВМС мають проміжне значення між розмірами молекул істинних розчинів і розміром частинок грубодисперсних систем. Хоч макромолекули ВМС мають розміри частинок колоїдних розчинів, їх термодинамічні властивості відповідають властивостям істинних розчинів. Процес розчинення ВМС є енергетично вигідним і супроводжується зменшенням вільної енергії Гіббса ( 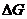 < 0).
< 0).
Біополімери - клас полімерів, що зустрічаються в природі і входять до складу живих організмів: білки, нуклеїнові кислоти, полісахариди. Біополімери складаються з однакових (або різних) ланок - мономерів. Мономери білків - амінокислоти, нуклеїнових кислот - нуклеотиди, полісахаридів - моносахариди.
Виділяють два типи біополімерів – регулярні (деякі полісахариди) та нерегулярні (білки, нуклеїнові кислоти, деякі полісахариди). Регулярні біополімери - речовини, що складаються з однакових мономерів. Нерегулярні біополімери - речовини, що складаються з різних мономерів. Відомі також змішані біополімери, наприклад ліпопротеїни (комплекси, що містять білки і ліпіди), глікопротеїни (з`днуються, в молекулах яких оліго- або полісахаридні ланцюги ковалентно пов'язані з пептидними ланцюгами), ліпополісахариди (сполуки, молекули яких побудовані з ліпідів, оліго-і полісахаридів).
1. 2. Одержання біополімерів
Природні високомолекулярні сполуки (ВМС) утворюються у живих організмах у результаті біосинтезу. Біополімери з рослинної, тваринної та мікробіологічної сировини виділяють екстракцією, фракційним осадженням, хроматографією, електрофорезом та іншими методами.
1. 3. Деякі властивості ВМС
ВМС володіють комплексом фізико-хімічних властивостей. Так, лінійні полімери утворюють міцні анізотропні волокна і плівки, можуть деформуватися, набухають перед розчиненням при додаванні відповідного розчинника, їх розчини мають виражену в'язкість. Молекули володіють гнучкістю.
ВМС можуть існувати у кристалічному та аморфному стані. Кристалічний стан виникає при періодичному чередуванні у макромолекулі довгих ділянок. Тут можуть виникати різні надмолекулярні структури (фібрили, сфероїди, монокристали та ін), які в аморфних ВМС виражені гірше, ніж в кристалічних. Аморфні ВМС бувають скловидні, високопластичні і в’язкотекучі. Полімери з низькою температурою переходу із склообразного стану у високоеластичний називають еластомерами, з високою температурою переходу - пластиками.
Полімери можуть вступати в різні хімічні реакції. Їх макромолекули розщеплюються на фрагменти. Наприклад, макромолекула білка гідролізується до амінокислот.
ВМС у відповідних розчинниках здатні утворювати розчини. Набухання передує розчиненню. Розчини ВМС можна назвати справжніми, оскільки в процесі розчинення виникають системи, в яких розчинена речовина представлена окремими молекулами. Утворюється стійка термодинамічна система.
За своїми властивостями ВМС схожі на звичайні колоїдні розчини. Між типовими колоїдними розчинами та ВМС є ряд спільних ознак: їх частинки близькі за розмірами, вони не проникають через напівпроникну мембрану, повільно дифундують, володіють багатьма подібними молекулярно-кінетичними, оптичними та електрокінетичними властивостями.
Однак, за низкою ознак розчини ВМС відрізняються від колоїдних. Так, ядро міцели ліозолей утворюється з багатьох тисяч і навіть мільйонів молекул низькомолекулярних речовин. В той же час дисперсна фаза розчину ВМС найчастіше утворена однією великою молекулою, що має дисперсність колоїдного розміру, а її форма представлена витягнутою ниткою, де довжина набагато більше ширини. У розчині така нитка скручується в пухкий клубок, який за формою нагадує витягнутий еліпсоїд.
Розчинення ВМС протікає без спеціальних стабілізаторів. Виникає стійка система. Для отримання ж золю та збереження його стійкості потрібен стабілізатор. Він у ряді випадків утворюється в ході хімічних реакцій.
Здатність ВМС розчинятися в тому чи іншому розчиннику залежить від співвідношення полярностей компонентів системи, фазового стану ВМС, гнучкості макромолекул і щільності їх упаковки.
З молекулярно-кінетичних властивостей розчинів ВМС найбільш виражені три – дифузія, осмотичний тиск і седиментація. Макромолекули ВМС мають розміри міцел золів. Вони володіють низькою дифузійною здатністю.
Осмотичний тиск розбавлених розчинів визначається рівнянням Вант-Гоффа
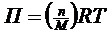 (1. 1)
(1. 1)
де n – кількість часток/м3.; М – молекулярна маса ВМС; R – газова постійна; Т – абсолютна температура.
У розчинів ВМС він вище, ніж за законом Вант-Гоффа. Причина цього – гнучкість молекул полімерів: чим гнучкіше молекула, тим більша відхилення від даного рівняння. Осмотичний тиск розчину ВМС зростає швидше, ніж концентрація. При збільшенні концентрації ВМС збільшується число сегментів, з яких складається його гнучка молекула.
Розчини ВМС стійкі до седиментації. Це пов’язано з низьким коефіцієнтом дифузії і високим ступенем сольватації, а також з малою густиною розчиненої речовини.
1. 4. Набухання та розчинення
Набухання передує розчиненню полімеру. Це відбувається в декілька стадій, внаслідок великої різниці швидкостей дифузії молекул біополімеру та низькомолекулярного розчинника.
1 Стадія – набухання, це проникнення молекул розчинника у простір між ланками полімерного ланцюга. Це і є набухання. Існує два види набухання: обмежене набухання (воно не завершується розчиненням полімеру ) та необмежене набухання (розчинення). Якщо полімер має сітчасту структуру – розчинення неможливо (обмежене набухання).
Кількісна характеристика набухання:
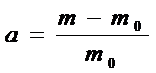 , (1. 2)
, (1. 2)
де а – ступінь набухання, m – наважка зразка, після набухання, m0 - наважка вихідного зразка.
Метод визначення ступеню набухання за вагою називається гравіметричним. Існує також об’ємний метод. У цьому методі у капіляр поміщують відомий об’єм вихідного зразка з відомим діаметром, а потім визначають об’єм набряклого зразку.
Швидкість набухання описується за допомогою рівняння, яке подібне кінетичному рівнянню необоротних реакцій першого порядку:
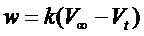 ,
,
де w – швидкість набухання, k – константа швидкості реакції набухання, V∞ - граничний об’єм набряклого зразка, Vt – об’єм зразка у момент часу t.
2 Стадія – розчинення.
Розчинення біополімерів – самочинний процес, що супроводжується зменшенням вільної енергії змішання Гіббса (∆ G< 0):
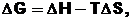 (1. 3)
(1. 3)
Ентальпія розчинення (Δ Н) залежить від природи розчинника. Наприклад, 1кг каучуку розчиняється у бензолі, бензині та хлороформі з відповідними Δ Н (кДж): 5, 7; 0, 4; -12, 5. Можна розрахувати Δ Н практично для будь-яких поєднань полімер-розчинник. Розрахувати ентропію розчинення (Δ S) можна лише для деяких типів розчинів.
Флорі та Хаггенс на основі квазікристалічної моделі розчину для атермічної системи (Δ Н=0) розрахували Δ S. Суть цієї моделі розчину: біополімер, що розчиняється, складається з визначеного числа ланок. Кожній ланці біополімеру відповідає певне число молекул розчинника, які можуть займати її місце. Якщо вважати перестановки молекул розчинника, та ланок полімеру рівними, тоді ентропію розчинення можна розрахувати, як термодинамічну вірогідність цього процесу за формулою Больцмана:
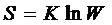 (1. 4)
(1. 4)
де, W-кількість однаково ймовірних мікростанів, що описують даний макростан системи.
К–постійна Больцмана.
Для атермічного розчину згідно теорії Флорі-Хаггенса ентропія розраховується за рівнянням:
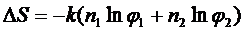 , (1. 5)
, (1. 5)
де n1 та n2 – кількість молей відповідно розчинниката полімеру, φ 1 та φ 2 – мольні долі розчинника та полімеру.
Для неатермічних розчинів:
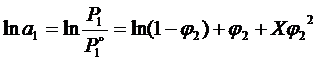 , (1. 6)
, (1. 6)
де а1 – активність розчинника, Р1 та Р1° - тиск пара над розчином та розчинником, Х – постійна Хаггенса, що залежить від взаємодії між полімером та розчином.
Теорія встановлює наступну залежність осмотичного тиску (П) від параметрів розчину ( для невеликих концентрацій):
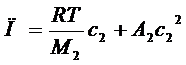 , (1. 7)
, (1. 7)
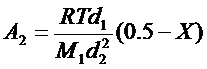 , (1. 8)
, (1. 8)
С2 – концентрація полімеру в розчині; М1 та М2 – молекулярні маси розчинника та полімеру; d1 та d2 - густина розчинника і полімеру.
Обмеженість теорії Флорі – Хаггенса пов’язана з тим, що вона не враховує ефект сольватації, а макромолекули розглядаються як гнучкі ланцюги, які можуть приймати будь-які конформації у розчині.
Флорі удосконалив теорію, відмовившись від квазікристалічної моделі.
Замість параметра Х вводиться інший параметр, що описує взаємодію між полімером та розчинником, χ (хи). На відміну від параметра Х параметр χ залежить від концентрації. Він містить ентальпійну χ Н та ентропійну χ S складові:
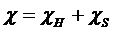 , (1. 9)
, (1. 9)
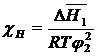 , (1. 10)
, (1. 10)
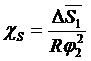 , (1. 11)
, (1. 11)
Де 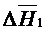 – надлишкова ентальпія змішування,
– надлишкова ентальпія змішування, 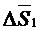 – надлишкова ентропія змішування.
– надлишкова ентропія змішування.
Добрий розчинник – це такий розчинник, що інтенсивно взаємодіє з полімерами, утворює розчини зі значним зниженням тиску пари та позитивним другим віріальним коефіцієнтом А2.
Поганий розчинник – зниження тиску пари незначне та другий віріальний коефіцієнт має негативне значення.
Квазіідеальний розчинник, або θ (тета) – розчинник, має другий віріальний коефіцієнт А2=0.
Якість розчинника характеризується параметром χ, для доброго розчинника χ < 0, 5.
Флорі ввів поняття θ (тета) – температури, яка відповідає стану системи розчинник-полімер, при якому другий віріальний коефіцієнт А2=0. При θ -температурі розбавлений розчин полімеру набуває властивості ідеального розчину. При цьому Δ G=0 та
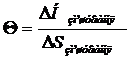 , (1. 12)
, (1. 12)
Розчинність молекул біополімерів в межах одного гомологічного ряду знижується з підвищенням молекулярної маси. Тому, додаючи до розчину полімеру визначенні порції рідини, у якій полімер не розчиняється, виділяють із розчину полімерну фракцію з меншою молекулярною масою.
Цей метод – метод фракціонування – використовується для встановлення їх молекулярно-масового розподілення полімерів.
1. 5. Молекулярно-масові розподілення біополімерів
Молекулярна маса – найважливіша характеристика біополімерів. Від неї залежать усі властивості речовини: еластичність, міцність, здатність до набухання та розчинення.
Як правило, полімери – суміш молекул різної ваги. Для побудування кривих молекулярно-масового розподілення вихідну суміш фракціонують різними методами – додаванням «поганого» розчинника, центрифугуванням, або гель-фільтрацією (хроматографією). Потім визначають масу кожної фракції.
Для спрощеної характеристики полімеру використовують середнє значення молекулярної маси: середньочисельну та середньовагову.
Середньочисельну молекулярну масу (Мn) визначають за формулою:
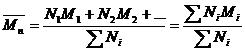 , (1. 13)
, (1. 13)
Де N1, N2, …., Ni.. – число молекул у 1, 2 та і-тих фракціях полімеру, М1, М2, …, Мі, – відповідні їм молекулярні маси, ∑ Ni – загальна кількість молекул у зразку.
Середньовагову молекулярну масу (Мm) вираховують за формулою:
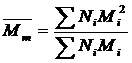 (1. 14)
(1. 14)
Тотожність двох видів молекулярних мас можливо тільки у випадку, коли полімер складається з однакових за масою молекул.
У загальному випадку Мm ≥ Мn. Відношення Мm/ Мn - міра полідисперсності полімеру.
Середня молекулярна маса нефракціонованого полімеру залежить від метода її визначення.
Методи визначення поділяють на 4 групи:
1. Хімічні методи – засновані на кількісному визначенні функціональних груп, якщо в молекулі даного полімеру є відоме, строго визначене число цих груп;
2. Термодинамічні методи – засновані на термодинамічних властивостях розбавлених розчинів полімерів (визначення осмотичного тиску, кріоскопія, ебуліоскопія);
3. Молекулярно-кінетичні методи – засновані на визначення швидкості дифузії, ультрацентрифугування, визначення в’язкості розчинів полімерів;
4. Оптичні методи – засновані на визначення світлорозсіювання у розчинах біополімерів.
З термодинамічних методів зручним є метод визначення осмотичного тиску.
Для полімерів осмотичний тиск (П) дорівнює:
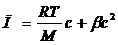 , (1. 15)
, (1. 15)
С – концентрація розчину полімеру, β – коефіцієнт, що враховує молекулярні сили зчеплення.
Вимірюють осмотичний тиск у ряді розчинів різних концентрацій. Далі вираховують графічно молекулярну вагу (М). Для цього ліву та праву частини у рівнянні для осмотичного тиску ділять на с:
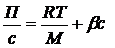 , (1. 16)
, (1. 16)
Це рівняння прямої лінії. Потім будують пряму лінію у координатах 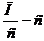 . Пряма відсікає на осі 0Y відрізок, який дорівнює
. Пряма відсікає на осі 0Y відрізок, який дорівнює 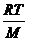 . Звідси знаходять М.
. Звідси знаходять М.
З молекулярно-кінетичних методів широко використовується метод ультрацентрифугування та вискозіметричний метод.
Вискозіметричний метод: спочатку визначають в’язкість чистого розчинника, та в’язкість розчинів (η ). Потім знаходять відносну η:
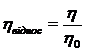 , (1. 17)
, (1. 17)
та приведену η:
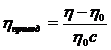 , (1. 18)
, (1. 18)
Якщо макромолекула – клубок, радіус якого пропорційний М, то η прив~М1/2
Межа приведеної в’язкості (η прив) при концентраціях полімеру, що наближається до 0, називається характеристичною в’язкістю [η ]. Для реальних розчинів справедливо рівняння Марка-Хаувікка:
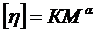 , (1. 19)
, (1. 19)
де К та α – постійні для даного гомологічного ряду (α ≈ 0, 6 – 0, 8). Залежність між характеристичною в’язкістю, приведеною в’язкістю та концентрацією показує рівняння Хаггенса:
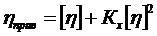 , (1. 20)
, (1. 20)
де [η ] – характеристична в’язкість, Кх – константа Хаггенса;
та рівняння Кремера:
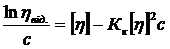 , (1. 21)
, (1. 21)
де Кк – константа Кремера.
Обидві константи пов’язані Кх+ Кк ≈ 0, 5. Рівняння 1. 20 та 1. 21 виконуються при умові, що η прив< 1, 5.
Молекулярна маса, яка знайдена вискозіметричним методом, відрізняється від середньочислової та середньовагової. Вона називається середньов’язкісною 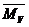 . Для суміші полімерів гомологів її знаходять за формулою:
. Для суміші полімерів гомологів її знаходять за формулою:
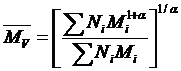 , (1. 22)
, (1. 22)
Із оптичних методів широко використовується метод світлорозсіювання.
Для макромолекул, розміри яких наближаються до довжини світлової хвилі, Дебай запропонував ввести поправку Р(θ ), яка залежить від кута розсіювання θ та форми частинки. Рівняння з поправкою Дебая:
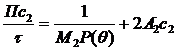 , (1. 23)
, (1. 23)
А2˙ - другий віріальний коефіцієнт, с2 – концентрація розчину, τ – коефіцієнт каламутності.
Поправку Р(θ ) знаходять, проводячи вимірювання при кутах, симетричних 90°(наприклад, 120°: 60°, 135°: 45°). Потім вираховують відношення розсіювання світла при цих кутах [z]. Залежність Р(θ ) від [z] дані у спеціальних таблицях.
Більш точніший метод Зимма: виміряють інтенсивність розсіювання світла у широкому діапазоні кутів при різних концентраціях. Величину 1/М2 знаходять, одночасно екстраполюючи до нульових концентрацій та нульових кутів розсіювання.
1. 6. Драглі полімерів
Драглі – це системи, що позбавлені плинності, у яких низькомолекулярна рідина молекулярно-диспергована у полімері, що має поперечні зв’язки. Драглями є набряклі у розчиннику полімери, що мають просторову структуру.
Драглі утворюються при взаємодії полімеру, що має не дуже часту сітку, з низькомолекулярною рідиною, здатною викликати його обмежене набухання. З підвищенням концентрації розчину вірогідність утворення драглів підвищується. Драглі утворюються при полімеризації або при поліконденсації у розчині, якщо при цьому утворюються сітчасті полімери.
Природа молекулярних зв’язків у драглях грає важливу роль. Драглі, що утворені за рахунок хімічних зв’язків, є одною фазою, термодинамічно стійкою системою. Такі драглі не переходять у плинний стан при нагріванні, тобто під дією температури драглі не плавляться до руйнування.
Драглі, що утворені міцними міжмолекулярними зв’язками нехімічного характеру є термодинамічно нестійкими системами.
Для драглів характерні дуже складні релаксаційні явища: міжмолекулярні зв’язки затримують перегрупування частин гнучких макромолекул, при деформуванні драглі можуть виявляти себе або як склоподібне, або як високоеластичне тіло.
1. 7. Пластифікація полімерів
Одним зі способів структурної модифікації полімерів є пластифікація. Механічна пластифікація, що полягає у витяжці вздовж однієї осі або всієї площини полімерних плівок, також підвищує міцність полімерів.
Крім того, введення в полімер пластифікаторів (у твердому або рідкому стані) зміщує температуру текучості і склування в область більш низьких температур, зменшує модуль пружності полімерів, а також впливає на інші властивості, наприклад міцність, діелектричні властивості та ін.
У якості прикладів хімічної пластифікації полімерів, основна мета якої - підвищення деформації полімеру, можна навести пластифікацію, що здійснюється введенням в полімер олігомерних або полімерних продуктів. Введення таких речовин можливе не тільки механічним шляхом – змішуванням, але і хімічним зв'язуванням, наприклад за допомогою сополімеризації.
Пластифікація полімерів багато в чому змінює їх механічні властивості. Еластичність і вимушена еластичність полімерів зростають. Невелика кількість пластифікаторів приводить і до підвищення механічної міцності, проте при зростанні їх концентрації міцність полімерів знижується.
Аналогічно змінюється при підвищенні концентрації пластифікатора і температури крихкості. Зазвичай помірна пластифікація підвищує температуру крихкості, і тільки при введенні дуже великої кількості пластифікатора вона знижується.
Проникнення молекул пластифікатора між макромолекулами або надмолекулярними структурами полімеру змінює міжмолекулярну взаємодію. Отже, збільшується структурний коефіцієнт γ (величина енергії активації залишається та сама), а значить знижується довговічність полімерів.
Велику роль у практичному здійсненні пластифікації відіграє сумісність пластифікатора і полімеру, тобто їх здатність до утворення істинного розчину. Кращим прикладом є утворення термодинамічно стійкої гомогенної системи, що дає можливість варіювати в широкому діапозоні концентрацією пластифікатора.
Термодинамічна спорідненість пластифікатора і полімеру визначається величиною тиску набухання полімеру в пластифікаторі.
Механізм молекулярної пластифікації різний для полярних та неполярних компонентів. При взаємодії з полярними пластифікаторами, або, що те ж саме, полярних розчинників з полярними полімерами, величина, зниження температури склування пропорційна не масовій кількості сорбованого пластифікатора, а числу його молекул, що утримуються полімером незалежно від форми і розмірів молекул пластифікатора
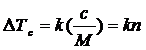 , (1. 24)
, (1. 24)
де Δ Тс - зниження температури склування; с - концентрація; k- коефіцієнт, що не залежить від природи розчинника; п - число сорбованих молекул пластифікатора.
Таким чином, механізм пластифікації зводиться до блокування молекулами пластифікатора активних груп полімерних ланцюгів, які здійснювали диполь-дипольні взаємодії у полімері до введення пластифікуючих компонентів.
Наведене вище рівняння вказує на прямо пропорційну залежність між зниженням температури склування і кількістю молей введеного в полімер пластифікатора, і називається правилом Журкова, або правилом мольних концентрацій.
За цим правилом ефект пластифікації полярного полімеру, що оцінюється величиною зниження Тс, визначається числом молей полярного пластифікатора, введеного у полімер, незалежно від його хімічної природи та розмірів молекул.
Промислова переробка полімерів використовує також метод пластифікації високомолекулярними сполуками. Цей метод супроводжується незначним падінням міцності матеріалу навіть при великих концентраціях полімеру, який виконує функції пластифікатора. Важливою умовою використання високомолекулярних сполук при пластифікації є їх сумісність, тобто можливість утворення істинного розчину одного полімеру в іншому. Якщо такої сумісності немає, то з розшаруванням системи матеріал каламутніє, різко погіршуються його фізико-механічні властивості.
Пластифікація полімерів знайшла широке застосування у багатьох галузях народного господарства, у тому числі і в легкій промисловості. Нею користуються для розширення асортименту полімерів, що використовуються у взуттєвій промисловості, для виготовлення штучної шкіри, клеїв, оздоблювальних матеріалів та ін. В даний час найбільш широке застосування в якості пластифікаторів знайшли наступні типи хімічних сполук: фталати, фосфати, адіпінати і себацинати, епоксидній і поліефірні смоли.
Загальними вимогами, що пред'являються до пластифікаторів, є:
1. Можливість використання пластифікатора в широкому інтервалі концентрацій і температур. Якщо пластифікатор обмежено сумісний, то при певній температурі можливо його відділення від полімеру, «випотівання» на поверхні виробу або на інші поверхні. Це не тільки може погіршити якість виробів, але і зробити їх непридатними до використання (наприклад, надати клейкість, липкість).
2. Нелетючість, стійкість до випаровуванню в умовах експлуатації. Це важлива вимога, тому що для багатьох полярних полімерів (наприклад, білків) дуже хорошим пластифікатором є вода, але її леткість перешкоджає широкому практичному застосуванню для постійної пластифікації.
3. Низька температура плавлення, або власна морозостійкість пластифікатора.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|