
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторна робота №4-5 2 страница
4. Стійкість до старіння під дією світла, теплоти, кисню повітря, вологи та ін. Якщо пластифікатор “нестійкий до старіння”, то він відповідно знижує опір старіння виробу, незалежно від стійкості основного полімеру, з якого виготовлено виріб.
Тема 2. В’язкість розчинів ВМС
План:
2. 1. В’язкість розчинів ВМС.
2. 2. Поліелектроліти.
2. 3. Білки як поліелектроліти.
2. 4. Ізоелектрична точка білків.
2. 5. Колоїдний захист.
2. 6. Біологічне значення онкотичного тиску.
2. 1. В’язкість розчинів ВМС
В’язкість розчинів ВМС відрізняється від в’язкості золів та істинних розчинів. У низькомолекулярних розчинів та золів існує пропорційна залежність між концентрацією та в’язкістю. (рис. 2. 1)
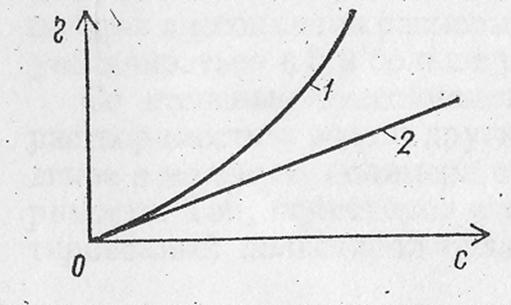
Рис. 2. 1- Залежність в’язкості розчинів ВМС та колоїдів від концентрації.
1- розчин полімеру; 2- золь.
У розчинів ВМС зі збільшенням концентрації в’язкість непропорційно зростає. Таке зростання відбувається внаслідок збільшення об’єму дисперсної фази розчину ВМС в результаті її гідратації та наявності у системі гнучких молекул. Великі набряклі молекули ВМС збільшують силу тертя між шарами.
Розбавлені розчини (концентрація ~ 1%) мають в’язкість, яка перевищує в 18-20 разів в’язкість чистого розчинника. В’язкість розчинів ВМС в середньому перевищує в’язкість розчинників на 13-15 порядків. Макромолекули у розчині згинаються, утворюють клубки і обертаються в потоці. Це збільшує тертя сегментів макромолекули об молекули розчинника. Механізм тертя концентрованих розчинів ВМС наближується до механізму зміщення самих полімерів.
Г. Штаудингер (1881-1965) запропонував формулу визначення в’язкості розчинів ВМС з урахуванням того, що у ньому молекули полімеру не взаємодіють між собою (для розбавлених розчинів):
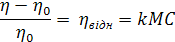 (2. 1)
(2. 1)
де η – в’язкість розчину; η 0 – в’язкість розчинника; η відн – відносна в’язкість; k – константа для кожного полімеру гомологічного ряду; М – молекулярна маса полімеру; С – концентрація розчину, виражена в „основних молях” на літр („основний моль” – число грамів полімеру, яке чисельно дорівнює масі мономера).
В’язкість розчинів ВМС залежить від природи розчинника. В різних розчинниках вона відрізняється в 1000 і більше разів. В розчинниках, які мають хімічну спорідненість з полімером, вона більше, ніж у тих, де полімер погано розчиняється. В цьому випадку сольватація макромолекул незначна та вони згортаються в клубок.
Зростання температури веде до зменшення в’язкості розчинів ВМС. Так, у біополімерів (наприклад, білків) мінімальна в’язкість спостерігається в ізоелектричній точці. Мінімальна в’язкість з’являється при максимальній іонізації макромолекули. Додавання до розчину ВМС протилежно заряджених іонів збільшує його в’язкість. В’язкість розчинів ВМС зростає зі збільшенням тиску, так як відбувається орієнтація частинок паралельно потоку та руйнуються глобулярні утворення макромолекул. Зростання концентрації розчину викликає утворення асоціатів з макромолекул, а це перешкоджає потоку розчину та збільшує в’язкість. Такі структури розпадаються при зростанні температури, струшуванні та перемішуванні.
2. 2. Поліелектроліти
Поліелектроліти – це полімери, до складу молекул яких входять групи, які здатні до іонізації в розчині. До поліелектролітів відносяться білки, нуклеїнові кислоти, полісахариди. Більшість поліелектролітів містить слабкі кислотні чи основні групи. При цьому ланцюжок полімеру набуває заряд (позитивний або негативний), а дисперсійне середовище заряджається протилежно (противоіонами). За природою іоногенних груп розрізняють три групи поліелектролітів:
1. Полімерні кислоти – молекули містять кислотні групи.
2. Полімерні основи – молекули містять основні групи.
3. Поліамфоліти – молекули містять одночасно основні і кислотні групи.
На особливу увагу заслуговують «зшиті» поліелектроліти, які отримують шляхом введення в сітчасті полімери легко дисоціюючих груп (наприклад, сульфоаміногруп). До них відносяться іонообмінні смоли, полівалентний каркас яких можна розглядати як багатоядерний величезний іон, що приймає у свої комірки малі рухливі противойони.
Поліелектроліти, окрім білків, володіють високою щільністю вмісту іоногенних груп. Так, у молекулі поліелектроліту на одну складову ланку ланцюга полімера в середньому припадає одна іоногенна група. Властивості молекул поліелектролітів у розчині визначаються електростатичною взаємодією заряджених груп низькомолекулярних іонів розчину. Молекули поліелектролітів володіють сильним електростатичним полем. Воно і утримує поблизу молекули поліелектроліту велику кількість противойонів. Їх число часто складає більше половини числа заряджених груп ланцюга. Якщо в розчин поліелектроліту додати сіль, то число противойонів практично не змінюється. Койони (іони того ж знаку, що і іони полимеру) не зв’язуються. Існує правило Мок-Марешаля: при нuзьких концентраціях noліелектроліту активність противойонів в розчині в nрисутності солі дорівнює їх активності у відсутності солі nлюс активність однойменно заряджених іонів у відсутності noліелектролітів. Це позначається на осмотичному тиску: осмотичний тиск розчину поліелектроліту і низькомолекулярної солі дорівнює сумі їх осмотичних тисків при однакових концентраціях.
Багато властивостей поліелектролітів залежить від міри їх іонізації. Додавання тих або інших електролітів може змінити ступінь іонізації поліелектроліту. Зі збільшенням ступеню дисоціації розміри молекул поліелектролітів можуть збільшуватись в 5 та більше разів.
Зі ступенем дисоціації поліелектролітів пов’язана їх розчинність у воді та інших полярних розчинниках. Введення в молекулу полімеру іонних груп збільшує його розчинність.
2. 3. Білки як поліелектроліти
Білки - найважливіші біополімери, з діяльністю яких пов’язані всі процеси існування живої матерії на Землі. Білки побудовані із залишків амінокислот, з’єднаних між собою пептидними зв'язками. Амінокислоти є амфотерними електролітами, молекули яких містять карбоксильну (-СООН) й аміну (-NH2) групи. У вміст різних білків входить в основному 20 амінокислот. Схематично молекулу білка можна представити як NH2-R-СООН, де R - залишок молекули білка без функціональних груп. Цей залишок виникає в результаті взаємодії з багатьма тисячами амінокислот:
NH2 – R’ – COOH + HNH – R” – COOH + HNH – R”’ – COOH → NH2 – R’ – CONH – R” – CONH – R”’ – COOH + 2H2O
Молекулярна маса білків коливається від 5700 (інсулін) до 322 000 000 (білок вірусу грипу). У молекулі білка є одна або декілька поліпептидних ланцюгів, що мають вигляд спіралей, закріплених між собою внутрішньомолекулярними водневими зв'язками. Розрізняють чотири рівні структурної организації молекули білка - первинний, вторинний, третинний і четвертинний. Є дві основні форми молекули білка - глобулярна (кулевидна) і фібрилярна (витягнута). У фібрилярних молекул білків довжина макромолекули в тисячі разів перевищує товщину. Так, довжина молекул проколагену - 300 нм, ширина - десяті долі нанометра, а довжина молекул глобулярних білків - 30 нм, ширина - 20-30 нм.
На поверхні молекули білка є велика кількість гідрофільних груп, що створюють оболонку гідрату. Гідрофобні частини молекули в основному розміщуються всередині. При формуванні молекули білка деяка частина молекул води залучається всередину її і складає інтерміцелярну воду. Між молекулами білка циркулює вода, яка називається інтерміцелярною.
Білки є амфолітами. У водному середовищі молекула білка дисоціює на іони як звичайний електроліт. Так, при дисоціації карбоксильних груп молекули білка проявляють властивості кислоти, а при дисоціації аміногруп – властивості основ.
Ці властивості виявляються при взаємодії білка з кислотами і основами. Так, якщо у розчин білка додати сильну кислоту, то карбоксильні групи молекул білка не можуть дисоціювати і макромолекула набуває позитивного заряду. Якщо у розчин білка додати основу, то білок проявляє властивості кислоти, макромолекула набуває негативного заряду (дисоціюють карбоксильні групи).
В даний час відомо понад 3000 білків. Вони діляться на прості (протеїни) і складні (протеїди). При гідролізі простих білків, в основному, утворюються амінокислоти; при гідролізі складних білків утворюються прості білки (а з них амінокислоти) і простетичні групи. За хімічною природою простетичних груп складні білки поділяють на нуклеопротеїди, фосфопротеїди, хромопротеїди, ліпопротеїди, глікопротеїди і металопротеїди.
За хімічними властивостями білки можуть бути кислими, нейтральними і основними. Кислі властивості білків проявляються тоді, коли до складу їх молекул переважно входять залишки моноамінодикарбонових кислот (аспарагінова і глутамінова), а до складу складних білків, окрім цього, ще і кислотні функціональні групи (наприклад, у фосфопротеїдах - ортофосфорной кислоти). Основні властивості білків-протеїнів залежать від наявності у складі їх молекул великої кількості залишків діаміномонокарбонових амінокислот (наприклад, аргініну, лізину), а в складних білках, окрім цього, ще і простетичних груп, що володіють основними властивостями. Нейтральні білки в молекулах мають однакову кількість основних і кислотних груп.
Молекули кислих білків у воді заряджають негативно, оскільки відщеплення від молекули кожного іона Н+ надає полімеру один негативний заряд. Молекула основного білка у воді заряджається позитивно. Білки, що володіють в однаковій мірі основними і кислотними властивостями, у водному розчині відщеплюють і приєднують однакову кількість іонів Н+, що обумовлює їх нейтральність.
Процесом відщеплення і приєднання іонів водню молекули білка можна управляти. Так, якщо збільшити концентрацію іонів водню в розчині білка (наприклад, додати кислоти), то рівновага реакції зміститься вліво і негативний заряд молекули білка зменшиться:
NH2-R-COOH ↔ NH2-R-COO- + Н+.
Якщо в розчині основного білка збільшити концентрацію іонів водню, то рівновага реакції зміститься вправо і позитивний заряд молекули зросте:
HOOC – R - NH2 + H+ ↔ HOOC – R - NН3+.
2. 4. Ізоелектрична точка білків
Як вже наголошувалося, заряд молекули білка залежить від реакції середовища (рН) і змінюється із зміною цієї реакції. У випадку, коли кількість позитивних та негативних зарядів в молекулі білка буде рівна, то сумарний поверхневий заряд молекули (електрокінетичний потенціал) в цьому стані наближається до нуля. Такий стан молекули білка називається ізоелектричним, а значення рН розчину, що відповідає такому стану, називається ізоелектричною точкою білка (ІЕТ). Кожен білок має своє значення ІЕТ.
У середовищах, де рН< ІЕТ, іони водню протонують карбоксильні групи і молекула білка заряджається позитивно. У середовищах, де рН> ІЕТ, молекула білка заряджена негативно, тому що протонуються аміногрупи білка.
В ізоелектричному стані молекули білка мають інші властивості, ніж у звичайному стані. Так в умовах ІЕТ білки не володіють електрофоритичною рухливістю, характеризуються мінімальною стійкістю, розчинністю, гідратацією, в'язкістю, осмотичним тиском, електропровідністю, мірою набухання, питомим оптичним обертанням і мембранним потенціалом. В умовах ІЕТ відбувається максимальна коагуляція білкових розчинів і вони мають найвищу швидкість желатинування.
ІЕТ білка визначається прямими і непрямими методами. До прямих методів відносяться методи, при яких визначається рН розчина білка, коли рухливість частинок в постійному електричному полі дорівнює нулю (електрофоретичні методи). Непрямі методи засновані на встановленні рН розчину, при якому мінімальне значення мають в’язкість та набухання, і максимальні – каламутність і осадження білка.
Вивчення ІЕТ багатьох колоїдів організму людини і тварин представляє великий інтерес для діагностики захворювань і оцінки змін, що відбуваються в організмі, органах, тканинах, клітинах і субклітинних структурах. Між ІЕТ, стабільністю колоїдів і інтенсивністю обміну речовин і енергії існує певна кореляція.
2. 5. Колоїдний захист
Стійкість ВМС до дії електролітів використовується для колоїдного захисту. Колоїдний захист – це підвищення стійкості ліофобних золів і грубодисперсних систем по відношенню до електролітів. Він досягається шляхом додавання до таких систем високомолекулярних сполук і, перш за все, білків, молекули яких адсорбуються на поверхні міцел золів або частинок грубодисперсних систем, сольватуються, що і надає стійкості дисперсним системам.
Захисними властивостями володіють багато білків (желатин, яєчний і сироватковий альбумін, казеїн), полісахариди (крохмаль, декстрин), деякі напівколоїди (стеарат і олеат натрію), сапоніни і ін.. Захисні властивості білків найчастіше характеризуються «золотим числом». «Золотим числом» називається така кількість міліграм захисного колоїду, якої достатньо для того, щоб запобігти зміні червоного кольору у фіолетовий у 10 мл золя золота при додаванні до нього 1 мл 10 %-гo розчину NаCl. Чим менше «золоте число», тим сильніше захисна дія колоїду.
Колоїдному захисту належить важлива роль в біології, медицині, ветеринарії. Так, карбонати і фосфати кальцію утримуються в біологічних рідинах в певних концентраціях завдяки захисній дії білків. Білки сироватки крові збільшують розчинність СаСО3 майже в 5 разів і сіль знаходиться в захищеному вигляді. Утворення жовчних і ниркових каменів пов'язане з недостатньою захисною дією муцинів і інших речовин, що синтезуються слизовими оболонками жовчо- і сечовивідних шляхів. Патологічні відкладення деяких речовин в тканинах при подагрі пов'язані з порушеннями захисних властивостей білків. Те ж саме спостерігається і при виникненні артеросклерозу, коли на стінках кровоносних судин виникають осади стеринів, стеридів і інших речовин.
Колоїдний захист застосовується для одержання стійких в часі лікарських препаратів. Прикладом можуть слугувати бактерицидні препарати протаргол і коларгол, частинки яких представляють собою міцели гідрозолю срібла, захищені білками. Захист колоїдів використовується в промисловому каталізі для одержання стабільних розчинів золів благородних металів, при приготуванні фотографічних емульсій та змащувальних засобів.
2. 6. Біологічне значення онкотичного тиску
Онкотичний тиск - доля осмотичного тиску в біологічних рідинах, що обумовлено наявністю в них високомолекулярних сполук (білків, нуклеїнових кислот, полісахаридів). У плазмі крові він складає лише 0, 5 % осмотичного тиску (0, 003 - 0, 004 МПа). Осмотичний тиск крові домашніх тварин дорівнює 0, 68-0, 74 МПа. Він залежить від наявності в крові мінеральних солей (NaCl, CaC12 і ін. ), глюкози і інших речовин. Не дивлячись на невелику долю онкотичного тиску в осмотичному тиску (0, 5%), він має виключно велике значення для життя організму.
Онкотичний тиск, перш за все, бере участь в розподілі води і розчинених в ній речовин між кров'ю і тканинами. Такий розподіл здійснюється капілярами. Стінка капіляра є напівпроникною мембраною, через пори якої вода і розчинні низькомолекулярні речовини проникають в міжклітинну рідину і з неї ж вони повертаються у зворотному напрямку. Стінка непроникна для білків плазми, які транспортують ці речовини. Швидкість такої фільтрації визначається різницею між онкотичним тиском білків плазми крові і гідростатичним тиском крові, що створюється роботою міокарду. Капіляр має два кінця - артеріальний і венозний. Через артеріальний кінець капіляру розчин живильних речовин з крові поступає в міжклітинну рідину, а із неї – у клітини.
Тема 3. Набухання високомолекулярних сполук
План:
3. 1. Явище набухання полімерів. Значення в природі та техніці.
3. 2. Вплив форми макромолекул полімерів.
3. 3. Ентропійний характер набухання.
3. 4. Стадії набухання та розчинення полімерів.
3. 1. Явище набухання полімерів. Значення в природі та техніці
Набухання - це самочинний процес поглинання низькомолекулярної рідини високомолекулярною речовиною, що супроводжується збільшенням її маси і об'єму.
Для оцінки якості деяких продуктів у товарознавстві широко використовують їх здатність до набухання. Печиво доброї якості повинно швидко і значно набухати у воді. Споживчі якості круп визначаються за їх здатністю поглинати воду при варінні. За ступенем набухання хліба визначається його свіжість. Відомо, що сушені плоди та овочі з низьким ступенем набухання погано розварюються і мають знижені споживчі властивості.
Набухання — вибіркове явище, тобто полімери здатні набухати в тих рідинах, які для них служать розчинниками. Желатин набухає у воді, каучук, гума - у вуглеводневих рідинах. Розрізняють два види набухання - необмежене і обмежене.
Необмежене набухання - це набухання, що переходить у повне розчинення (наприклад, каучук в бензолі, бензині). При обмеженому набуханні не відбувається повне розчинення, набухання йде до певного визначеного (максимального) значення і подальший контакт з розчинником не змінює ні маси, ні об'єму полімеру (наприклад, набухання желатину у воді при кімнатній температурі, гуми в бензині).
3. 2. Вплив форми макромолекул полімерів
Розчинення високомолекулярних речовин з лінійними гнучкими молекулами, на відміну від розчинення низькомолекулярних сполук, супроводжується набуханням, або, вірніше, набухання таких речовин є першим етапом їх розчинення. При набуханні високомолекулярна речовина поглинає низькомолекулярний розчинник, значно збільшується в масі, при цьому змінює механічні властивості без втрати однорідності. Об'єм високомолекулярної речовини при набряканні може збільшуватися на 1000-1500%.
Набухання має велике значення в природі і техніці. Воно лежить в основі таких процесів, як клейстеризація крохмалю, мерсеризація в текстильній технології. Ряд явищ в організмах тварин і рослин також можна пояснити набуханням.
Причиною набухання є те, що при розчиненні відбувається не тільки дифузія молекул речовини, що розчиняють, в розчинник (як це має місце при розчиненні низькомолекулярних речовин), але, головним чином, дифузія молекул розчинника в високомолекулярну речовину. Останнє пов'язане з тим, що макромолекули в звичайних аморфних високомолекулярних речовинах упаковані порівняно нещільно і в результаті теплового руху гнучких ланцюгів між ними періодично утворюється не великий простір, в який можуть проникати молекули розчинника. Оскільки рухливість молекул розчинника у багато разів більша за рухливість макромолекул, то спочатку, головним чином, відбувається дифузія молекул розчинника в полімер, що супроводжується збільшенням об'єму останнього, і лише потім макромолекули, зв'язок між якими сильно ослабився, відриваються від основної маси речовини і дифундують в середовище розчинника, утворюючи однорідний справжній розчин.
Відмітимо, що оскільки розчинність пов'язана з рухом в розчині не всієї макромолекули, а тільки її сегментів, то вона не повинна залежати від молекулярної маси полімеру. Проте молекулярна маса значно впливає на швидкість розчинення. Чим менша молекулярна маса, тим більше розчинення полімеру схоже на розчинення низькомолекулярної речовини. Відомо, наприклад, що деструктурований каучук розчиняється без набухання. Навпаки, із збільшенням молекулярної маси розчинення полімерів сповільнюється. При незначній швидкості розчинення, яка спостерігається, коли молекули полімеру дуже великі, може навіть створитися неправильне уявлення про його нерозчинність. Якщо молекули полімеру жорсткі, тобто якщо довжина сегменту практично дорівнює довжині всього ланцюга, розчинність завжди повинна залежати від ступеню полімеризації.
Відомо, що високомолекулярні речовини зі сферичними молекулами при розчиненні не набухають, або набухають дуже слабо. В якості типового прикладу можна привести глікоген, що складається із глобулярних молекул. Зразки глікогену, що володіють вельми великою молекулярною вагою 800 000, при розчиненні не набухають. Це вказує, на те що дифузія не може розглядатися, як єдиний фактор, що управляє набуханням. Відсутність здібності набухати у речовин зі сферичними макромолекулами пояснюється тим, що когезійні сили, що діють на сферичну молекулу (завдяки її порівняно невеликій поверхні) завжди менші, ніж ті ж сили, що діють на лінійну макромолекулу. Завдяки малій когезійній енергії високомолекулярні речовини зі сферичними молекулами розчиняються краще.
Описана картина набухання високомолекулярних сполук з лінійними макромолекулами спостерігається в простому випадку, коли набухання і розчинення носять майже чисто ентропійний характер, наприклад при розчиненні каучуків у вуглеводнях. Коли молекули розчинника енергійно взаємодіють з молекулами високомолекулярної речовини, як, наприклад, при розчиненні желатину у воді, механізм розчинення ускладнюється. В цьому випадку можна вважати, що розчинення протікає в дві стадії, хоча, звичайно, друга стадія практично починається раніше закінчення першої.
На першій стадії набухання відбувається сольватація макромолекул в результаті дифузії розчинника у високомолекулярну речовину. Ця стадія характеризується виділенням тепла і впорядковуванням розташування молекул розчинника біля макромолекул, внаслідок чого ентропія системи на першій стадії розчинення, зазвичай, навіть знижується. Основне значення цієї стадії при розчиненні зводиться до руйнування зв'язків між окремими макромолекулами, внаслідок чого ланцюги стають вільними і здатні здійснювати тепловий рух в цілому.
Другою стадією є набухання, або розчинення, обумовлене тільки ентропійними причинами. На цій стадії, оскільки сольватація вже завершилася, тепловий ефект дорівнює нулю, або навіть має негативне значення, а ентропія різко зростає внаслідок зсуву громіздких і гнучких макромолекул з малими молекулами розчинника. Другу стадію розчинення можна розглядати як чисто осмотичний процес.
На набухання і розчинення полімерів впливає їх фізичний стан. Звичайно, найлегше набухають і розчиняються полімери у в’язкотекучому і високоеластичному стані, коли молекули пов'язані одна з одною не міцно. Значно важче розчиняються полімери, що знаходяться в скловидному стані. В цьому випадку спочатку, при контакті полімеру з розчинником, молекули розчинника проникають у поверхневий шар полімеру, що призводить до його поверхневого набухання. Далі полімер, що набряк, розчиняється так само, як і високоеластичний полімер. Межа розділу між твердим полімером, в який ще не проник розчинник, і набряклим його шаром поступово просувається всередину полімеру зі швидкістю дифузії розчинника.
Найважче проходить розчинення кристалічних полімерів. З розчинником, в першу чергу, взаємодіятимуть невпорядковані області таких полімерів. В кристалічну область розчинник зможе проникати, якщо він екзотермічно взаємодіє з полімером, так як руйнування кристалічних областей завжди супроводжується значним поглинанням тепла. В протилежному випадку систему необхідно нагрівати для розчинення кристалічної частини.
Набухання не завжди закінчується розчиненням. Дуже часто після досягнення відомої міри набухання процес завершується. Одна з причин такого явища може полягати в тому. що високомолекулярна речовина та розчинник здатні змішуватися обмежено. Тому в результаті набухання в системі утворюються дві фази - насичений розчин полімеру в розчиннику (власне розчин) та насичений розчин розчинника в полімері (гель). Таке обмежене набухання носить рівноважний характер, тобто об'єм, який набряк, на межі високомолекулярної речовини може необмежено довго залишається незмінним, якщо тільки в системі не стануться хімічні зміни. Прикладами набухання, обумовленого обмеженим розчиненням, є набухання полівінілхлориду в ацетоні та поліхлоропрену в бензолі. Слід зазначити, що обмежене набухання, дуже часто при зміні умов досліду переходить в необмежене. Так. желатин і агар, які набухають обмежено в холодній воді, в теплій воді набухають необмежено.
В даний час ще неможливо точно встановити зв'язок між природою розчинника і його здатністю розчиняти дану високомолекулярну речовину. Зазвичай обмежуються емпіричним правилом - подібне розчиняється в подібному. Іншими словами, неполярні полімери розчиняються в неполярних розчинниках. а полярні - в полярних. Джі встановив зв'язок між здатністю розчинників викликати набухання і розчинення полімеру та значеннями щільності когезіонних енергій цих розчинників. Питома щільність когезіонної енергії Е/Vмол (де Е - когезіонна енергія або прихована теплота випаровування; Vмол — молярний об’єм) представляє собою енергію, яку необхідно витратити на те, щоб розсунути молекули, які містяться в 1 см3 полімеру, на відстань, що виходить за сферу їх дії. На ряду прикладів було показано, що максимальне набухання спостерігається, коли питома щільність когезіонної енергії розчинника і полімеру рівні або близькі.
Інша причина обмеженого набухання високомолекулярної речовини полягає в тому, що між молекулами полімеру можуть існувати хімічні поперечні зв’язки (так звані містки), і вся речовина по суті є просторовою сіткою. Це перешкоджає відриву макромолекул одна від одної і переходу їх в розчин. Крім того, якщо навіть не всі молекули полімеру зв'язані в просторову сітку, то така сітка може виконувати роль мембрани, яка є проникливою для маленьких молекул розчинника та перешкоджає дифузії макромолекул з об'єму набряклого полімеру. В результаті збільшення об'єму високомолекулярної речовини при набряканні в просторовій сітці з'являється напруга, що і призводить до припинення набухання. Прикладом обмеженого набухання, обумовленого наявністю міцної просторової сітки, є набухання вулканізованого каучуку в бензолі.
3. 3. Ентропійний характер набухання
Обмежене розчинення полімеру, внаслідок наявності в ньому просторової молекулярної сітки, можна трактувати і з термодинамічної точки зору. Дійсно, при набуханні такого полімеру гнучкі ділянки макромолекул, які лежать між вузлами сітки, розтягуються і розпрямляються, отже, «ентропійні пружини» переходять в менш вірогідний стан. В результаті ентропія системи зменшується, при цьому це зменшення може стати рівним збільшенню ентропії в результаті зміщення. У цей момент набухання припиниться, тобто система перейде в рівноважний стан. Правильність наведених припущень підтверджується наявністю зв'язку між модулем пружності полімерів та їх здатністю до набухання (Флорі).
Слід відзначити, що при великій кількості поперечних хімічних зв'язків між макромолекулами, високомолекулярна речовина перестає не лише розчинятися, але й набухати. Прикладом може бути ебоніт — вулканізований каучук з 25-30% вмістом сірки. Внаслідок щільності та жорсткості просторової сітки молекули розчинника вже не можуть проникати в полімер і розсовувати його ланцюги. Тому набухання ебоніту не відбувається. Полімер, що частково набряк і має незначну кількість зв'язків між макромолекулами, може перетворитися на необмежено набряклий в результаті механічної обробки, наприклад вальцюванні. При вальцюванні незначна кількість поперечних зв'язків розривається, і полімер набуває здатності до необмеженого розчинення.
Між обома можливими випадками обмеженого набухання, один з яких обумовлений обмеженістю зміщення, а інший - просторовою структурою полімеру, немає принципової відмінності. Можна прийняти, що в першому випадку полімер є просторовою сіткою, в якій зв'язки обумовлені не хімічними, а фізичними міжмолекулярними силами взаємодії. Тоді обмежене розчинення такого полімеру можна пояснити тим, що поганий розчинник просто не може зруйнувати ці зв'язки або руйнує їх частково, що і знаходить своє виявлення в обмеженому набуханні.
Можливо і третє пояснення обмеженого набухання високомолекулярних речовин, запропоноване В. А. Каргіним. Уявимо собі, що в результаті сольватації при набуханні та розчиненні гнучкість макромолекул зменшується. Це може бути обумовлено збільшенням потенційного бар’єру обертання ділянок молекули в результаті взаємодії з розчинником. Тоді ентропія полімеру при набуханні зменшиться, оскільки макромолекули стають все більш жорсткими і не можуть преходити в ті конформації, які були їм доступні при відсутності розчинника. Як тільки зниження ентропії через втрату гнучкості макромолекул стане більше за зменшення внутрішньої енергії в результаті енергетичної взаємодії макромолекул з молекулами розчинника, тобто як тільки ізобарно-ізотермічний потенціал системи перестане зменшуватися, набухання припиниться. Подібний випадок має місце, наприклад, при набуханні ацетату целюлози в тетрахлоретані. Аналогічні явища часто спостерігаються також при набряканні полярних високомолекулярних речовин у воді. В таблиці 3. 1 приведені парціальні термодинамічні величини води і набряклих до різних ступенів полімерів – агару, казеїну, кератину і целюлози. На думку В. А. Каргіна і А. А Тагера, при набуханні всіх вищезгаданих речовин (в результаті взаємодії молекул розчинника з макромолекулами) різко збільшується потенційний бар'єр обертання, що призводить до зменшення ентропії і зростанню вільної енергії системи. Внаслідок цього набухання припиняється на певному етапі і розчинення не відбувається.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|