
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторна робота №4-5 5 страница
Виникнення та зникнення кавітаційних бульбашок з зарядженою поверхнею забезпечує не тільки розрив довгих молекулярних ланцюгів, але і молекул низькомолекулярних речовин. В обох випадках дуже активні продукти розпаду, вільні радикали або іони за рахунок наступних перетворень призводять до глибоких хімічних змін речовин, які підлягають дії ультразвуку.
Лабораторна робота № 1
Тема: вивчення залежності в'язкості розчинів желатину від рН розчину.
Мета: вивчити вплив рН середовища на в’язкість розчинів поліелектролітів і визначити ізоелектричну точку.
Об’єкт дослідження: желатин.
Обладнання і посуд: віскозиметр Оствальда, циліндр, колби, рН-метр, ваги, піпетки.
Реактиви: стандартні буферні розчини, дистильована вода.
Методика виконання роботи
Вимірювання в'язкості методом капілярної віскозиметрії проводять за допомогою віскозиметра Оствальда. У ретельно вимитий віскозиметр Оствальда наливають певний об'єм води, занурюють віскозиметр до термостата, повільно засмоктують воду у верхню кульку вище мітки 1 (рис. 1).
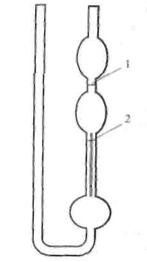
Рис. 1. Віскозиметр Оствальда
За секундоміром визначають час витікання рідини від мітки 1 до мітки 2. Визначення проводять не менше трьох разів. Потім 1 %-й розчин желатину змішують з буферним розчином у співвідношенні, який вказує викладач. Промивають цим розчином віскозиметр і визначають час його витікання, як і для води. Аналогічна процедура виконується для всіх вказаних розчинів, причому спочатку проводять визначення для розчинів з меншим значенням рН. Потім розраховують відносну в'язкість 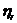 як відношення в'язкості
як відношення в'язкості 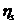 розчину, який досліджується, до в'язкості води
розчину, який досліджується, до в'язкості води 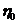 .
.
 (1)
(1)
Використовуючи для розрахунку в'язкостей 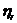 , і
, і 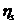 рівняння (1) і припускаючи, що густина розбавлених розчинів близька до густини води, можна показати, що
рівняння (1) і припускаючи, що густина розбавлених розчинів близька до густини води, можна показати, що 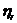 дорівнює відношенню часу витікання розчину (
дорівнює відношенню часу витікання розчину (  ) і води (
) і води ( 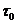 ), тобто:
), тобто:
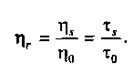 (2)
(2)
Проводять градуювання рН-метричної установки за допомогою стандартних буферних розчинів і будують залежність ЕРС —  f(pH), потім визначають рН розчинів желатину, яка досліджуються. Експериментальні і розрахункові величини заносять до таблиці. За отриманими даними будують графік залежності відносної в'язкості
f(pH), потім визначають рН розчинів желатину, яка досліджуються. Експериментальні і розрахункові величини заносять до таблиці. За отриманими даними будують графік залежності відносної в'язкості 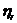 , від рН, і за графіком знаходять ізоелектричну точку.
, від рН, і за графіком знаходять ізоелектричну точку.
| № розчину |  , с , с
| 
| Е, мВ | рН |
Зробити висновок до роботи.
Лабораторна робота № 2
Тема: дослідження процесу набухання желатину.
Мета: дослідити кінетики набухання желатину, вивчити вплив рН середовища на швидкість процесу набухання желатину.
Методика виконання роботи
Дослідження процесу набухання проводять за допомогою приладів конструкції ЛДУ (Ленінградського державного університету) (рис. 1), які являють собою скляну трубку зі шкалою, до якої припаяні два резервуари. Перед початком досліду кожен прилад ретельно миють хромовою сумішшю, промивають водою і сушать. Для градуювання кожного приладу в нього наливають такий об'єм води, щоб її рівень був на початку шкали при вертикальному положенні приладу. Потім піпеткою доливають певну кількість води і за зміною її рівня у трубці визначають ціну поділки шкали приладу в одиницях об'єму.
При визначенні ступеня набухання в один з приладів наливають досліджуваний розчин, відмічають початковий рівень рідини, h0 у трубці, поміщають зважену пластинку желатину і повертають прилад так, щоб желатина була зануреною до розчинника. Через певні проміжки часу перевертають прилад у вертикальне положення і проводять визначення рівня рідини, h, у трубці приладу, який змінюється внаслідок набухання желатину, доки два сусідніх визначення не дадуть однакових результатів. Потім виймають пластинку желатину з розчину, знімають з неї краплі рідини за допомогою фільтрувального паперу і зважують на терезах.
Ступінь набухання (аm) можна розрахувати за густиною рідини та її об'ємом, який був поглинутий желатином:
 (1)
(1)
де m0 та m — початкова маса желатину та його маса на момент часу 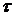 .
.
Максимальний ступінь набухання (ат, тах) розраховують за зміною маси желатину:
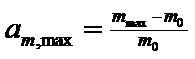 (2)
(2)
де ттах — маса желатину після набухання.
Швидкість процесу набухання описується кінетичним рівнянням першого порядку:
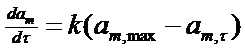 (3)
(3)
де k — константа швидкості набухання. Інтегрування рівняння для швидкості набухання дає наступне рівняння:
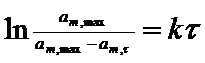 (4)
(4)
з якого випливає, що константу швидкості набухання можна знайти як тангенс кута нахилу лінійної залежності ln[am, max/(am, max-am,  )] від часу
)] від часу  .
.

Рис. 1 Прилад конструкції ЛДУ для вивчення процесу набухання об’ємним методом
Оскільки:
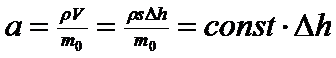 (5)
(5)
де s — площа поперечного перерізу трубки приладу; Δ h— зміна стовпа рідини в трубці при набуханні; Δ h = h0 - h, то підставляючи а з рівняння (5) до рівняння (4); дістаємо рівняння (6), що використовують для розрахунку константи швидкості процесу набухання:

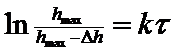 (6)
(6)
де Δ hmax— зміна висоти рівня рідини в трубці після закінчення набухання. Побудувавши графік залежності 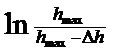 , від
, від  знаходять константу швидкості набухання як тангенс кута похилу отриманої прямої.
знаходять константу швидкості набухання як тангенс кута похилу отриманої прямої.
Аналогічну процедуру виконують для всіх вказаних викладачем розчинів, будують залежність am, max від рН розчину, роблять висновки про залежність перебігу процесу набухання від рН середовища.
Експериментальні та розрахункові величини заносять до таблиці.
| рН |  , мин. , мин.
| h0, мм | h  , мм , мм
| Δ h, мм | 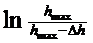
| am, max | k |
Зробити висновок до роботи.
Лабораторна робота №3
Тема: визначення відносної молекулярної маси амінокислот за амінним Нітрогеном.
Мета: сформувати вміння визначати сумарну кількість амінокислот у біологічних системах і білковому гідролізаті шляхом утворення мідного комплексу амінокислот, розраховувати відносну молекулярну масу амінокислоти за вмістом амінного Нітрогену. Закріпити одержані в курсі аналітичної хімії вміння йодометричного титрування.
Методика виконання роботи
У мірну колбу (23 см3) вносять 2 см3 досліджуваного розчину амінокислоти (ω = 1%), додають 2 краплини тимолфталеїну і невеликими частинами розчин натрій гідроксиду (С = 0, 5 моль/дм3) до блідо-блакитного забарвлення (рН розчину – 10, 2). Потім додають у колбу суспензію купрум (ІІ) фосфату. Суспензія спочатку розчиняється, бо Купрум використовується на утворення в лужному середовищі розчинного комплексу амінокислоти синьо-фіолетового забарвлення розчину. Оскільки вміст амінокислоти в розчині невідомий, додають надлишок суспензії купрум (ІІ) фосфату. Вміст колби доводять водою до риски, старанно перемішують перевертанням колби і відфільтровують надлишок купрум (ІІ) фосфату крізь густий фільтр.
Фільтрат має бути абсолютно прозорим. Цього можна досягти багаторазовим фільтруванням. З фільтрату піпеткою відбирають дві проби по 10 см3 у конічні колби на 50 см3 для титрування, підкислюють близько 0, 4 см3 льодяної оцтової кислоти до зникнення синього забарвлення мідного комплексу, додають 6-8 см3 розчину КІ з ω = 10% і йод, що виділився титрують розчином N2S2O3 (С(1/2) = 0, 01 моль/дм3). Індикатор крохмаль додають до розчину, коли більша частка йоду вже відтитрована і розчин набув солом’яно-жовтого забарвлення.
Проводять контрольне визначення, у якому замість розчину амінокислоти беруть воду. Об’єм розчину N2S2O3, що витрачався на контрольний розчин, віднімається від його об’єму в досліді.
Хімізм процесу
При взаємодії солі амінокислоти з суспензією купрум (ІІ) фосфату утворюється забарвлена в синій колір добре розчинна комплексна мідна сіль амінокислоти.
Фосфатна кислота зв’язується боратним буфером, і реакція відбувається до кінця. У фільтраті після відділення надлишок купрум (ІІ) фосфату залишається лише мідні солі амінокислот(за винятком цистину, мідна сіль якого не розчинна). Отже за кількістю купруму, що ввійшов до складу комплексу, можна визначити вміст амінокислот. При додаванні до розчину мідного комплексу амінокислот концентрованої оцтової кислоти цей комплекс руйнується і розчині з’являються йони Купруму (Сu2+), вміст яких визначається йодометрією:
2Cu2+ + 4I- → Cu2I2 + I2
2 N2S2O3 + I2 → 2NaI + Na2I4O6
За рівнянням реакції 0, 5 моль йоду, що вивільнилося відповідає 1 моль Купруму, який у свою чергу еквівалентний 28 г амінного нітрогену. Титр робочого розчину N2S2O3 за речовиною, що визначається становитиме:
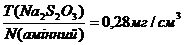
Всі дані зводять в єдину формулу:
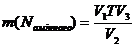 ,
,
де V1 – об’єм розчину N2S2O3 (С(1/2) = 0, 01 моль/дм3), що пішов на титрування, см3;
V2 – аліквотний об’єм розчину комплексної мідної солі амінокислоти, см3;
V3 – загальний об’єм розчину комплексної мідної солі амінокислоти, см3.
Для розрахунку молярної маси амінокислоти за амінним Нітрогеном слід застосовувати співвідношення:
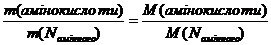
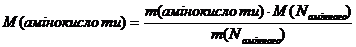 .
.
Масу взятої для дослідження амінокислоти визначають за формулою:
m = V·d∙ ω,
де m – маса амінокислоти, г;
V – об’єм розчину амінокислоти, см3;
d – густина розчину, г/см3;
ω – масова частка амінокислоти в розчині.
В умовах даної роботи d можна прийняти за 1. Звідси:
 г/моль
г/моль
Особливі умови: необхідно знати кількість атомів амінного Нітрогену в молекулі амінокислоти, яка досліджується.
Зробити висновок до роботи.
Лабораторна робота №4-5
Тема: реакції осадження білків.
Мета: провести реакції осадження білків методом висолювання, при нагріванні, при дії мінеральних і органічних кислот, осадження солями важких металів, фенолами, альдегідами, спиртом і та ін.; з’ясувати механізми зворотного і незворотного осадження білків.
Методика виконання роботи
Висолювання білків. У водному розчині білкові молекули заряджені і гідратовані, що забезпечує стійкість білкових розчинів. При високій концентрації солей, йони яких теж гідратовані, відбувається руйнування водних оболонок білкових молекул у результаті конкуренції за воду йонів солей. Крім того, йони солей адсорбуються на поверхні білкової молекули, внаслідок чого зменшується заряд білкової молекули, частинки білка менше відштовхуються, злипаються, випадають в осад.
Амоній сульфат має різко виражену висолюючи здатність і осаджує білки в нейтральному середовищі, а ще краще у слабокислому. Інші солі, наприклад натрій хлорид, осаджують білки лише при підкисленні розчину.
Для висолювання різних білків потрібна різна концентрація одних і тих же солей. Отже, білки можна висолювати фракційно. Так, глобуліни випадають в осад при напівнасичені розчину амоній сульфатом, а альбуміни осаджуються при повному насиченні.
Хід процесів висолювання білків. Наливають у пробірку 1, 5-2, 0 см3 розчину білка додають рівний об’єм насиченого розчина амоній сульфат і струшують суміш. З’являється помутніння від утвореного осаду глобулінів. Слід звернути увагу на те, щоб розчину амоній сульфату був дійсно насичений, тобто на дні посудини з розчином був осад.
Мутну рідину фільтрують крізь складчастий фільтр. Частину прозорого фільтрату нагрівають до кипіння і спостерігають згортання альбумінів, що знаходились у розчині. До іншої частини фільтрату додають при перемішуванні надлишок амоній сульфату у вигляді порошку до припинення його розчинення. З’являється помутніння, альбуміни випадають в осад.
Осадження білків солями лужних металів і амонію є оборотним процесом. При додаванні води білки знову розчиняються.
Згортання білків при нагріванні. У п’ять пробірок наливають по 2 см3 розчину білка.
1. Нагрівають вміст першої пробірки. Осад білка з’являється ще до того, як рідина закипить.
2. Додають до другої пробірки одну краплину розчину оцтової кислоти (ω = 1%), і нагрівають. Осад випадає швидше, внаслідок того що при підкисленні рН розчину наближається до ізоелектричної точки білка.
3. У третю пробірку додають близько 0, 5 см3 розчину оцтової кислоти (ω = 10%) і нагрівають. Осад білка не утворюється навіть при кип’ятінні.
У даному випадку надлишок хлоридної кислоти призводить до перезарядки молекул білка, молекули отримують позитивний заряд, взаємно відштовхуються, і осад не утворюється.
4. У четверту пробірку додають 0, 5 см3 розчину оцтової кислоти (ω = 10%), декілька насиченого розчину натрій хлориду і нагрівають. Утворюється осад білка.
5. У п’яту пробірку вносять близько 0, 5 см3 розчину натрій гідроксиду і нагрівають. Осад білка не утворюється навіть при кип’ятінні.
Причина полягає в тому, що досліджуваний білок кислий і молекули його мають від’ємний заряд (-), а рІ < 7, 0. Якщо рН середовища більше значення ізоелектричної точки білка, то білкові молекули матимуть від’ємний заряд (-). Отже, лужне середовище буде перешкоджати досягненню кислим білком ізоелектричного стану (рН < 7, 0 ), і білок не випадатиме в осад.
Сильно кисле середовище теж стримуватиме досягнення білком ізоелектричного стану, особливу для основних білків, у яких рІ > 7, 0.
Білки як амфотерні електроліти дисоціюють як кислоти і основи. У лужному середовищі, особливо поблизу ізоелектричної точки, молекули білка являють собою біполярні іони.
У кислому середовищі зменшується дисоціація білка по карбоксильних групах, молекула отримає позитивний заряд і знаходиться в розчині навіть при кип’ятінні.
У лужному середовищі зменшується протонізація аміногруп білка, молекули отримують від’ємний заряд і залишається у розчині навіть при кип’ятінні.
Додавання до розчину білка нейтральних солей полегшує і прискорює згортання білків при кип’ятінні внаслідок дегідратації. Згортання білків при нагріванні відбувається внаслідок їх денатурації – порушення четвертинної, третинної, вторинної структури молекули – і є процесом практично незворотним.
Осадження білків концентрованими мінеральними кислотами. У три пробірки наливають по 1 – 2 см3 концентрованої нітратної, сульфатної і хлоридної кислот. Потім, нахиливши кожну пробірку, по стінці доливають до неї з піпетки по 0, 5 см3 досліджуваного розчину білка так, щоб він не змішувався з кислотою. На межі двох рідин з’являється білий аморфний осад білка. При струшуванні осад, що утворився при дії хлоридної і сульфатної кислоти розчиняється у їх надлишку. Розчинення осаду білка у надлишку хлоридної кислоти пояснюється тим, що відбувається перезарядка білкової молекули і перехід із ізоелектричного стану (при рН < рІ) у стан з позитивним зарядом білкової молекули.
Збільшення осаду білка в надлишку нітратної кислоти відбувається внаслідок процесів нітрування ароматичних амінокислот білка і зшивання поліпептидних ланцюгів за рахунок продуктів реакції. У надлишку концентрованої сульфатної кислоти руйнування молекули білка до найпростіших низькомолекулярних сполук, які не дають осаду.
Осадження білків органічними кислотами. У дві пробірки наливають по 2-3 см3 розчину білка і додають в одну з них декілька крапель розчину трихлороцтової кислоти (ω = 5%), у другу – декілька крапель розчину сульфосаліцилової кислоти (ω = 20%). В обох випадках випадають осади білка.
Сульфосаліцилова і трихлороцтова кислоти є чутливими й специфічними реактивами на білок. Трихлороцтова кислота осаджує тільки білки і не осаджує продуктів розпаду білка і амінокислот, нею користуються для повного вилучення білків з біологічних рідин.
Осадження білків солями важких металів. У дві пробірки наливають по 1-2 см3 досліджуваного розчину білка і повільно, краплинами при струшуванні додають в одну з них розчин купрум сульфату, а в іншу – розчин плюмбум ацетату. Випадають пластівчасті осади із сіллю Купруму – блакитного кольору, із сіллю Плюмбуму – білого кольору.
Солі важких металів необоротно осаджують білки внаслідок зшивання поліпептидних ланцюгів багатовалентними атомами металів. Тому білки застосовують при отруєнні солями важких металів. Деякі з таких осадів (наприклад, із солями Купруму (ІІ), Плюмбуму (ІІ), Цинку) розчиняється в надлишку солі внаслідок адсорбції йонів цих металів на поверхні білкових частинок, у результаті цього білкові частинки набувають заряд і переходять у розчин.
Розчиняється осадів денатурованих білків у надлишку солі важких металів називається адсорбційною пептизацією. Такі явища вивчає колоїдна хімія.
Осадження білків фенолом і формальдегідом. У дві пробірки вносять по 1-2 см3 розчину білка, додають: у першу – рівний об’єм насиченого водного розчину фенолу, а в другу – рівний об’єм розчину формальдегіду (ω = 40%). В обох пробірках випадає білий осад білка. Утворення осаду при дії на білок формальдегіду пояснюється взаємодією його з ароматичними амінокислотами білка з утворенням нерозчинних сполук типу фенол-формальдегідних смол.
Осадження білків спиртом. У пробірку наливають 1-1, 5 см3 розчину білка і додають трохи кристалічного натрій хлориду. Доливають поступово 5-6 см3 етилового спирту. Випадає пластівчастий осад білка внаслідок дегідратації молекул при додаванні спирту.
Осадження білків натрій вольфраматом. До 3 см3 розчину білка додають 0, 5 см3 розчину сульфатної кислоти (С(1/2) = 0, 66 моль/дм3) і після перемішування 0, 5 см3 розчину натрій вольфрамату (ω = 10%). Випадає осад. Натрій вольфрамат дуже добре і часто застосовується для вилучення їх з біологічних рідин і екстрактів.
Зробити висновок до роботи.
Лабораторна робота №6
Тема: якісні реакції на амінокислоти та білки
Мета: сформувати вміння хімічного виявлення деяких вільних амінокислот і їх залишків у складі білків, виявлення пептидного зв’язку у білках і пептидах.
Методика виконання роботи
1. Біуретова реакція становить процес виникнення мідного комплексу, забарвленого в рожево фіолетовий колір, при взаємодії пептидів і білків з купрум (ІІ) гідроксидом у лужному середовищі. Ця реакція не є специфічної, бо подібний комплекс утворює не тільки пептиди і білки, а й біурет: , який теж має зв'язок.
Саме тому реакція отримала назву біуретової. Правильно було б сказати, що ця реакція утворення пептидами і білками мідного комплексу – такого ж, як і з біуретом.
Хід роботи. До 1-2 см3 розведеного розчину білка додають подвійний об’єм розчину натрій гідроксиду (ω = 30%), добре перемішують і вносять за допомогою скляної палички декілька крапель розчину купрум (ІІ) сульфату (ω = 1%). Знову ретельно перемішують. З’являється рожево-фіолетове забарвлення. Якщо було внесено велику кількість розчину купрум (ІІ) сульфату, то надлишок купрум (ІІ) гідроксиду, що при цьому утворився, маскуватиме рожево-фіолетове забарвлення мідного комплексу білка, весь розчин набуде синього кольору.
2. Нінгідринова реакція – це реакція ароматичного трикетону нінгідрину з речовинами, що мають вільні аміногрупи. Амінокислоти, пептиди і білки мають такі вільні аміногрупи і при взаємодії з нінгідрином утворюють барвник Руемана синьо-фіолетового кольору. Як і біуретова, нінгідринова реакція не є специфічною на амінокислоти, пептиди і білки. Будь-які речовини, що містять вільну аміногрупу, і навіть амоніак, дають позитивну реакцію. У нуклеїнових кислот теж така реакція. Тому говорять про нінгідринпозитивні речовини.
Взаємодія нінгідрину з амінокислотою:
Хід роботи. До 2-3 см3 розведеного розчину білка додають розчин нінгідрину (ω = 1%) в ацетоні (ω = 95%). Перемішують і нагрівають на киплячій водяній бані при 70°С 15-20 хвилин. Розвивається синьо-фіолетове забарвлення.
3. Ксантопротеїнова реакція – це реакція нітрування ароматичних амінокислот у складі пептидів і білків, у результаті якої утворюються нітропохідні жовтого кольору. Реакція не специфічна, бо нітропохідні вільних ароматичних вуглеводнів теж мають таке забарвлення.
Хід роботи. До 1-2 см3 розчину білка додають 5-6 крапель концентрованої нітратної кислоти до появи білого осаду або помутніння, нагрівають на киплячій водяній бані. При цьому осад і розчин забарвлюють у жовтий колір, осад потім майже повністю розчиняється.
Охолоджують суміш і, не перемішуючи, додають краплинами до кислого розчину надлишок концентрованого розчину амоніаку або лугу до лужної реакції середовища. Вміст забарвлюється в яскраво-оранжевий колір, що обумовлено виникненням у лужному середовищі хромофорної групи.
4. Реакція Адамкевича – це реакція на амінокислоту триптофан з гліоксалевою кислотою, у результаті якої відбувається конденсація двох залишків триптофану з утворенням сполуки, що має довгий ланцюг спряжених подвійних зв’язків, який зумовлює виникнення червоно-фіолетового забарвлення.
Гліоксалева кислота за участі концентрованої сульфатної кислоти декарболізуються:
Утворений формальдегід вступає в реакцію конденсації з двома залишками триптофану у складі білка:
Хід роботи. У пробірку вносять приблизно 0, 5 см3 нерозведеного білка, додають 2 см3 льодяної оцтової кислоти, до якої внесено трохи гліоксалевої кислоти. Суміш нагрівають до розчинення осаду, який утворився. Охолоджують пробірку із сумішшю, а потім, нахиливши її, обережно по стінці приливають до 1 см3 концентрованої сульфатної кислоти так, щоб рідини не змішалися, а утворили два шари. На межі двох рідин з’являється червоно-фіолетове кільце.
5. Реакція Паулі – це реакція азосполучення п-сульфофенілдіазонійхлориду з ароматичними амінокислотами – як вільними, так і в складі пептидів і білків. Спочатку проводять на холоді діазотування сульфанілової кислоти, а потім реакцію азосполучення з ароматичними амінокислотами у складі білків. З’являється оранжево-червоне забарвлення в результаті утворення азобарвника.
Хід роботи. До 1 см3 розчину сульфанілової кислоти (ω = 1%) в розчині хлоридної кислоти (ω = 5%) додають 2 см3 розчину натрій нітрату (ІІІ, ω = 0, 5%), ретельно перемішують і додають спочатку 2 см3 розведеного розчину білка, а потім (після перемішування вмісту пробірки) 6 см3 розчину натрій карбонату (ω = 10%), знову перемішують. З’являється вишнево-червоне забарвлення.
6. Нітропруссидна реакція – це реакція на амінокислоту цистеїн, що містить сульфгідрильну групу –SH. При взаємодії натрій нітропруссиду зі сполуками, що містять –SH-групу або S2-, з’являється пурпурове забарвлення. Ця реакція на білки теж неспецифічна.
Хід роботи. У пробірку вносять 1-2 см3 розведеного білка, додають рівний об’єм насиченого розчину амоній сульфату і 2-3 краплини розчину натрій нітропруссиду (ω = 5%). Потім вносять декілька крапель концентрованого розчину амоніаку.
Якщо в білку є цистеїн, то відбувається реакція, у результаті якої з’являється пурпурове забарвлення.
Загалом слід зазначити, що специфічних реакцій на білки немає, у тому для ідентифікації білків застосовується декілька реакцій.
Лабораторна робота №7
Тема: визначення загального вмісту нітрогену по К'ельдалю (мікрометод).
Мета: визначити загальний вміст нітрогену в харчовій сировині і продуктах по К'ельдалю (мікрометод).
Метод визначення загального вмісту нітрогену в біологічних об'єктах по К'ельдалю вважається одним з найточніших.
При визначенні загальної кількості нітрогену органічну речовину мінералізують кип'ятінням з концентрованою сірчаною кислотою. Амоніак, що звільняється, зв'язується сульфатною кислотою, при цьому утворюється амоній сульфат.
Додаванням концентрованого розчину натрій гідроксиду витісняють амоніак. Амоніак поглинається титрованим розчином сульфатної кислоти, який беруть в надлишку. Відгонку амоніаку прискорюють пропусканням водяної пари. Надлишок розчину сульфатної кислоти, що не прореагував, відтитровують натрій гідроксидом.
За різницею між об’ємами (см3) розчину сульфатної кислоти, узятими для поглинання амоніаку і тим що залишився в надлишку після закінчення реакції, визначають об’єм (см3), витрачений для нейтралізації амоніаку.
1 см3 0, 01 н розчину сульфатної кислоти відповідає 0, 000142 г нітрогену.
Об'єкт дослідження: нітрогенвмісна речовина.
Обладнання і посуд: колби К'ельдаля місткістю 50... 100 см3., апарат для мікровизначення нітрогену.
Реактиви: сульфатна кислота концентрована, пергідроль, купрум (ІІ) сульфат, калій сульфат, натрій гідроксид (ω = 33 % ), для звільнення від амоніаку рекомендується нагріти розчин до кипіння, кип'ятити 1-2 хв., потім охолодити, натрій гідроксид, 0, 01 н, метиловий червоний, реактив Несслера, дистильована вода.
Методика виконання роботи
Досліджуваний продукт ретельно подрібнюють. У пробірку з термостійкого скла (діаметром 15 мм) вносять 0, 03... 0, 08 г зваженого подрібненого продукту, додають 2 см3 концентрованої сульфатної кислоти і 1... 2 краплі пергідролю. Як каталізатор використовують суміш купрум (ІІ) сульфату і калій сульфату (1: 3). Тримаючи пробірку від себе під кутом 45 градусів (за допомогою утримувача) нагрівають її на слабкому вогні. Протягом 2-3 хвилин звичайно відбувається знебарвлення рідини. При подальшому нагріванні безбарвна і прозора рідина не повинна пожовтіти. Якщо ж вона набуває жовтого забарвлення, то це свідчить про неповне спалювання органічних речовин. В цьому випадку вміст пробірки охолоджують, додають ще 1... 2 краплі пергідролю і знову нагрівають на повільному вогні. Всього витрачають не більше 4... 5 крапель пергідролю.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|