
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Закон состояния.
2. Закон состояния.
Потенциалы Р в числе прочих величин являются функциями состояния. Поэтому для них можно написать:
Рi = fi(Е1; Е2; ... ; Еn) дж (14)
или (при n = 2)
Р1 = f1(Е1; Е2) дж. (15)
Р2 = f2(Е1; Е2) дж. (15)
Дифференцирование этих выражений дает
dPi = 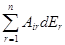 (16)
(16)
где i = 1, 2, ..., n;
Aii = (¶Pi/¶Ei)Eин ; Air = (¶Pi/¶Er)Eин; ... ; Ari = (¶Pr/¶Ei)Eин (17)
и (при n = 2)
dР1 = А11dЕ1 + А12dЕ2; (18)
dР2 = А21dЕ1 + А22dЕ2; (18)
где
A11 = (¶P1/¶E1)E2 ; A22 = (¶P2/¶E2)E1; (19)
A12 = (¶P1/¶E2)E1 ; A21 = (¶P2/¶E1)E2 . (20)
Дифференциальные уравнения состояния (16) и (18) выражают закон состояния. В них основные коэффициенты Аii , А11 и A22характеризуют количественную сторону влияния данного заряда на сопряженный с ним потенциал. Эти коэффициенты обратны емкостям К системы по отношению к соответствующим зарядам, т.е.
Аii =1/Кii ; А11 = 1/К11 ; A22 = 1/К22 . (21)
Перекрестные коэффициенты Аir , Аri , А12 и А21определяют количественную сторону влияния данного заряда на не сопряженные с ним потенциалы.
Примером может служить газ, в котором в числе прочих связаны между собой термическая и механическая внутренние степени свободы. Для газа
dT =A11dS + A12dV °K ; (22)
dp = A21dS + A22dV н/м2, (22)
где
A11 = (¶T/¶S)V ; A22 = (¶p/¶V)S; (23)
A12 = (¶T/¶V)S ; A21 = (¶p/¶S)V. (24)
Изменение энтропии сопровождается одновременными изменениями как температуры, так и давления; аналогичная картина наблюдается при изменении объема. Величина А11 обратна энтропиеемкости (термоемкости) К11 , причем энтропиеемкость и теплоемкость связаны соотношением
С11 = ТК11 дж/град (25)
Если Аir= Аri = 0 и А12 = А21 = 0, то внутренние степени свободы оказываются не связанными между собой (взаимного влияния соответствующих явлений не происходит). При этом дифференциальные уравнения состояния (16) и (18) распадаются на независимые простейшие уравнения вида
dPi = AidEi = dEi/Ki (26)
В общем случае число связанных внутренних степеней свободы системы равно l £ n.
Дифференциальные уравнения состояния применимы для изучения любых явлений, они отражают связи между всеми переменными, существенными для системы, не делая исключения для энтропии, которая обычно изгоняется из уравнений состояния.
Для идеальных твердых, жидких и газообразных тел коэффициенты Аявляются константами. Интегрирование уравнений (16), (18) и (22) дает (принимается, что нулевым значениям зарядов отвечают нулевые значения потенциалов)
Pi = 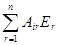 (27)
(27)
где i = 1, 2, ..., n;
Р1 = А11Е1 + А12Е2; (28)
Р2 = А21Е1 + А22Е2; (28)
T =A11S + A12V °K ; (29)
p = A21S + A22V н/м2, (29)
Калорическое уравнение состояния идеального тела при n =1 имеет вид
U = (1/2)KP2 = (1/2)PE = (1/2)AE2 дж (30)
Уравнения типа (27), (28) и (30) справедливы для всех явлений, включая термические, хотя для последних внутреннюю энергию принято сопоставлять не с квадратом температуры [формула (30)], а с температурой в первой степени. Общепринятая точка зрения базируется на случайных причинах (на свойствах обычного идеального газа Клапейрона). Поэтому в принципиальном отношении более правильными следует считать закономерности (26) н (30) Ими можно пользоваться наравне с общепринятыми (теплоемкость с температурой, как правило, растет, а энтропиеемкость - убывает) [10, 13]. Уравнение состояния (29) особого идеального газа автора отличается от уравнения Клапейрона прежде всего этим его свойством (у особого идеального газа внутренняя энергия сопоставляется с квадратом температуры).
Выражения (27) - (29) в новом аспекте представляют проблему абсолютного нуля температуры и других потенциалов. Для системы с несвязанными степенями свободы потенциал стремится к нулю при стремлении к нулю соответствующего заряда. Для системы со связанными степенями свободы данный потенциал стремится к нулю при стремлении к нулю всех зарядов (либо в нуль должны обращаться все коэффициенты А).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|