
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
MnSO4 + BaCl → Al + Se →
ВАРИАНТ 1
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
SO3 + NH4OH ® KHCO3 + NaOH ®
CuO + P2O5 ® CdOHCl + HNO3 ®
Li2SiO3 + H2SO4 ® Ag + H3PO4 ®
2.Вычислите молярность 20% раствора соляной кислоты, плотность которого раствора 1,1 г/см3.
3.На основании величин DН0298 и DS0298 реагирующих веществ вычислите DG0298 для реакции SO2(г) + 1/2O2(г) = SO3(г)
| Вешество | DН0298 кДж/моль | DS0298 Дж/моль.К |
| SO2(г) | - 296,9 | 248,1 |
| SO3(г) | - 395,2 | 256,23 |
| O2(г) | 205,03 |
Укажите, в каком направлении эта реакция будет протекать.
4.Как изменится скорость реакции, если концентрацию исходных веществ увеличить в 2 раза?
N2 (г) + 3H2(г) « 2 NH3 (г)
5.В какую сторону сместится равновесие реакции
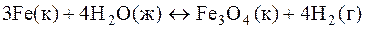
при увеличении давления ?
6.Какую функцию выполняет пероксид водорода в реакции
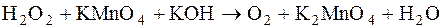
Составьте электронно-ионные полуреакции и подберите коэффициенты.
7.Составьте схему гальванического элемента, состоящего из Cd, опущенного в раствор 10-2 М CdSO4, и Fe, погруженного в 10-3 М раствор Fe2(SO4)3. Определите ЭДС и напишите уравнения реакций, за счет которых возникает разность потенциалов.
8.Электролизу подвергаются следующие водные растворы солей CuCl2, Na2SO4, ZnSO4, AgI. При электролизе какой соли на катоде будет выделяться газообразный водород? Объясните почему. Напишите уравнения реакций.
9. Какой силы ток необходимо пропускать через раствор NiSO4, чтобы в течение 30 минут масса катода увеличилась на 53,2 г ? Выход по току 100 %.
10.Составьте электронные уравнения процессов, протекающих при атмосферной коррозии луженого (покрытого оловом) железа. Приведите схему, образующихся микрогальванопар.
11.Определите, какие частицы являются изоэлектронными. Напишите электронные формулы данных частиц Se, As3+, Ge2+, Br-
ВАРИАНТ 2.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
SiO2 + RbOH  IK3AsO4 + 2H3AsO4
IK3AsO4 + 2H3AsO4 
CaO + HMnO4  NiOHNO3 + HNO3
NiOHNO3 + HNO3 
FeCl3 + Na2SO4  Ca + N2
Ca + N2 
2.0,6 л раствора гидроксида калия содержит 16,8 г КОН. Чему равна молярность и нормальность этого раствора? Какова процентная концентрация его, если плотность раствора составляет 1,022 г/см3?
3.Возможно ли разложение NH4NO3 (к) по уравнению:
NH4NO3 (к) = NO2 (г) + 2H2O (п)
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль×К |
| NH4NO3 (к) | -317,5 | 98,6 |
| NO2 (г) | 33,5 | 240,3 |
| H2O (п) | -241,98 | 188,85 |
4.Как изменится скорость прямой реакции
4NH3 (г) + 5O2 (г) 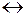 4NO (г) + 6H2O (г),
4NO (г) + 6H2O (г),
если увеличить давление в 2 раза?
5.В какую сторону сместится равновесие реакции
3Fe (к) + 4H2O (ж) 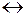 Fe3O4 (к) + 4H2 (г)
Fe3O4 (к) + 4H2 (г)
при увеличении давления?
6.Определите окислитель и восстановитель, расставьте коэффициенты, пользуясь методом составления электронно - ионных полуреакций:
H3PO3 + AgNO3 + H2O 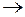 H3PO4 + Ag0 + HNO3.
H3PO4 + Ag0 + HNO3.
7.Составьте схему гальванического элемента, электродами которого являются Ni и Fe. Концентрация NiSO4 составляет 0,1 моль/л, Fe2(SO4)3 – 0,001 моль/л. Вычислите ЭДС элемента, напишите уравнения реакций, протекающих на электродах.
8.Напишите уравнения реакций для процессов, происходящих при электролизе водного раствора CuSO4. Сколько минут необходимо пропускать ток силой 2,5 А через раствор CuSO4, чтобы на катоде выделилось 0,72 г меди? Выход по току составляет 90 %.
9.Подберите протектор, защищающий железную конструкцию, эксплуатируемую под землей (среда нейтральная). Составьте схему образующихся микрогальванопар и уравнение анодного и катодного процессов.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 4Be 33As 42Mo.
ВАРИАНТ 3.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
SiO2 + H2SO4 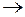 LiHSO4 + KOH
LiHSO4 + KOH 
СаО + Mn2O7  (CuOH)2CO3 + HNO3
(CuOH)2CO3 + HNO3 
Sr(OH)2 + (NH4)2S  AI + HBr
AI + HBr 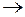
2.Определите молярную, нормальную и процентную концентрации азотной кислоты, если 1 л раствора содержит 224 г HNO3. Плотность раствора 1,12 г/см3.
3.Возможно ли разложение NH4Cl по уравнению:
NH4Cl (тв) = NH3 (г) + HCl (г)
| Вещество | DH0298 кДж/моль | DS0298 Дж/моль×К |
| NH4Cl (тв) | -314,4 | 95,9 |
| NH3 (г) | -46,2 | 192,6 |
| HCl (г) | -92,36 | 186,92 |
4.Во сколько раз увеличится скорость реакции при повышении температуры на 200С, если температурный коэффициент ( 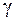 ) равен 3?
) равен 3?
5.В какую сторону сместится равновесие реакции
N2 (г) + 3H2 (г) « 2NH3 (г) DН0Х.Р.< 0
при: а) повышении давления;
б) повышении температуры
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
NaBrO3 + NaBr + H2SO4 ® Br2 + Na2SO4 + H2O.
7.Составьте схему гальванического элемента, электродами которого являются Ni и Cu. Концентрация NiCl2 составляет 10-2 моль/л, CuCl2 – 1 моль/л. Вычислите ЭДС элемента и напишите уравнения реакций, протекающих на электродах.
8.Вычислите выход по току при осаждении Zn из раствора ZnSO4, если электролиз вели при силе тока 3А 10 минут и при этом на катоде выделилось 0,46 г цинка? Напишите химические реакции процессов, происходящих на катоде и аноде.
9.Подберите протектор, защищающий стальную конструкцию, эксплуатируемую под землей (среда нейтральная). Составьте схему образующихся микрогальванопар и уравнение входного и катодного процессов.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 11Na 31Ga 41Nb.
ВАРИАНТ 4.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
As2O5 + RbOH ® ZnCO3 + H2CO3 ®
K2O + HClO4 ® CuOHIO3 + H2SO4 ®
Fe(NO3)3 + Na2SO4 ® Mg + H3PO4 ®
2.Плотность 40 % раствора HNO3 равна 1,25 г/см3. Рассчитайте полярность и нормальность этого раствора.
3.Возможно ли разложение NO2 по уравнению:
2NO2 = 2NO + O2
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| NO2(г) | 33,5 | 240,32 |
| NO(г) | 90,31 | 210,72 |
| O2(г) |
4.На сколько градусов необходимо поднять температуру, чтобы скорость реакции возросла в 16 раз? Температурный коэффициент (g) равен 2.
5.Реакция протекает по уравнению
4HCl (г) + O2 (г) « 2H2O (г) + 2Cl2 (г) DН0Х.Р. = -115 кДж.
В какую сторону сместится равновесие этой реакции:
а) при понижении температуры
б) при удалении паров воды?
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O
7.Составьте схему гальванического элемента, электродами которого являются Pb и Cr. Концентрация Pb+2 составляет 1 моль/л, Cr+3 - 0,001 моль/л. Вычислите ЭДС элемента и напишите уравнения реакций, протекающих на электродах.
8.Какой силы ток необходимо пропускать через раствор NiSO4, чтобы в течении 300 минут масса катода увеличилась на 50 г? Выход по току 90 %. Напишите химические реакции процессов, происходящих на аноде и катоде.
9.Подберите протектор, защищающий свинцовую конструкцию, эксплуатируемую под землей (среда нейтральная). Составьте схему образующихся микрогальванопар и уравнение анодного и катодного процессов.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 12Mg 32Ge 40Zr.
ВАРИАНТ 5.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
P2O5 + Ca(OH)2 ® BaCO3 + H2CO3 ®
CdO + HMnO4 ® (CuOH)2SO4 + H2SO4 ®
CrCl3 + NH4OH ® Hg + SnCl2 ®
2. Плотность 26 % раствора КОН равна 1,24 г/см3. Сколько молей КОН находится в 5 л раствора?
3.Возможно ли разложение N2O4 по уравнению: N2O4(г) = 2NO2(г)
| Вещество | DH0298 кДж/моль | DS0298 Дж/моль × К |
| N2O4(г) | 9,6 | 304,0 |
| NО2(г) | 33,5 | 240,32 |
4.Как изменится скорость прямой реакции, если концентрацию исходных веществ увеличить в 2 раза?
N2 (г) + 3H2 (г) « 2NH3 (г).
5.В какую сторону сместится равновесие реакции 2H2O (ж) « 2H2 (г) + O2 (г) при увеличении давления? Напишите выражение для константы равновесия данной реакции.
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
H2Se + K2Cr2O7 + H2SO4 ® Se + Cr2 (SO4)3 + K2SO4 + H2O.
7.Составьте схему гальванического элемента, электродами которого являются Pb и Zn. Концентрация ZnSO4 составляет 0,1 моль/л, PbSO4 – 1 моль/л. Вычислите ЭДС элемента и напишите уравнения реакций, протекающих на электродах.
8.Сколько минут надо пропускать ток силой 0,5А через раствор AgNO3, чтобы получить на площади 150 см2 покрытие из серебра толщиной 0,02 мм? Плотность серебра 10,5 г/см3. Выход по току 95 %. Напишите реакции, которые протекают на катоде и аноде.
9.Подберите протектор, защищающий медную конструкцию, эксплуатируемую под землей (среда нейтральная). Составьте схему образующихся микрогальванопар и уравнение анодного и катодного процессов.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 19К 31Ga 30Zn
ВАРИАНТ 6.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
SeO2 + Ba (OH)2 ® Ba (HS)2 + Ba (OH)2 ®
MgO + V2O5 ® (ZnOH)2SO4 + H2SO4 ®
FeCO3 + H3PO4 ® Cu + HClO4 ®
2.Определите молярность и нормальность 8 % раствора CuSO4, плотность которого 1,084 г/см3.
3.Возможно ли разложение Mg (OH)2 по уравнению:
Mg (OH)2 = MgO + H2O (г)
| Вещество | DH0298 кДж/моль | DS0298 Дж/моль × К |
| Mg (OH)2(к) | -925,28 | 63,22 |
| MgO(к) | -602,1 | 26,96 |
| H2O(г) | -241,98 | 188,85 |
4.Температурный коэффициент реакции равен 2. Во сколько раз уменьшится скорость при понижении температуры с 50 до 200С?
5.В каком направлении сместится равновесие реакции
СН4 (г) + Н2О (г) « СО (г) + 3Н2 (г) при увеличении давления в системе.? Почему?
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
Cr(OH)3 + Br2 + KOH ® K2CrO4 + KBr + H2O
7.Составьте схему гальванического элемента, электродами которого являются Mg и Fe. Концентрация MgSO4 составляет 0,01 моль/л, FeSO4 – 0,1 моль/л. Вычислите ЭДС элемента и напишите уравнения реакций, протекающих на электродах.
8.Вычислить выход по току при электролизе раствора AgNO3, если при протекании тока силой 5А в течение 10 минут масса катода увеличится на 0,9г. Напишите реакции, которые протекают на катоде и аноде.
9.Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластине, опущенной в кислоту, прикоснутся цинковой, то на меди начинается интенсивное выделение водорода. Объясните это явление, составив схему образующихся микрогальванопар и уравнение анодного и катодного процессов.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 20Сa 13Al 29Cu.
ВАРИАНТ 7.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
As2O5 + Mg (OH)2 ® Na2SeO3 + H2SeO3 ®
Ag2O + H2SO4 ® Ba (OH)2 + 1 HNO3 ®
FeS + H3PO4 ® Au + H2SO4 ®
2.Водный раствор содержит 577 г H2SO4 в 1 л. Плотность раствора 1,335 г/см3. Вычислите молярную, нормальную и процентную концентрации этого раствора.
3.Возможно ли разложение СаСО3 по уравнению:
СаСО3 (к) = СаО (к) + СО2(г)
| Вещество | DH0298 кДж/моль | DS0298 Дж/моль × К |
| СаСО3 (к) | -1207,72 | 92,9 |
| СаО (к) | -635,5 | 39,8 |
| СО2 (г) | -393,8 | 213,8 |
4.Не производя вычислений определить, будет ли DS > 0; DS < 0; DS » 0
в реакции
С (графит) + СО2 (г) = 2СО (г).
5.Сместится ли равновесие обратимой реакции
Н2 + I2 « 2H I DH0298= +52 кДж
При повышении температуры, и в какую сторону?
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
P + HNO3 + H2O ® H3PO4 + NO
7. Составьте схему гальванического элемента, электродами которого являются Pb и Zn. Концентрация ZnSO4 составляет 0,1 моль/л, PbSO4 – 1 моль/л. Вычислите ЭДС элемента и напишите уравнения реакций, протекающих на электродах.
8.Какой силы ток необходимо пропускать в течение 1 ч для осаждения никеля из раствора NiSO4, чтобы масса электрода увеличилась на 60 г. Выход по току 96 %. Напишите реакции, которые протекают на катоде и аноде.
9.Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на алюминиевой и медной пластинах.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 37Rb 14Sr 21Sc
ВАРИАНТ 8.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
SnO2 + KOH ® Ca (HCO3)2 + Ca (OH)2 ®
NH3 + H2CrO4 ® CdOHCl + HСlO4 ®
Al (NO3)3 + CuSO4 ® Sr + N2 ®
2.Сколько граммов HCl содержится в 0,250 л 10,52 % раствора HCl (r = 1,050г/см3). Чему равна молярность и нормальность этого раствора?
3. Возможно ли разложение Са (ОН)2 по уравнению:
Са (ОН)2 (к) = СаО (к) + Н2О (ж)
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| Са (ОН) (к) | -986,8 | 83,4 |
| СаО (к) | -635,5 | 39,8 |
| Н2О (ж) | 286,0 | 70,0 |
4.Будет ли реакция N2 (г) + 2О2 (г) = 2NО2 (г) D Н0Х.Р.> 0 протекать самопроизвольно? Ответ поясните, не производя вычислений.
5. Как можно повысить выход безводной соли по реакции:
К2СО3 × n Н2О (к) « К2СО3 (к) + n Н2О (п) D Н0Х.Р. > 0
а) повысить температуру? б) понизить давление? в) повысить давление?
г) понизить давление и повысить температуру? д) повысить давление и понизить температуру? Ответ поясните.
6. Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
NaBr + NaBrO3 + HNO3 ® Br2 + NaNO3 + H2O
7.Cоставьте схему гальванического элемента, электродами которого являются Fe и Zn. Концентрация FeSO4 составляет 10-1 моль/л, ZnSO4 – 1 моль/л. Вычислите ЭДС элемента и напишите уравнения реакций, протекающих на электродах.
8. Вычислите выход по току при электролизе раствора CuSO4, если при протекании тока силой 2А в течение 15 минут масса катода увеличилась на 0,54 г. Напишите реакции, которые протекают на аноде и катоде.
9. Никель склепан с железом. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на никелевой и железной пластинах.
10. Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 38Sr 15P 22Ti
ВАРИАНТ 9.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
CrO3 + NH4OH ® 2CuSO4 + 2NH4OH ®
ZnO + H2SeO4 ® NaNO3 + LiOH ®
Sr (HSO3)2 + Sr (OH)2 ® K + H2O ®
2.В каком количестве воды следует растворить 30 г KBr для получения 6 % раствора? Чему равна молярность и нормальность этого раствора, если его плотность равна 1,042 г/см3?
3.Возможно ли разложение СО2 (г) по уравнению: 2СО2 (г) = 2СО (г) + О2 (г)
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| СО2 (г) | -393,8 | 213,8 |
| СО (г) | -110,0 | 197,7 |
| О2 (г) |
4.Реакция идет по уравнению N2 + 3Н2 « 2NН3. Как изменится скорость прямой реакции, если объем уменьшить в 3 раза?
5.Объясните, как повлияет понижение температуры и давления на равновесие:
а) СО (г) + 2Н2 (г) = СН3ОН (г) DН0Х.Р. > 0
б) N2 (г) + О2 (г) =2NО DН0Х.Р.< 0
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций
MnSO4 + NaBiO3 + HNO3 ® HMnO4 + Na2SO4 + Bi (NO3)3 + NaNO3 + H2O
7.Cоставить схему гальванического элемента, состоящего из двух железных электродов, опущенных в растворы FeSO4: с1 = 0,1 моль/л; с2 = 10 моль/л. Какие процессы протекают на электродах? Как называется такой гальванический элемент? Чему равна ЭДС этого элемента?
8.Определите толщину слоя металлического покрытия, полученного при электролизе раствора NiSO4, если время электролиза составляет 60 минут, площадь покрытия 200 см2, сила тока 2А, выход по току 98 %, а плотность Ni равна 8,9 г/см3.
9.Цинк склепан с железом. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на цинковой и железной пластинах.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 55Cs 16S 33V.
ВАРИАНТ 10.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре
As2O3 + KOH ® Mg (H2PO4)2 + KOH ®
Li2O + SiO2 ® (PbOH)2CrO4 + H2CrO4 ®
CaS + CH3COOH ® Ag + H2SO4 (р) ®
2.Определите процентную и молярную концентрации 9,28 Н раствора NaOH (r = 1,310 г/см3).
3.Возможно ли разложение С2Н6 по уравнению: С2Н6 (г) = С2Н4 (г) + Н2 (г)
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| С2Н6 (г) | -84,8 | 229,7 |
| С2Н4 (г) | +52,5 | 219,4 |
| Н2 (г) | 130,6 |
4.Вычислите константу равновесия прямой реакции N2О4 « 2NО2, если равновесная концентрация NО2 равна 0,28 моль/л, а равновесная концентрация N2О4 = 0,30 моль/л.
5.Не производя вычислений определить будет ли DSХ.Р. < 0, DSХ.Р. > 0 или DSХ.Р. » 0 для процесса MgO (к) + H2 (г) = Mg (к) + H2O (ж). Ответ поясните.
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций
Cr2 (SO4)3 + Br2 + KOH ® K2CrO4 + KBr + K2SO4 + H2O
7.Рассчитайте ЭДС гальванического элемента, составленного из двух кадмиевых электродов, погруженных в раствор с концентрацией: с1 = 0,01 моль/л и с2 = 0,1 моль/л CdSO4. Какие процессы протекают на электродах? Как называется такой гальванический элемент? Чему равна ЭДС этого элемента?
8.Напишите процессы, протекающие у электродов при электролизе водных растворов веществ: Na2SO4; NiSO4; KBr; CuI2.
9.Цинк склепан с кадмием. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на цинковой и кадмиевой пластинах.
10. Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 56Ba 6C 24Cr
ВАРИАНТ 11.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре
Al2O3 + KOH ® ZnSO3 + H2SO3 ®
MgO + RbOH ® FeOHCl + HNO3 ®
Na3PO4 + BaCl2 ® Ca + N2 ®
2.Сколько мл 96 % раствора H2SO4 (r = 1,84 г/см3) нужно взять, чтобы приготовить 1 л 0,25 Н раствора?
3.Возможно ли разложение С2Н5ОН по уравнению:
С2Н5ОН (ж) = С2Н4 (г) + Н2О (ж)
| Вещество | DH0298 кДж/моль | DS0298 Дж/моль × К |
| С2Н5ОН (ж) | -277,1 | 161,1 |
| С2Н4 (г) | 52,5 | 219,4 |
| Н2О (ж) | -286,0 | 70,0 |
4.Не производя вычислений определить, будет ли DS > 0, DS < 0 или DS » 0 для процесса MgO (к) + Н2 (г) = Mg (к) + Н2О (ж).
5.Напишите математическое выражение закона действия масс (кинетическое уравнение) для гетерогенной реакции: SnO (к) + NO2 (г) = SnNO2 (к) + NO (г) DН0Х.Р. = - 298 кДж. Дайте ответы на следующие вопросы:
1) Как изменится скорость прямой реакции, если концентрацию NO2 увеличить в 2 раза?
2) Как повлияют: понижение температуры, повышение давления на равновесие?
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций:
Hg + NaNO3 + H2SO4 ® Na2SO4 + Hg2SO4 + NO + H2O.
7.Составьте схему гальванического элемента, электродами которого является стандартный водородный электрод и железный, опущенный в раствор Fe2(SO4)3 с концентрацией 0,1 моль/л. Чему равна ЭДС этого элемента? Какие реакции протекают на электродах?
8.Напишите процессы, протекающие у электродов при электролизе водного раствора Ni (NO3)2, если анод: а) угольный; б) никелевый.
9.Цинк склепан с медью. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на цинковой и медной пластинах.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 87Fr 7N 25Mn.
ВАРИАНТ 12.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
B2O3 + KOH ® Ca (H2PO4)2 + KOH ®
MnO + NH4OH ® PbOHNO3 + NH4OH ®
K2SO3 + MgSO4 ® Fe + CuCl2 ®
2.В каком объеме 0,1 Н раствора содержится 8 г CuSO4.
3.Возможно ли получить СН3ОН по уравнению: 2Н2 (г) + СО (г) = СН3ОН (ж)?
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| Н2 (г) | 130,6 | |
| СО (г) | -110,6 | 197,7 |
| СН3ОН (ж) | -239,61 | 126,7 |
4.Как изменится скорость прямой реакции 4NH3 (г) + 5О2 (г) « 4NO (г) + 6 Н2О (г), если увеличить давление в 2 раза?
5.Увеличится или уменьшится энтропия в процессе
4HCl (г) + О2 (г) = 2Cl2 (г) + 2Н2О. Почему?
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
Na2SO3 + K2Cr2O7 + H2SO4 ® Na2SO4 + Cr2 (SO4)3 + K2SO4 + H2O
7.Составьте схему гальванического элемента, электродами которого является стандартный водородный электрод и цинковый, опущенный в раствор ZnSO4 с концентрацией 0,01 моль/л. Чему равна ЭДС этого элемента? Какие реакции будут протекать на электродах?
8.Электролизу подвергаются водные растворы сульфата натрия, хлорида никеля, нитрата серебра. При электролизе какой соли на катоде будет выделяться газообразный водород? Напишите реакции, которые протекают на катоде и аноде.
9.Олово склепано с железом. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на оловянной и железной пластинах.
10.Составьте электронные формулы атомов элементов в стабильном и возбужденном состояниях и изобразите орбитали внешнего энергетического уровня: 2He 15P 26Fe
ВАРИАНТ 13.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре
Mn2O7 + HNO3 ® 1K3AsO4 + 2H3AsO4 ®
NiO + HclO4 ® Mg2 (OH)2 CO3 + HBr ®
Fe2 (SO4)3 + RbOH ® Zn + P ®
2.Определите процентную и нормальную концентрации 0,8 М раствора Fe2(SO4)3, если плотность раствора равна 1,01 г/см3.
3.Возможно ли получить SO3 пo уравнению: 2SO2 (г) + O2 (г) = 2SO3 (г)
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| SO2 (г) | - 297,1 | 248,2 |
| O2 (г) | ||
| SO3 (г) | - 396,1 | 256,9 |
4.Написать кинетическое равновесие прямой реакции
2NO (г) + Cl2 (г) « 2NOCl (г) DН0Х.Р. = - 74 кДж.
Как влияет увеличение: а) температуры; б) давления на сдвиг равновесия в данной обратимой реакции.
5.Будет ли DS > 0, DS < 0 или DS » 0 для процесса СН3СООН « СН3СОО- + Н+. Почему?
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций.
PH3 + KMnO4 + H2SO4 ® H3PO4 + MnSO4 + K2SO4 + H2O.
7.Составьте схему гальванического элемента, электродами которого является стандартный водородный электрод и кадмиевый, опущенный в раствор CdSO4 c концентрацией 0,1 моль/л. Чему равна ЭДС этого элемента? Какие реакции протекают на электродах?
8.При электролизе водного раствора сульфата никеля с никелевым анодом в течении 10 минут при силе тока в 5А масса анода уменьшилась на 0,9 г. Вычислить выход по току, приведите электронные уравнения процессов, протекающих на электродах при электролизе сульфата никеля с никелевым анодом.
9.Цинк склепан с никелем. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на цинковой и никелевой пластинах.
10.Напишите электронные формулы частиц: Se, As3+, Ge2+, Bг-. Определите, какие частицы являются изоэлектронными, т.е. содержащими одинаковое число электронов.
ВАРИАНТ 14.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
Mn2O7 + Ca (OH)2 ® BaHPO4 + Ba (OH)2 ®
CuO + H3AsO4 ® PbOHNO3 + HNO3 ®
ZnS + HСlO4 ® Hg + HCl ®
2.Найдите молярность 36,2 % раствора HCl, плотность которого 1,18 г/см3.
3.Возможно ли получить SO2Cl2 по уравнению: SO2 (г) + Cl2 (г) = SO2Cl (г)
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| SO2 (г) | - 297,1 | 248,2 |
| Cl2 (г) | - 222,9 | |
| SO2Cl (г) | - 363,4 | 311,5 |
4.Напишите математическое выражение закона действия масс (кинетическое уравнение) для гомогенной реакции
Н2 + Cl2 « 2HCl DH0Х.Р. = - 184 кДж
Как изменится скорость прямой реакции, если объем, занимаемый газами, уменьшится в 3 раза? Как повлияют повышение температуры и повышение давления на равновесие?
5.Чему равен общий порядок реакции 2А + В = С, если кинетическое уравнение имеет вид: V = kCA × CВ
6.Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций
CrCl3 + Br2 + KOH ® K2CrO4+ KBr + KCl + H2O
7. Составьте схему гальванического элемента, электродами которого является стандартный водородный электрод и никелевый, опущенный в раствор NiSO4 с концентрацией 0,001 моль/л. Чему равна ЭДС этого элемента? Какие реакции протекают на электродах ?
8.Напишите процессы, протекающие при электролизе водных растворов:
Ba (OH)2; H3PO4; SnCl2; KI.
9. Железо склепано с кадмием. Какой из металлов будет подвергаться коррозии, если металлы попадут в кислую среду? Составьте схему образующихся микрогальванопар и напишите процессы, протекающие на железной и кадмиевой пластинах.
10.Напишите электронные формулы частиц: Kr, Sr2+, Se2-, Bг-. Определите, какие частицы являются изоэлектронными, т.е. содержащими одинаковое число электронов.
ВАРИАНТ 15.
1.Определите, какие реакции будут протекать. Напишите их уравнения и назовите все вещества по международной номенклатуре.
ZnO + NaOH ® NaHSO4 + KOH ®
NiO + H3PO4 ® Mg2 (OH)2CO3 + HСlO4 ®
K2CO3 + Ca (OH)2 ® Hg + CuCl2 ®
2.Сколько грамм Na2CO3 содержится в 500 мл 0,50 Н раствора? Какова молярность этого раствора?
3.Возможно ли получить CoCl2 по уравнению Co (г) + Cl2 (г) = CoCl2 (г)
| Вещество | DН0298 кДж/моль | DS0298 Дж/моль × К |
| Co (г) | - 110,6 | 197,7 |
| Cl2 (г) | - 222,9 | |
| CoCl2 (г) | - 220,3 | 283,9 |
4.Вычислите константу равновесия реакции: СО2 (г) + 2Н2 (г) = СН3ОН (г) DН0Х.Р. = 193,3 кДж, если равновесные концентрации ССО = 0,3 моль/л; СН2 =
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|