
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 2 страница
2.
Гидроксиды.
Гидроксид магния, гидроксиды щелочноземельных металлов – характер основный, гидроксид бериллия – характер амфотерный.
Сa(OH)2 (избыток) + CO2 = СaCO3 + H2O
Ca(OH)2 + 2CO2(избыток) = Ca(HCO3)2
Ca(OH)2(избыток) + SO2 = CaSO3↓ + H2O
Ca(OH)2 + 2SO2(избыток) = Ca(HSO3)2
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ca(OH)2 + 2CH3COOH = (CH3COO)2Ca + 2H2O
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
3Mg(OH)2 + H3PO4 = (MgOH)3PO4 + 3H2O
Mg(OH)2  MgO + H2O
MgO + H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
3.
Соли.
Са(НСО3)2 + 2HNO3 = Ca(NO3)2 + 2H2O + 2CO2
СаСО3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
(CH3COO)2Ca + Na2CO3 = CaCO3↓+ 2CH3COONa
Ca(NO3)2 + Na2CO3 = CaCO3↓ + 2NaNO3
Ca(ClO)2 + 4NaBr + 2H2O = CaCl2 + 4NaOH + 2Br2
CaCO3 + C  CaC2 + 3CO
CaC2 + 3CO
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
CaCO3  CaO + CO2
CaO + CO2
Са(НСО3)2  CaCO3
CaCO3  + CO2 + H2O
+ CO2 + H2O
2Ca(NO3)2  2CaO + 4NO2 + O2
2CaO + 4NO2 + O2
CaCl2 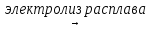 Ca + Cl2
Ca + Cl2
на катоде на аноде
CaCO3 + CO2 + H2O = Ca(HCO3)2
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2СО2
Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
CaCO3·MgCO3  CaO + MgO + 2CO2
CaO + MgO + 2CO2
BaSO3 + H2O2 = BaSO4 + H2O
BaS + 2HCl = BaCl2 + H2S↑
BаСО3 + 2HNO3 = Ba(NO3)2 + H2O + CO2↑
BaCO3 + 2HCl = BaCl2 + CO2 ↑ + H2O
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Ba(NO3)2 + FeSO4 = Fe(NO3)2 + ↓BaSO4
Ba(HS)2 + Na2CO3 = ↓BaCO3 + 2NaHS
Ba(NO3)2 + Na2SO4 = ↓BaSO4 + 2NaNO3
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
2Ba(NO3)2  2BaO + 4NO2↑ + O2↑
2BaO + 4NO2↑ + O2↑
CH3 – C – O – Ba – O – C – CH3  BaCO3 + CH3 – C – CH3
BaCO3 + CH3 – C – CH3
║ ║ ║
O O O
BaSO4 + 4C = BaS + 4CO
BaSO4 + 3C  BaS + 2CO + СО2
BaS + 2CO + СО2
BaSO4 + 4CO = BaS + 4CO2
BaSO4 + 4H2 = BaS + 4H2O
Ba(H2PO4)2 + 2Ba(OH)2 = Ba3(PO4)2 + 4H2O
Ba3(PO4)2 + 5C  3BaO + 2P + 5CO
3BaO + 2P + 5CO
3Ba(NO3)2 + 2Na3PO4 = Ba3(PO4)2↓ + 6NaNO3
Ba3(PO4)2 + 6HNO3 = 3Ba(NO3)2 + 2H3PO4
Ba(H2PO4)2 + 2HNO3 = Ba(NO3)2 + 2H3PO4
Mg(CH3COO)2 + 2NaOH = ↓Mg(OH)2 + 2CH3COONa
MgSO4 + (CH3COO)2Ba = ↓BaSO4 + (CH3COO)2Mg
MgI2 + 2AgNO3 = ↓2AgI + Mg(NO3)2
MgSO4 + Ba(NO3)2 = ↓BaSO4 + Mg(NO3)2
MgSO4 + Na2S = MgS↓ + Na2SO4
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2Mg(NO3)2  2MgO + 4NO2↑ + O2↑
2MgO + 4NO2↑ + O2↑
2MgSO4  2MgO + 2SO2 + O2
2MgO + 2SO2 + O2
MgCO3 + H2SO4 = MgSO4 + CO2↑ + H2O
MgS + 2HBr = MgBr2 + H2S↑
SrCO3 + CO2 + H2O = Sr(HCO3)2
SrSO4 + 4CО  SrS + 4CO2
SrS + 4CO2
Sr(HCO3)2  SrCO3 + CO2 + H2O
SrCO3 + CO2 + H2O
SrCO3 + 2HNO3 = Sr(NO3)2 + CO2↑ + H2O
Sr(NO3)2 + Na2SO3 = ↓SrCO3 + 2NaNO3
SrSO3 + H2O2 = SrSO4 + H2O
4.
Бинарные соединения.
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Са3Р2 + 6Н2О = 2РН3↑ + 3 Са(ОН)2
Mg3N2 + 3H2SO4 = 3MgSO4 + 2NH3↑
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
Mg2Si + 4H2O(хол.) = 2Mg(OH)2↓ + SiH4↑
СаH2 + 2H2O = Ca(OH)2 + H2↑
Ba3N2 + 6H2O = ↓3Ba(OH)2 + 2NH3
5Ca3P2 + 16KMnO4 + 24H2SO4 = 5Ca3(PO4)2 + 16MnSO4 + 8K2SO4 + 24H2O
Ca3P2 + 2KMnO4 + 4H2O = 3Ca(OH)2 + 2MnO2 + 2KOH + 2P
Ca3P2 + 8Cl2 + 8H2O = Ca3(PO4)2 + 16HCl
Ca3P2 (тв). + 8H2SO4(конц.) = Ca3(PO4)2 + 8SO2 + 8H2O
Ca3P2 + 22HNO3 = 3Ca(NO3)2 + 16NO2 + 2H3PO4 + 8H2O
3Ca3P2 + 8K2Cr2O7 + 64HCl = 3Ca3(PO4)2 + 16KCl + 16CrCl3 + 32H2O
Ca(ClO)2 + 4NaBr + 2H2O = CaCl2 + 4NaOH + 2Br2
IIА группа
1. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась, и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета; осадок растворился при дальнейшем пропускании газа. При кипячении полученного раствора выпадает осадок. Напишите уравнения описанных реакций.
2. Кальций растворили в воде. При пропускании через полученный раствор сернистого газа образуется осадок белого цвета, который растворяется при пропускании избытка газа. Добавление к полученному раствору щелочи приводит к образованию осадка белого цвета. Напишите уравнения описанных реакций.
3. Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и пркалили. При обработке продукта прокаливания хлороводородной кислотой выделился газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
4. Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
5. Через баритовую воду пропускали углекислый газ. В полученный раствор добавили гидроксид бария, продукт реакции отделили и растворили в ортофосфорной кислоте.
Напишите уравнения описанных реакций.
6. Через раствор, полученный при гашении извести, пропустили газ, который образуется при получении негашеной извести из известняка; в результате выделяется белый осадок. При действии уксусной кислоты на полученный осадок выделяется тот же газ, который образуется при прокаливании карбоната кальция. Напишите уравнения описанных реакций.
7. Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при кальцинировании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение осадка. Напишите уравнения описанных реакций.
8. Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
9. Магниевую стружку нагрели в атмосфере азота и продукт реакции последовательно обработали кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций
10. Негашеную известь прокалили с избытком кокса. Продукт реакции после обработки водой используется для поглощения сернистого и углекислого газов. Напишите уравнения описанных реакций.
11. Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагрели до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
12. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
13. Простое вещество, полученное при нагревании фосфата кальция с коксом и оксидом кремния, сплавили с металлическим кальцием. Продукт реакции обработали водой, а выделяющийся газ собрали и пропустили через раствор соляной кислоты. Напишите уравнения описанных реакций.
14. Фосфат кальция прокалили с углём в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
15) Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода.
Напишите уравнения описанных реакций.
16) Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
17) Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
18) Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. выделившийся при этом газ прореагировал с избытком гидроксида кальция с выпадением осадка белого цвета. Осадок растворили в избытке раствора бромоводородной кислоты и в полученный раствор добавили раствор нитрата серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
19) Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
20) Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твердый продукт сжигания растворили в концентрированном растворе гидроксида цезия. Напишите уравнения описанных реакций.
21) Магний нагрели в атмосфере азота. При добавлении к полученному веществу воды выделился газ, который пропустили над нагретым оксидом свинца (II). Полученное твердое вещество темного цвета растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
22) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ сначала пропустили над нагретым оксидом меди (II), а полученный газ пропустили через раствор гидроксида кальция до тех пор, пока первоначально выпавший осадок не растворился. Напишите уравнения описанных реакций.
23) Барий растворили в воде. К полученному раствору добавили сульфат калия, выпавший осадок отфильтровали, после чего через горячий фильтрат пропустили газообразный хлор. Реакционную массу выпарили, а затем прокалили до образования одной соли. Напишите уравнения описанных реакций.
24) Магний растворили в разбавленной азотной кислоте. К полученному раствору последовательно добавили гидроксид натрия, бромоводородную кислоту, фосфат натрия. Напишите уравнения описанных реакций.
25) Барий растворили в разбавленной азотной кислоте, при этом выделился бесцветный газ – несолеобразующий оксид. Полученный раствор разделили на три части. Первую выпармлм досуха, полученный осадок прокалили. Ко второй части добавили раствор сульфата натрия до прекращения выделения осадка; к третьей добавили раствор карбоната натрия. Напишите уравнения описанных реакций.
26) Сульфат бария сплавили с коксом. Твердый остаток растворили в соляной кислоте, выделившийся газ вступил в реакцию оксидом серы (IV), а раствор – с сульфитом натрия. Напишите уравнения описанных реакций.
IIА группа
1) СаСО3 + 2HCl = CaCl2 + CO2↑ + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
Ca(HCO3)2
CaCO3 + CO2 + H2O
2) Ca + 2H2O = Ca(OH)2 + H2↑
Ca(OH)2 + SO2 = CaSO3↓ + H2O
CaSO3 + SO2 + H2O = Ca(HSO3)2
Ca(HSO3)2 + Ca(OH)2 = 2CaSO3↓ + 2H2O
3) SO2 + Br2 + 2H2O = 2HBr + H2SO4
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
BaSO4 + 4С  BaS + 4CO↑
BaS + 4CO↑
BaS + 2HCl = ВaCl2 + H2S↑
4) Са + H2  CaH2
CaH2
СаH2 + 2H2O = Ca(OH)2 + H2↑
ZnO + H2  Zn + H2O
Zn + H2O
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
5) Ba(OH)2 + CO2 = BaCO3 + H2O
BaСО3 + CO2 + H2O = Вa(HCO3)2
Вa(HCO3)2 + Ba(OH)2 = 2BaCO3↓ + 2H2O
BaCO3 + 2Н3РО4 = СО2 + H2O + Ва(Н2РО4)2
6) СаСО3  СаО + СО2↑
СаО + СО2↑
СаО + Н2О = Са(ОН)2
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2СН3СООН = (СН3СОО)2Са + СО2 ↑ + H2O
7) CaO + H2O = Ca(OH)2
2NaHCO3  Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
8) 2Mg + Si  Mg2Si
Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
3SiH4 + 8KMnO4 = 8MnO2 ↓ + 3SiO2 ↓ + 8KOH + 2H2O
9) 3Mg + N2  Mg3N2
Mg3N2
Mg3N2 + 6H2O(гор.) = 3Mg(OH)2↓ + 2NH3↑
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
MgSO4 + Ba(NO3)2 = BaSO4↓ + Mg(NO3)2
10) СaO + C  CaC2 + CO↑
CaC2 + CO↑
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Ca(OH)2 + CO2 = CaCO3↓ + H2O
или Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ca(OH)2 + SO2 = CaSO3↓ + H2O
или Ca(OH)2 + 2SO2 = Ca(HSO3)2
11) 3Mg + 2NH3  Mg3N2 + 3H2↑
Mg3N2 + 3H2↑
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
NH4Br  NH3↑ + HBr↑
NH3↑ + HBr↑
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaBr
12) 2Mg + Si  Mg2Si
Mg2Si
Mg2Si + 4H2O(хол.) = 2Mg(OH)2↓ + SiH4↑
SiH4+ 2H2O(гор.) = SiO2 + 4Н2
SiO2 + 2NaOH  Na2SiO3 + H2O
Na2SiO3 + H2O
13) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
3Ca + 2P  Ca3P2
Ca3P2
Ca3P2 + 6H2O = 3Ca(OH)2↓ + 2PH3↑
PH3 + HCl = PH4Cl
14) Ca3(PO4)2 + 5C + 3SiO2  3CaSiO3 + 5CO + 2P
3CaSiO3 + 5CO + 2P
2P + 5Cl2 = 2PCl5
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
2K3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6KOH
15) 3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
16) KNO2 + NH4Cl  KCl + N2↑ + 2H2O
KCl + N2↑ + 2H2O
3Mg + N2 = Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2↑ + 4NaCl
17) 4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
NH4NO3 + KOH  NH3↑ + KNO3 + H2O
NH3↑ + KNO3 + H2O
4NH3 + 3O2 = 2N2 + 6H2O
18) 3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 2CO2↑ + 3NaNO2
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CaCO3 + 2HBr = CaBr2 + CO2↑ + H2O
CaBr2 + 2AgNO3 = 2AgBr↓ + Ca(NO3)2
19) Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
PH3 + 2O2 = H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
K3PO4 + 3AgNO3 = Ag3PO4↓ + 3KNO3
20) SiO2 + 2Mg = 2MgO + Si
2Mg + Si = Mg2Si или
SiO2 + 4Mg = 2MgO + Mg2Si
Mg2Si + 4H2O = 2Mg(OH)2↓ + SiH4↑
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + 2CsOH = Cs2SiO3 + H2O
21) 3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
2NH3 + 3PbO = 3Pb + N2 + 3H2O
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
22) H2C2O4 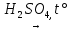 H2O + CO↑ + CO2↑
H2O + CO↑ + CO2↑
CO + CuO = Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
23) Ba + 2HCl = BaCl2 + H2
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
BaSO4 + 4C  BaS + 4CO
BaS + 4CO
3CO + Fe2O3  2Fe + 3CO2
2Fe + 3CO2
24) 4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O + 5H2O
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
3MgBr2 + 2Na3PO4 = Mg3(PO4)2↓ + 6NaBr
25) 4Ba + 10HNO3(разб.) = Ba(NO3)2 + N2O + 5H2O
Ba(NO3)2  Ba(NO2)2 + O2
Ba(NO2)2 + O2
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
Ba(NO3)2 + Na2CO3 = BaCO3↓ + 2NaNO3
26) BaSO4 + 4C  BaS + 4CO
BaS + 4CO
BaS + 2HCl = ВaCl2 + H2S↑
H2S + SO2 = 2H2O + 3S↓
BaCl2 + Na2SO3 = BaSO3↓ + 2NaCl
Алюминий. Соединения алюминия.
i.
Алюминий.
Порошкообразный алюминий легко взаимодействует с неметаллами:
4Al + 3O2 = 2Al2O3
2Al + N2 = 2AlN
4Al + 3C 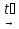 Al4C3
Al4C3
2Al + 3Br2 = 2AlBr3
2Al + 3Cl2 = 2AlCl3
2Al + 3I2 = 2AlI3
2Al + 3S = Al2S3
Очищенный от оксидной пленки алюминий способен взаимодействовать с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
Алюминий восстанавливает металлы из их оксидов (алюмотермия)
2Al + Cr2O3 = Al2O3 + 2Cr
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Как активный металл алюминий реагирует с растворами кислот с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб.) = Al2(SO4)3 + 3H2
Концентрированные серная и азотная кислоты на холоду пассивируюталюминий, однако, при сильном нагревании они растворяют алюминий.
2Al + 6H2SO4 (конц.)  Al2(SO4)3 + 3SO2 + 6H2O
Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(конц..)  Al(NO3)3 + 3NO2 + 3H2O
Al(NO3)3 + 3NO2 + 3H2O
10Al + 36HNO3(разб.) = 10Al(NO3)3 + 3N2 + 48H2O
8Al + 30HNO3(разб.) = 8Al(NO3)3 + 3N2O + 15H2O
8Al + 30HNO3(оч. разб.) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
При нагревании с концентрированными растворами щелочей алюминий образует комплексные соли.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2Al + 6NaOH  2Na3AlO3 + 3H2 (сплавление)
2Na3AlO3 + 3H2 (сплавление)
2Al + 3Na2O2  2NaAlO2 + 2Na2O
2NaAlO2 + 2Na2O
8Al + 3KNO3 + 5KOH + 18H2O = 8K[Al(OH)4] + 3NH3
10Al + 6KMnO4 + 24H2SO4 = 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O
2Al + NaNO2 + NaOH + 5H2O = 2Na[Al(OH)4] + NH3
Al + 3KMnO4 + 4KOH = 3K2MnO4 + K[Al(OH)4]
4Al + K2Cr2O7  2Cr + 2KAlO2 + Al2O3
2Cr + 2KAlO2 + Al2O3
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|