
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IIА группа 1 страница
Щелочные металлы и их соединения.
Щелочные металлы.
Щелочные металлы легко реагируют с неметаллами:
2K + I2 = 2KI
2Na + H2 = 2NaH
6Li + N2 = 2Li3N (реакция идет уже при комнатной температуре)
3K + P = K3P
2Na + S = Na2S
2Na + 2C = Na2C2
В реакциях с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – пероксид, калий – надпероксид.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
K + O2 = KO2
Получение оксида натрия:
10Na + 2NaNO3 = 6Na2O + N2 ↑
2Na + Na2O2 = 2Na2O
2Na + 2NaOН = 2Na2O + Н2↑
Взаимодействие с водой приводит к образованию щелочи и водорода.
2Na + 2H2O = 2NaOH + H2↑
Взаимодействие с кислотами:
2Na + 2HCl = 2NaCl + H2↑
8Na + 5H2SO4(конц.) = 4Na2SO4 + H2S + 4H2O
2Li + 3H2SO4(конц.) = 2LiHSO4 + SO2 + 2H2O
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
При взаимодействии с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
Взаимодействие с органическими соединениями:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
2CH3Cl + 2Na → C2H6 + 2NaCl
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2СН3ОН + 2Na → 2 CH3ONa + H2↑
2СH3COOH + 2Na → 2CH3COOONa + H2↑
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами. Ион Li+ окрашивает пламя в кармино-красный цвет, ион Na+ – в желтый, К+ – в фиолетовый
Соединения щелочных металлов
Оксиды.
Оксиды щелочных металлов типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
3Na2O + P2O5 = 2Na3PO4
Na2O + Al2O3 = 2NaAlO2
Na2O + 2HCl = 2NaCl + H2O
Na2O + 2H+ = 2Na+ + H2O
Na2O + H2O = 2NaOH
Пероксиды.
2Na2O2 + CO2 = 2Na2CO3 + O2↑
Na2O2 + CO = Na2CO3
Na2O2 + SO2 = Na2SO4
2Na2O + O2 = 2Na2O2
Na2O + NO + NO2 = 2NaNO2
2Na2O2 = 2Na2O + O2↑
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
Na2O2 + 2HCl = 2NaCl + H2O2
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
2Na2O2 + S = Na2SO3 + Na2O
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
Основания (щелочи).
2NaOH(избыток) + CO2 = Na2CO3 + H2O
NaOH + CO2 (избыток) = NaHCO3
SO2 + 2NaOH (избыток) = Na2SO3 + H2O
SiO2 + 2NaOH  Na2SiO3 + H2O
Na2SiO3 + H2O
2NaOH + Al2O3  2NaAlO2 + H2O
2NaAlO2 + H2O
2NaOH + Al2O3 + 3H2O = 2Na[Al(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4]
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO3 = K2CO3 + H2O
2NaOH + Si + H2O = Na2SiO3 + H2
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
Соли.
2NaNO3  2NaNO2 + O2
2NaNO2 + O2
Na2CO3 + 2NH4Cl = 2NaCl + CO2 + 2NH3 + Н2О
NaHCO3 + HNO3 = NaNO3 + CO2 + H2O
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
NaI → Na+ + I–
на катоде: 2Н2О + 2e → H2 + 2OH– 1
на аноде : 2I– – 2e → I2 1
2Н2О + 2I–  H2 + 2OH– + I2
H2 + 2OH– + I2
2H2O + 2NaI  H2 + 2NaOH + I2
H2 + 2NaOH + I2
8KI + 5H2SO4(конц.) = 4K2SO4 + H2S + 4I2 + 4H2O
2NaCl 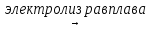 2Na + Cl2
2Na + Cl2
на катоде на аноде
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
2Na2HPO4 →Na4P2O7 + H2O (?)
KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
4KClO3  KCl + 3KClO4
KCl + 3KClO4
2KClO3 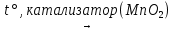 2KCl + 3O2
2KCl + 3O2
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O
2NaI + Br2 = 2NaBr + I2
2NaBr + Cl2 = 2NaCl + Br2
I A группа.
1. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезает через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2. Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
3. Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганата калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
4. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, внесли в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой, и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций
5. Вещество, полученное на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Поученный продукт последовательно обработали сернистым газом и раствором гидроксида бария. Напишите уравнения описанных реакций
6. Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода; при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций
7. Неизвестный металл сожгли в кислороде. Продукт реакции, взаимодействует с углекислым газом, образует два вещества: твердое, которое взаимодействует с раствором соляной кислоты с выделением углекислого газа, и газообразное простое вещество, поддерживающее горение. Напишите уравнения описанных реакций.
8. Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели, выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
9. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха; при нагревании этой соли без катализатора образуются соль Б и соль высшей кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется желто-зеленый газ (простое вещество) и образуется соль Б. Соль Б окрашивает пламя в фиолетовый цвет, при ее взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
10. К нагретой концентрированной серной кислотой добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагрели с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
11. Поваренную соль обработали концентрированной серной кислотой. Полученную соль обработали гидроксидом натрия. Полученный продукт прокалили с избытком угля. Выделившийся при этом газ прореагировал в присутствии катализатора с хлором. Напишите уравнения описанных реакций.
12. Натрий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с хлором, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
13. Натрий сожгли в избытке кислорода, полученное кристаллическое вещество поместили в стеклянную трубку и пропустили через неё углекислый газ. Газ, выходящий из трубки, собрали и сожгли в его атмосфере фосфор. Полученное вещество нейтрализовали избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
14. К раствору, полученному в результате взаимодействия пероксида натрия с водой при нагревании, добавили раствор соляной кислоты до окончания реакции. Раствор образовавшейся соли подвергли электролизу с инертными электродами. Газ, образовавшийся в результате электролиза на аноде, пропустили через суспензию гидроксида кальция. Напишите уравнения описанных реакций.
15. Через раствор гидроксида натрия пропустили сернистый газ до образования средней соли. К полученному раствору прилили водный раствор перманганата калия. Образовавшийся осадок отделили и подействовали на него соляной кислотой. Выделившийся газ пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
16. Смесь оксида кремния (IV) и металлического магния прокалили. Полученное в результате реакции простое вещество обработали концентрированным раствором гидроксида натрия. Выделившийся газ пропустили над нагретым натрием. Образовавшееся вещество поместили в воду. Напишите уравнения описанных реакций.
17. Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали раствором хлорида бария. Раствор профильтровали, а фильтрат смешали с раствором нитрата натрия и нагрели. Напишите уравнения описанных реакций.
18. Натрий нагрели в атмосфере водорода. При добавлении к полученному веществу воды наблюдали выделение газа и образование прозрачного раствора. Через этот раствор пропустили бурый газ, который был получен в результате взаимодействия меди с концентрированным раствором азотной кислоты. Напишите уравнения описанных реакций.
19. Гидрокарбонат натрия прокалили. Полученную соль растворили в воде и смешали с раствором алюминия, в результате образовался осадок и выделился бесцветный газ. Осадок обработали избытком раствора азотной кислоты, а газ пропустили через раствор силиката калия. Напишите уравнения описанных реакций.
20. Натрий сплавили с серой. Образовавшееся соединение обработали соляной кислотой, выделившийся газ нацело прореагировал с оксидом серы (IV). Образовавшееся вещество обработали концентрированной азотной кислотой. Напишите уравнения описанных реакций.
21. Натрий сожгли в избытке кислорода. Образовавшееся вещество обработали водой. Полученную смесь прокипятили, после чего в горячий раствор добавили хлор. Напишите уравнения описанных реакций.
22. Калий нагрели в атмосфере азота. Полученное вещество обработали избытком соляной кислоты, после чего к образовавшейся смеси солей добавили суспензию гидроксида кальция и нагрели. Полученный газ пропустили рад раскаленным оксидом меди (II).Напишите уравнения описанных реакций.
23. Калий сожгли в атмосфере хлора, образовавшуюся соль обработали избытком водного раствора нитрата серебра. Выпавший осадок отфильтровали, фильтрат выпарили т осторожно нагрели. Образовавшуюся соль обработали водным раствором брома. Напишите уравнения описанных реакций.
24. Литий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с бромом, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
25. Натрий сожгли на воздухе. Образовавшееся при этом твердое вещество поглощает углекислый газ с выделением кислорода и соли. Последнюю соль растворили в соляной кислоте, а к полученному при этом раствору добавили раствор нитрата серебра. При этом выпал белый осадок. Напишите уравнения описанных реакций.
26. Кислород подвергли воздействию электроразряда в озонаторе. Полученный газ пропустили через водный раствор йодида калия, при этом выделился новый газ без цвета и запаха, поддерживающий горение и дыхание. В атмосфере последнего газа сожгли натрий, а полученное при этом твердое вещество прореагировало с углекислым газом. Напишите уравнения описанных реакций.
I A группа. (ответы)
1. N2 + O2 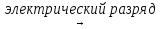 2NO
2NO
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3  2NaNO2 + O2
2NaNO2 + O2
2. 2NaCl 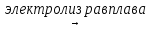 2Na + Cl2
2Na + Cl2
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2CO3 + 2NH4Cl = 2NaCl + CO2 + 2NH3 + Н2О
3. NaHCO3 + HNO3 = NaNO3 + CO2 + H2O
2NaNO3  2NaNO2 + O2
2NaNO2 + O2
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
4. 2H2O + 2NaI  H2 + 2NaOH + I2
H2 + 2NaOH + I2
2K + I2 = 2KI
8KI + 5H2SO4(конц.) = 4K2SO4 + H2S + 4I2 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3↓ + 3S↓ + 4KOH
5. 2NaCl 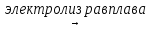 2Na + Cl2
2Na + Cl2
на катоде на аноде
2Na + O2 = Na2O2
Na2O2 + SO2 = Na2SO4
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
6. P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 4NaOH = 2Na2HPO4 + H2O
2Na2HPO4  Na4P2O7 + H2O
Na4P2O7 + H2O
7. 2Na + O2  Na2O2
Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
C + O2 = CO2
8. 2KOH + 2NO2 + O2 = 2KNO3 + H2O
KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
NH3 + HNO3 = NH4NO3
NH4NO3  N2O + 2H2O (190 – 245°C)
N2O + 2H2O (190 – 245°C)
2NH4NO3  2NO + N2 + 4H2O (250 – 300°C)
2NO + N2 + 4H2O (250 – 300°C)
2NH4NO3  2N2 + О2 + 4H2O (выше 300°C)
2N2 + О2 + 4H2O (выше 300°C)
9. 2KClO3 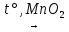 2KCl + 3O2 ↑
2KCl + 3O2 ↑
4KClO3  KCl + 3KClO4
KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
10. 2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + S = Na2S2O3
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O
11. NaCl(тверд.) + H2SO4(конц.) = NaHSO4 + HCl↑
NaHSO4 + NaOH = Na2SO4 + H2O
Na2SO4 + 4C  Na2S + 4CO↑
Na2S + 4CO↑
CO + Cl2 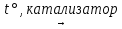 COCl2
COCl2
12. 2Na + H2 = 2NaH
NaH + H2O = NaOH + H2↑
H2 + Cl2 = 2HCl
6NaOH + 3Cl2 = NaClO3 + 5NaCl + 3H2O
13. 2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
4P + 5O2 = 2P2O5
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
14. 2Na2O2 + 2H2O = 4NaOH + O2↑
NaOH + HCl = NaCl + H2O
2H2O + 2NaCl
H2↑ + 2NaOH + Cl2↑
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
15. 2NaOH + SO2 = Na2SO3 + H2O
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
2NaOH(холодный) + Cl2 = NaCl + NaClO + H2O
16. SiO2 + 2Mg = 2MgO + Si
2NaOH + Si + H2O = Na2SiO3 + 2H2
2Na + H2 = 2NaH
NaH + H2O = NaOH + H2
17. 6Li + N2 = 2Li3N
Li3N + 3H2O = 3LiOH + NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
18. 2Na + H2 = 2NaH
NaH + H2O = NaOH + H2
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
2NaOH + 2NO2 = NaNO3 + NaNO2 + H2O
19. 2NaHCO3  Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
3Na2CO3 + 2AlBr3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaBr
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
К2SiO3 + 2CO2 + 2H2O = 2КHCO3 + H2SiO3↓
20. 2Na + S = Na2S
Na2S + 2HCl = 2NaCl + H2S↑
SO2 + 2H2S = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
21. 2Na + O2 = Na2O2
Na2O2 + 2H2O = 2NaOH + H2O2
2H2O2  2H2O + O2
2H2O + O2
6NaOH (гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
22. 6K + N2 = 2K3N
K3N + 4HCl = 3KCl + NH4Cl
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
2NH3 + 3CuO = N2 + 3Cu + 3H2O
23. 2K + Cl2 = 2KCl
KCl + AgNO3 = KNO3 + AgCl↓
2KNO3  2KNO2 + O2
2KNO2 + O2
KNO2 + Br2 + H2O = KNO3 + 2HBr
24. 2Li + H2 = 2LiH
LiH + H2O = LiOH + H2
H2 + Br2 = 2HBr
6LiOH(гор.) + 3Cl2 = LiClO3 + 5LiCl + 3H2O
25. 2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
26. 3O2 ↔ 2O3
O3 + 2KI + H2O = I2 + O2↑ + 2KOH
2Na + O2 = Na2O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
IIА группа
Металлы IIA группы.
Химические свойства щелочноземельных металлов во многом напоминают свойства щелочных металлов, а магний и бериллий имеют некоторые характерные особенности.
Бериллий, магний и щелочноземельные металлы горят на воздухе.
2Be + O2 = 2BeO
2Mg + O2 = 2MgO
2Ba + O2 = 2BaO
2Сa + O2 = 2CaO
Взаимодействие с неметаллами приводит к образованию бинарных соединений.
Са + S = СаS
Mg + S = MgS
2Mg + Si 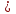 Mg2Si
Mg2Si
3Mg + N2 = Mg3N2
3Ba + N2 = Ba3N2
Са + H2 = CaH2
Be + S = BeS
Be + Cl2 = BeCl2
При комнатной температуре с водой реагируют только щелочноземельные металлы. Магний при нагревании.
Ca + 2H2O = Ca(OH)2 + H2↑
Mg + 2H2O  Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
Металлы IIА группы активно реагируют с разбавленными кислотами:
Mg + 2HCl = MgCl2 + Н2
Mg + H2SO4(разб.) = MgSO4 + H2
Ве + 2HCl = ВеCl2 + Н2
Бериллий не только образует амфотерные оксид и гидроксид, но и сам реагирует с щелочами в концентрированных растворах или при сплавлении:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Be + 2NaOH  Na2BeO2 + H2
Na2BeO2 + H2
Взаимодействие с кислотами окислителями (азотной, концентрированной серной)
3Ве + 8HNO3 (разб. гор.) = 3Ве(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
4Ca + 10HNO3 (разб.) = 4Ca(NO3)2 + N2O + 5H2O
4Ca + 10HNO3 (оч. разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
4Са + 5H2SO4(конц.) = 4СаSO4 + H2S + 4H2O
При взаимодействии с аммиаком образуются амиды и водород:
3Mg + 2NH3  Mg3N2 + 3H2
Mg3N2 + 3H2
Магний и кальций используют в качестве восстановителей.
MoO + Mg  Mo + MgO
Mo + MgO
V2O5 + 5Ca  5CaO + 2V
5CaO + 2V
Магний восстанавливает из оксидов не только металлы, но и неметаллы.
2Mg + CO2  2MgO + C
2MgO + C
2Mg + SiO2  Si + 2MgO (ниже 800°С)
Si + 2MgO (ниже 800°С)
4Mg + SiO2  Mg2Si + 2MgO ( 1000°С)
Mg2Si + 2MgO ( 1000°С)
2CO2 + 5Ca  CaC2 + 4CaO
CaC2 + 4CaO
4Mg + KNO3 + 6H2O = KOH + 4Mg(OH)2 + NH3
ii.
Cоединения металлов IIА группы
1.
Оксиды.
Оксид магния, оксиды щелочноземельных металлов – основные. Вступают в реакции с водой, кислотными оксидами, кислотами. Оксид бериллия – амфотерный. Амфотерность оксида бериллия выражается в его способности реагировать как с кислотами, так и с щелочами при сплавлении или в растворе.
CaO + H2O = Ca(OH)2 (реакция идет при комнатной температуре)
MgO + H2O(пар) = Mg(OH)2 (100° – 150°С)
CaO + CO2 = CaCO3
MgO + H2SO4 = MgSO4 + H2O
MgO + 2HI = MgI2 + H2O
MgO + 2HCl = MgCl2 + H2O
MgO + 2HNO3 = Mg(NO3)2 + H2O
BaO + 2H2S = Ba(HS)2 + H2O
BeO + 2HCl = BeCl2 + H2O
BeO + 2NaOH  Na2BeO2 + H2O
Na2BeO2 + H2O
BeO + 2NaOH + H2O = Na2[Be(OH)4]
BaO2 + 2H2SO4 + 2FeSO4 = BaSO4 + Fe2(SO4)3 + 2H2O
MgO + H2O + CO2 = (MgOH)2CO3
MgO + CO = Mg + CO2
3BaO + Si = BaSiO3 + 2Ba
СaO + C  CaC2 + CO
CaC2 + CO
MgO + C = Mg + CO
2MgO + CaO + Si = CaSiO3 + 2Mg
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|