
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ерітінді – газ шекаралық бөлу қабатындағы беттік құбылыс.
СОӨ Ж №6
Ерітінді – газ шекаралық бө лу қ абатындағ ы беттік қ ұ былыс.
Беттің майысуы Н берілген нү ктеде беттің ауданының кө лем бойынша туындысымен анық талады:
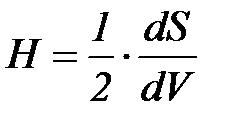
немесе келесі қ атынас кө мегімен
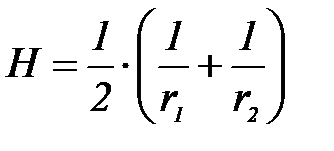
Сфералық бө лшектер ү шін

Беттік қ абат молекулалары екі фаза молекулаларымен де ә рекеттеседі, нә тижесінде беттік қ абаттағ ы молекулалық кү штер кө бірек ә рекеттесетін фаза ішіне қ арай бағ ытталады. Бетті кішірейтуге тырысатын беттік керілу пайда болады.
Беттік керілуді молекуланың кө лемінен беттік қ абатқ а ө ту энергиясы немесе бірлік бкттің тү зілу жұ мысы деп қ арастыруғ а болады:
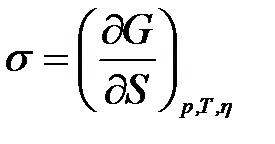
Беттік қ абаттың ішкі (толық ) энергиясы Гиббс – Гельмгольц тең деуімен байланысқ ан:

немесе

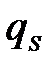 – бірлік беттің тү зілу жылуы.
– бірлік беттің тү зілу жылуы.
Жү йенің беттік Гиббс энергиясын азайтуғ а тырысуы фаза аралық беттік ө здігінен кішіреюінен (пішіні мен майысуының ө згеруі, коагуляция, коалесценция т. б. процестер) жә не беттік керілудің кішіреюінен (адсорбция, адгезия, ылғ алдану процестері, электр потенциялының пайда болуы т. б. ) байқ алады.
Беттің майысуының ө згеруі денелерде ішкі қ ысымының ө згерісін тудырады. Беті майысқ ан жә не тегіс сұ йық ішіндегі қ ысымда айырмасы 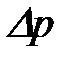 капиллярлық қ ысым деп аталады. Лаплас тең деуі капиллярлық қ ысым мен беттің майысуы арасындағ ы байланысты кө рсетеді:
капиллярлық қ ысым деп аталады. Лаплас тең деуі капиллярлық қ ысым мен беттің майысуы арасындағ ы байланысты кө рсетеді:
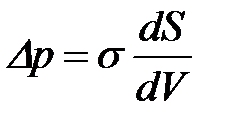
Беттің майысуы ө згеруімен зат ү стіндегі бу қ ысымы да ө згереді. Кельвин – Томсонның капиллярлық конденсация тең деуі бойынша:
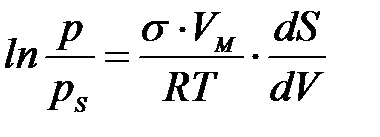
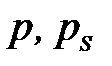 – майысуы бар жә не тегіс беттер ү стіндегі қ анық қ ан бу қ ысымы;
– майысуы бар жә не тегіс беттер ү стіндегі қ анық қ ан бу қ ысымы; 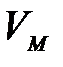 – конденсерленген кү йдегі заттың мольдік кө лемі; R – универсал газ тұ рақ тысы.
– конденсерленген кү йдегі заттың мольдік кө лемі; R – универсал газ тұ рақ тысы.
Егер сұ йық немесе қ атты дене басқ а сұ йық пен немесе қ атты денемен жанасатын болса, олардың арасында адгезия байқ алады.
Адгезия жұ мысы Дюпре тең деуімен анық талады
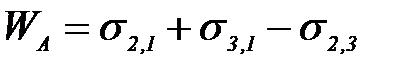
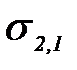 –
–
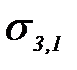 –
–
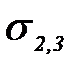 –
–
Сұ йық жә не басқ а конденсирленген фаза арасындағ ы ә рекеттесу шеткі бұ рыш q кө мегімен анық талады.
Юнг тең деуі:
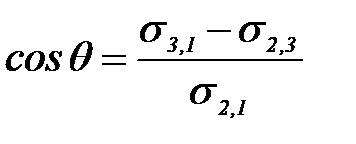
Адгезия жұ мысы:
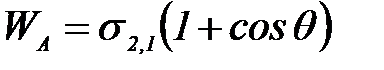
Сондай – ақ беттік керілуі тө мен заттардың беттік қ абатта ө здігінен жиналуы адсорбция нә тижесінде s азаяды.
Адсорбция шамасын екі ә діспен ө рнектейді. Беттің аудан бірлігіне немесе адсорбент масса бірлігіне келетін беттік қ абаттағ ы заттық мө лшері ретінде анық талады:
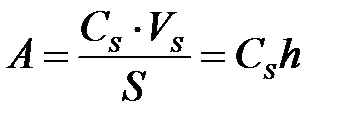
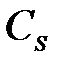 – беттік қ абаттағ ы компонент концентрациясы;
– беттік қ абаттағ ы компонент концентрациясы; 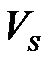 – беттік қ абат кө лемі; h – қ алың дығ ы.
– беттік қ абат кө лемі; h – қ алың дығ ы.
Адсорбция шамасын Г кө лемдік фаза кө леміндегі мө лшерімен салыстырғ анда беттік қ абаттағ ы компоненттің артық мө лшерімен анық талады ( артық адсорбция ):
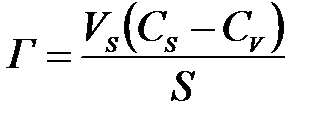
немесе
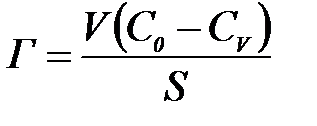
А жә не Г адсорбция шамалары арасындағ ы байланысы:
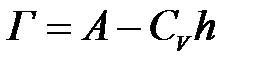
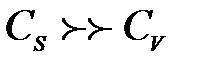 жағ дайда
жағ дайда 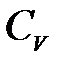 ескермеуге болады
ескермеуге болады 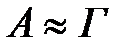 .
.
Ерітінді компоненттерінің адсорбция шамасы мен беттік керілу ө зара Гиббстің адсорбция тең деуімен байланысқ ан:
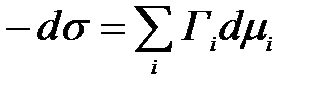
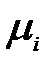 – компонентің химиялық потенциялы.
– компонентің химиялық потенциялы.
Бинарлы ерітіндіде адсорбат концентрациясы аз болса:
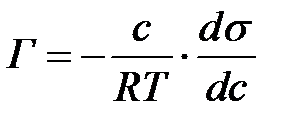
Мысал №3: 293К– де сынаптың шынығ а адгезия жұ мысын  есептең із. Шеткі бұ рыш
есептең із. Шеткі бұ рыш 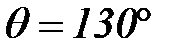 . Сынаптың беттік керілуі
. Сынаптың беттік керілуі 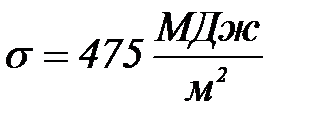 . Сынаптың шыны бетінде жайылу коэффициентін табың ыз.
. Сынаптың шыны бетінде жайылу коэффициентін табың ыз.
Шығ арылуы: Дюпре – Юнг тең деуі бойынша:
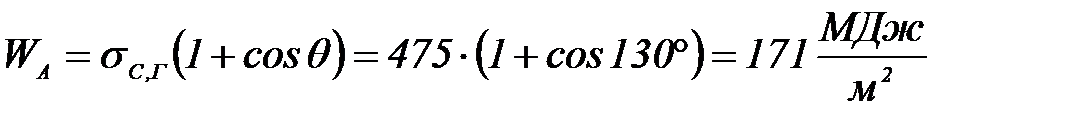
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|