
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
«Бейорганикалық химия» пәнінен 5 страница
F) [ Ni(CO)4]
101$$. [Ti(H2O)6]3+ - орталық атом заряды, сыртқ ы сфера заряды:
А) з. ц. а. = +3
В) з. в. с. = +3
C) з. в. с. = +4
D) з. ц. а. = +2
E) з. ц. а. = +1
F) з. ц. а. = -1
102$$. [TiF6]3- - сыртқ ы сфера заряды жә не координациялық сан:
A) з. в. с. = -3
B) к. ч. = 6
C) з. в. с. = +4
D) к. ч. = 5
E)з. в. с. = +3
F) к. ч. = 9
103$$. [CrCl6]3- орталық атом заряды жә не координациялық сан:
А) з. ц. а. = +3
B) к. ч. = 6
C) к. ч. = 5
D) з. ц. а. = +1
E) з. ц. а. = +2
F) к. ч. = 3
104$$. К4[Fe(CN)6] қ осылысына тә н:
А) сары қ ан тү сті тұ з
В) орталық атомы темір (ІІ)
C) бейтарап комплекс
D) катионды комплекс
E) орталық атом темір (ІІ)
F) қ ызыл қ ан тұ зы
105$$. Монодентантты лигандалар:
A) СN-, NH3-, I-
B) Сl-, Br-, F-
D) РО42-, С2О42-, Сl-
E) С2О42-, СN-, SСN-
F) ScO32-, NH3-, N2H4
106$$. Темір (ІІІ) ионы:
А) электрондық қ ұ рылымы 3d5
В) К4[Fe(CN)6] кө мегімен анық талады
С) К3[Fe(CN)6] кө мегімен анық талады
D) тек тотық тырғ ыш қ асиет тә н
Е) гидролизге ұ шырайды
F) тек тотық сыздандырғ ыш қ асиет тә н
107$$. [Zn(NH3)4](OH)2, K3[Co(NO2)6] кешенді қ осылыстарынң аты:
A) K3[Co(NO2)6] – калидің (III) гексанитрито кобальті
B) [Zn(NH3)4](OH)2 – мырыштың дигидроксотетраамині (II)
C) [Zn(NH3)4](OH)2 – мырыштың тетраамині (II)
D) K3[Co(NO2)6] – калийдің гексанитрато кобальті (II)
E) [Zn(NH3)4](OH)2, K3[Co(NO2)6] – аммиакаттар
F) K3[Co(NO2)6] – калий нитриті
108. Кординациялық изомерия мү мкіндігі бар, кешенді қ осылыс:
A) [Pt(NH3)4][CuCl4]
B) [Co(NH3)6][Cr(CN)6]
C) K4[Fe(CN)6]
D) [Pt(NH3)2Cl2]
E) [Co(NH3)5Br]SO4
F) [Co(En)2Cl2]NO2
109$$. Реакция ө здігінен жү руі мү мкін:
А) ∆ Н< 0
В) ∆ S> 0
C) ∆ G=0
D) ∆ S=0
E) ∆ S< 0
F) ∆ Н> 0
110$$. КОН жә не KCl суда еру ү рдісі:
A) экзотермиялық
B)эндотермиялық
C)реактивті
D)индифференті
E)ә ртү рлі
F)каталитті
111$$. Қ андай жағ дайда реакция ө здігінен жү руі мү мкін:
А) Δ G < 0
B) Δ H < 0
C) Δ G > 0
D) Δ G=0
E) Δ S < 0
F) Δ S = 0
112$$. Жү йенің реттілік жә не ретсіздік ө лшемін анық таушы:
А) энтропия
B) энтальпия
C) жылу эффектісі
D) ішкі энергия
E) кристалдану
F) Гельмгольц энергиясы
113$$. Реакцияларда стандартты энтропияның дұ рыс мә ні:
A) 2О3(г) = 3О2(г); ∆ S0 > 0
B) SO2(т) + 2H2S(г) = 2S(т) + 2H2O (ж); ∆ S0 < 0
C) HgBr2(т) = Hg(ж) + Br2(ж); ∆ S0 < 0
D) Cl2(г) + 5F2(г) = 2ClF5(г); ∆ S0 > 0
E) MgCO3(т) = MgO(т) + СО2(г); ∆ S0 < 0
F) MgCO3(т) = MgO(т) + СО2(г); ∆ S0 = 0
114$$. Реакцияларда стандартты энтропияның дұ рыс мә ні:
A) HgBr2(т) = Hg(ж) + Br2(ж); ∆ S0 > 0
B) Cl2(г) + 5F2(г) = 2ClF5(г); ∆ S0 < 0
C) СО2(г) + Н2(г) = СО(г) + Н2О(ж); ∆ S0 > 0
D) 2Н2О2(ж) = Н2О(ж) + О2(г); ∆ S0 < 0
E) CS2(ж) + 3O2(г) = CO2(г) + 2SO2(г); ∆ S0 > 0
F) Н2О(ж) = Н2О(г); ∆ S0 < 0
115$$. Энтропия мына жү йелерде ө згереді:
A) Н2О(ж) = Н2О(г)
B) I2(т) = I2(г)
C) C(т) + О2(г) = CО2(г)
D) 2HI(г) = H2(г) + I2(г)
E) СО(г) + Н2О(г) = СО2(г) + Н2(г)
F) Н2О(п) = Н2О(ж)
116$$. Реакцияларда стандартты энтропияның дұ рыс емес мә ні:
A) CO(г) + Cl2(г) = COCl2(г); ∆ S0 > 0
B) N2(г) + 3H2(г) = 2NH3(г); ∆ S0 > 0
C) СО2(г) + Н2(г) = СО(г) + Н2О(ж); ∆ S0 < 0
D) 2Н2О2(ж) = Н2О(ж) + О2(г); ∆ S0 > 0
E) MgCO3(т) = MgO(т) + СО2(г); ∆ S0 > 0
F) HgBr2(т) = Hg(ж) + Br2(ж); ∆ S0 > 0
117$$. ∆ S < 0 мына реакция ү шін:
A) 3H2(г) + N2(г) = 2NH3(г)
B) CO(г) + Cl2(г) = COCl2(г)
C) C(графит) + СО2(г) = 2СО(г)
D) Al(к) + Sb(к) = AlSb(к)
E) C(графит) + 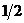 О2(г) = СО(г)
О2(г) = СО(г)
F) 2HI(г) = H2(г) + I2(г)
118$$. Кү й функциясы болмайтын термодинамикалық функциялар:
А)жылу
B) жұ мыс
С) энтропия
D) Гиббс энергиясы
E) ішкі энергия
F) энтальпия
119$$. Химиялық ү рдіс кез келген температурада жү ре алады, егер ол мынамен қ атар жү рсе:
A) энтальпияның тө мендеуі мен энтропияның ө суі
B) Гиббс энергиясының тө мендеуімен
C) энтальпия мен энтропия тө мендеуі
D) энтальпия мен энтропия ө суі
E) энтальпияның ө суі мен энтропияның тө мендеуі
F) Гиббс энергиясының артуымен
120$$. Химиялық ү рдіс кез келген температурада жү ре алмайды, егер ол мынамен қ атар жү рсе:
A) энтальпияның ө суі мен энтропияның кемуі
B) Гиббс энергиясының артуымен
C) Гиббс энергиясының тө мендеуімен
D) энтальпия мен энтропия тө мендеуімен
E) энтальпия мен энтропия артуымен
F) энтальпияның тө мендеуі мен энтропияның артуы
121$$. Тепе тенді ү рдістер ү шін (балқ у, қ айнау, сублимация) келесі термодинамикалық қ атынастар сә йкес болады:
A) Δ Н = TΔ S
B) Δ G=0
C) Δ G> 0
D) Δ G< 0
E) Δ G = Δ Н + TΔ S
F) U = A
122$$. Н =... энтальпия ү шін термодинамикалық ө рнектелу:
A) U + PV
B) G + TS
C) G - TS
D) U - TS
E) U + TS
F) U - PV
123$$. Химиялық реакцияның энтальпиясы тең:
A) реакцияда тү зілген ө німдер энтальпияның қ осындысынан бастапқ ы заттар энтальпиясының қ осындысын алып тастағ анғ а тең
B) бастапқ ы заттардың жану энтальпиясының қ осындысынан реакция ө німдерінің жану энтальпиясының қ осындысын алып тастағ анғ а тең
C) реакция ө німдерінің жану энтальпиясының қ осындысынан бастапқ ы заттардың жану энтальпиясының қ осындысын алып тастағ анғ а тең
D) бастапқ ы заттардың тү зілу энтальпиясының қ осындысын реакция ө німдерін тү зілу энтальпиясының қ осындысын алып тастағ анғ а тең
E) бастапқ ы заттардың энтальпия қ осындысынан реакция ө німдерінің энтальпияның қ осындысын алып тастағ анғ а тең
F) ішкі энергия мен энтальпия арасындағ ы айырымғ а тең
124$$. Мына реакцияда
4NH3(г) +3O2(г)®2N2(г) + 6H2O(г)
тепе тең дік оң ғ а ығ ысады:
А) қ ысымның тө мендеуі
B) NH3 концентрациясының артуы
C) NH3 концентрациясының тө мендеуі
D) қ ысымның артуы
E) N2 концентрациясының артуы
F) температура
125$$. Химиялық реакция жылдамдығ ына ә сер ететін факторлар:
A) температура
B) концентрация
C) уақ ыт
D) сағ ат
E) сұ йылту
F) ыдыс кө лемі
126. N2(г) + 3H2(г) = 2NH3(г); ∆ H < 0 химиялық реакциясында тепе тең дік оң ғ а ығ ысады егер:
A) Қ ысымды кө терсе
B) Аммиак коцентрациясын тө мендетсе
C) қ ысымды тө мендетсе
D) температураны кө терсе
E) температураны тө мендетсе
F) аммиак концентрациясын арттырса
127$$. CO2(г) + С(графит) = 2СO(г); ∆ H > 0
Химиялық реакцияның тепе тең дігі солғ а ығ ысады егер:
A) температураны тө мендетсе
B) қ ысымды жоғ арылатса
C) қ ысымды тө мендетсе
D) катализатор ендірсе
E) температураны ө сірсе
F) СО концентрациясын тө мендетсе
128$$. Химиялық тепе тең дік белгілері:
A) тура реакция жылдамдығ ы кері реакция жылдамдығ ына тең
B) тепе тең дік кү йге екі жақ ты келуге болады
C) заттардың концентрациясы уақ ытпен ө згермейді
D) тура жә не кері реакция жылдамдығ ы нө лге тең
E) тепе тең дік кү йі тек бастапқ ы заттар жағ ынан келуге болады
F) тепе тең дік кү йге тек реакция ө німдері жағ ынан келуге болады
129$$. Раульдің екінші заң ына сә йкес:
A) ∆ tкип = Еm
B) ∆ tкрист = Кm
C) (po- p1)/po = N1
D) pосм. = C(x)RT
E) pосм. = iC(x)RT
F) ∆ tкрист = 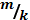
130$$. Идеал ерітінділерге жатады
A) ∆ H=0
B) ∆ V=0
C) ∆ V> 0
D) ∆ V< 0
E) ∆ S=0
F) ∆ H< 0
131$$. Ерітіндідегі сутегі иондарының концентрацисы
10-3моль\л ерітіндінің рН жә не рОН-ы:
А) рН=3
В) рОН=11
C) кө к
D) рН< 7
E) кү лгін
F) рОН=3
132$$. Мына заттарды қ осқ анда натри карбонатының гидролизі кү шейеді:
A) ZnCl2
B) CuCl2
C) K2S
D) NaOH
E) Na2S
F) KOH
133$$. Мына тұ здар қ ышқ ылдық орта кө рсетеді:
А) FeSО4
В) FeCl2
C) ВаCl2
D) NaCl
E) КCl
F) К2SО4
134$$. K2S; SiS2; Al2S2 сульфиттері кіреді жә не гидролизденеді:
A) SiS2 – қ ышқ ылдық қ айтымсыз гидролизденеді
B) K2S – негіздік қ айтымды гидролизденеді
C) Al2S3 – қ ышқ ылдық қ айтымды гидролизденеді
D) K2S – қ ышқ ылдық гидролизге ұ шырамайды
E) Al2S3 – амфотерлі гидролизге ұ шырамайды
F) барлыгы амфотерлі гидролизденеді
135. Сулы ерітінділерде анион бойынша гидролиз орны болады:
A) Na2SO3
B) CH3COONa
C) Na2SO4
D) Fe2(SO4)3
E) NH4NO3
F) AlCl3
136$$. О2®NH2OH ®N2H4 қ атарында:
A) тотық сыздандырғ ыштық қ абілеті артады
B) тотығ у дә режесі тө мендейді
C) тотық сыздандырғ ыш қ асиеті тө мендейді
D) ө згеріс жоқ
E) ө згермейді
F) тотығ у дә режесі артады
137$$. Н2S, Na2SO3, қ осылыстарында кү кірттің дә режесі тең:
А) -2
В) +4
С) +6
D) 0
Е) -6
F) -4
138$$. NH3, N2H4, NH2OH, HN3 азотты қ осылыс қ атарында:
А) азоттың тотық сыздандырғ ыштық қ асиеті тө мендейді
В) Қ ышқ ылдың қ асиеті артады
C) азоттың тотық тырғ ыштық қ асиеті тө мендейді
D) қ ышқ ылдық қ асиеті тө мендейді
E) тотығ у дә режесі тө мендейді
F) негіздік қ асиеті артады
139$$. Термиялық ыдырағ ан кезде диспропорциялануғ а ұ шырайды:
A) NH4NO3
B) (NH4)2 Cr2O7
C) NH4Cl
D) Na2SO4
E) NH4OH
F) NH4J
140$$. NH3 - NH4ОН - NаNO2- HNО3 қ осылыстары қ атарында:
А) азоттың тотық сыздандырғ ыш қ асиеті тө мендейді
В) қ ышқ ылдық қ асиеті артады
C) тотығ у дә режесі тө мендейді
D) азоттың тотық тырғ ыш қ асиеті тө мендейді
E) тотығ у дә режесі тө мендейді
F) негіздік қ асиеті артады
141$$. Кө міртегі мына қ осылыстарда ең жоғ арғ ы тотығ у дә режесін кө рсетеді:
А) СаСО3
В) СО2
C) CH3COOH
D) CH3CH2OH
E) CH3OH
F) CH3CH2COOH
142$$. Тотығ у- тотық сыздану реакциялары:
A) НNO2 ® HNO3 + NO
B) KI+Cl2 ® KCl + I2
C) HCl + KOH ®
D) NaCl + H2SO4 ®
E) N2O3(г)+ 2Н2О(г) ®
F) НСl + NaOH ®
143$$. K2SO3 + KMnO4 + H2SO4→ реакция ө німдері
А) H2O, MnSO4
В) K2SO4
С) MnSO4, K2S
D) MnO2, H2O
Е) K2S
F) MnO3
144$$. Сутегі мына заттармен ә рекеттесу реакциясында:
A) кү кіртпен тотық сыздандырғ ыш
B) фтороммен тотық тырғ ыш
C) азотпен тотық тырғ ыш
D) баримен тотық сыздандырғ ыш
E) натримен тотық сыздандырғ ыш
F) кальцимен тотық сыздандырғ ыш
145$$. Мына ә рекеттесулелдің реакция тең деулеріндегі барлық стехиометриялық коэффиценттердің қ осындысы:
A) натри мен тұ з қ ышқ ылы
B) натримен судың қ ышқ ылы
C) кальци мен судың қ ышқ ылы
D) магни мен қ айнағ ан судың
E) марганец пен су
F) барий мен су
146$$. Мырыш қ атысында мына реакция реакция ү шін Zn + KNO3 + KOH → .... дұ рысы:
A) K2ZnO2 тү зіледі
B) аммиак тү зіледі
C) Мырыштың координациялық саны -6
D) реакцияда гидроксокешен тү зіледі
E) мырыш кешені тү зіледі
F) Мырыштың координациялық саны -4
147$$. Калий перманганады тотық сызданады:
A) бейтарап ортада MnO2 – дейін
B) сілтілік ортада K2MnO4 – дейін
C) бейтарап ортада Mn2O3 – дейін
D) K2MnO3 – дейін бейтарап ортада
E) қ ышқ ыл ортада K2MnO4 – дейін
F) қ ышқ ыл ортада MnO2 – дейін
148$$. Калий перманганады тотық сызданады:
A) қ ышқ ыл ортада Mn+2 – дейін
B) сілтілік ортада K2MnO4 – дейін
C) бейтарап ортада Mn2O3 – дейін
D) бейтарап ортада K2MnO3 – дейін
E) қ ышқ ыл ортада K2MnO4 - дейін
F) қ ышқ ыл ортада MnO2 - дейін
149$$. Сулы ерітінділерінде тотық тырғ ыш қ асиеті кө лсетеді:
A) KMnO4
B) K2Cr2O7
C) K2S
D) K2SO4
E) NH3
F) Mn
150$$. Сулы ерітінділерде тотық сыздандырғ ыш қ асиеті кө рсетеді:
A) Na2SO3
B) Na2S
C) Na2CO3
D) Na2SO4
E) Na3PO4
F) O2
151$$. Сулы ерітінділерде тотық сыздандырғ ыш қ асиеті кө рсетеді:
A)K2Cr2O7
B)KMnO4
C)K3PO4
D)K2SO4
E)CrSO4
F)SnCl2
152$$. H2O2 + KMnO4 + H2SO4 реакция ө німдері
A) MnSO4 , K2SO4
B) O2, H2О
C) Mn(OH)2
D) MnO2
E) K2MnO4
F) KOH
153$$. Тотығ у – тотық сыздану реакциясының типімен оның тең деуі арасындағ ы сә йкестікті анық таң дар
| 2KClO3 = 2KCl + 3O2 | |
| 4KClO3 = KCl + 3KClO4 | |
| 2H2S + SO2 = 3S + 2H2O | |
| 3S + 6KOH = 2K2S + K2SO3 + 3H2O | |
| (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O | |
| 3P4 + 10KClO3 = 3P4O10 + 10KCl |
A) 1, 5 – молекула ішілік, 2, 4- диспропорциялық
B) 3, 6- молекулааралық
C) 1, 2-диспропорциялық, 3, 4- молекула ішілік,
D) 5, 6- молекулааралық
E) 2, 4- молекула ішілік, 1, 3- молекулааралық
F) 5, 6- диспропорциялық
154$$. NaOH ерітіндісін электролиздеген кезде, катодта (қ. ж. )2, 8 л. газ бө лінеді Анодта қ ай газ, қ андай кө лемде бө лінеді.
А) оттгі
В) 1, 4л
C) сутегі
D) су
E) 0, 05
F) 11, 2
155$$. SnCl2 ерітіндісін электролиздегенде анодта (қ. ж. )4, 48л хлор бө лінеді. Катодта бө лінген қ алайының зат мө лшері мен массасы нешеге тең
А) 23, 7г
B) 0, 2 моль
C) 0, 8 моль
D) 2, 37г
E) 0, 4 моль
F) 0, 6 моль
156$$. СиСl2 балқ ымасын электролиздегенде катод пен анодта тү зілген ө нім:
А) Cu
B) Cl2
C) H2O
D) Cu(OH)2
E) O2
F) H2
157$$. Металдың электрондық потенциалы анық тайды:
A) тотық тырғ ыштық қ абілеттілігін
В) тотық сыздандырғ ыштық қ абілеттігі
C) металдардың диссоциациялануғ а қ абілеттігін
D) диспропорциялануғ а қ абілеттігін
E) ассоциацияғ а қ абілеттігін
F) иондануғ а қ абілеттілігін
3 жауап
1$$$. КОН ерітіндісімен реакциясында, егер КН₂ РО₄; К₂ НРО₄; К₃ РО₄ тү зілсе, Н₃ РО₄ - тің эквиваленттік молярлық массасы тең:
A) 98
B) 49
C) 32, 7
D) 44
E) 87
F) 101
G) 12
H) 6
2$$$. Галогендер:
A) F
B) Cl
C) Br
D) Mn
E) Re
F) Tc
G) Xe
H) Ne
3$$$. Халькогендер;
Халькогены:
A) S
B) Se
C) O
D) F
E) Cl
F) Br
G) Mn
H) Re
4$$$. Пинктогендер:
A) N
B) P
C) As
D) F
E) Cl
F) Br
G) Mn
H) Re
5$$$. Амфотерлі элементтер:
A) Al
B) Zn
C) Be
D) C
E) Si
F) Hf
G) Ti
H) Re
6$$$. Ауыр металдар:
A) Хром
B) Марганец
C) Темір
D) Натрий
E) Кү міс
F) Калий
G) Магний
H) Алюминий
7$$$. Электронның қ ұ лауы мына атомдарда байқ алады:
A) Хром
B) Молибден
C) Мыс
D) Темір
E) Натрий
F) Кү кірт
G) Мышьяк
H) Мырыш
8$$$. Электронның қ ұ лауы мына атомдарда байқ алады:
A) кү міс
B) ниобий
C) алтын
D) бериллий
E) натрий
F) оттегі
G) мышьяк
H) мырыш
9$$$. 37Cl, Cl 36, Cl35 изoтоптардың атом ядролары:
A) 17p+18n
B) 17p+19n
C) 17p+20n
D) 17p+21n
E) 17p+22n
F) 17p+17n
G) 17p+17n
H) 18p+23n
10$$$. К+, Cl3+, F- иондарының электрондық формуласы:
A) 1S2 2S2 2p6 3S2 3p6 4S1
B) 1S2 2S2 2p6 3S2 3p5
C) 1S2 2S2 2p5
D) 1S2 2S2 2p6 3S2 1
E) 1S2 2S2 2p6 3S2 3p6 3d1
F) 1S2 2S2 2p6 3S2 3p6 3d2
G) 1S2 2S2 2p6 3S1
H) 1S2 2S2 2S2 2p6 3S2
11$$$. Мына элементтер атомдарының негізгі кү йінде 1 жә не 3 жұ птаспағ ан электрондар болады:
A) N
B) P
C) Li
D) Mn
E) O
F) S
G) C
H) Si
12$$$. n=1, n=2, n=4 дең гейлерінде электрондардың максималь саны:
A) 2
B) 8
C) 32
D) 16
E) 14
F) 18
G) 45
H) 91
13$$$. n=3, n=4, n=5 дең гейлерінде электрондардың максималь саны:
A) 18
B) 32
C) 50
D) 62
E) 16
F) 25
G) 14
H) 38
14$$$. 1S-, 2S -и 4S- орбитальдардан кейін толтырылады:
A) 2s
B) 2p
C) 3d
D) 5p
E) 3s
F) 4p
G) 6p
15$$$. Мына элементтер қ атарында электртерістілік тө мендейді:
A) Cl- S –P- Si -Al
B) Br- Se- As- Ge- Ga
C) O -N –C- Si- Ca
D) Be- B-C -H -Al
E) Na –Al- C –H- Cl
F) B -Si –As- C- H
G) Te -P –Se- Y- Br
H) N –Cl- O- F
16$$$. Мына қ атарларда атом радиустары артады:
A) F –Cl- Br
B) Li –Na- K
C) N –P- Bi
D) Mg -Ba -H
E) Zn -Li -O
F) Al -B -Si
G) K-S -Cl
H) Cu -S -Cl
17$$$. Ауыспалы элементтер:
A) Sc
B) Ti
C) V
D) K
E) Rb
F) Cs
G) Li
H)Na
18$$$. Периодтық заң ды қ ай ғ асырда, қ ай жылы жә не кім ашты:
A) 1869
B) Д. И. Менделеев
C) XVIII ғ асыр
D) И. А. Каблуков
E) 1861
F) XX ғ асыр
G) 1870
H) А. М. Бутлеров
19$$$. Сілтілік металдар:
A) IА тобы
B) Li, Na,
C) K, Rb, Cs
D) II В тобы
E) III А тобы
F) Магний, кальций
G) Стронций, барий
H) ІІІ В тобы
20$$$. Фосфор атомында:
A) 15протондар
B) 16 нейтрондар
C) 15 электрондар
D) 15нейтрондар
E) 16 протондар
F) 31нейтрондар
G) 16 электрондар
H) 31 электрондар
21$$$. Ауыспалы элементтерге сә йкес келеді:
A) d – элементтер
B) ІВ тобы
C) ІІІВ тобы
D) s - элементтер
E) ІІА тобы
F) p - элементтер
G) VIIA тобы
H) f - элементтер
22$$$. Жоғ арғ ы электртерістілік мына элементтерде:
A) F
B) СІ
C) І
D) Li
E) H
F) С
G) О
H) К
23$$$. Бас квант саны анық тайды:
A) Электрондық қ абатта электрондардың максимал санын
B) Электрондық орбиталдің мө лшерін
C) Атомдағ ы электронның энергиясын
D) Электрондық орбиталдің пішінін
E) беттік тегіс тү йіндерінің саны
F) электронның орбиталь моментінің мө лшерін
G) электрондық орбитальдарда электрондардың максимал саны
24$$$. 3d, 4f, 7s электрондарғ а сә йкес келетін қ осымша l квант сандарының мә ні:
A) 2
B) 3
C) 0
D) 5
E) 4
F) 6
G) 7
25$$$. 6р, 5d, 4s электрондарғ а сә йкес келетін қ осымша l квант сандарының мә ні:
A) 1
B) 2
C) 0
D) 4
E) 6
F) 5
G) 7
26$$$. Атомның негізгі кү йінде электрондарының энергетикалық дең гейлерде, дең гейшелерде жә не орбиталдарда орналасуы анық талады:
A) Паули принципімен
B) Хунд ережесімен
C) Клечковский ережесімен
D) Шредингер тең деуімен
E) Бор постулаттарымен
F) Вант – Гофф ережесімен
G) Аррениус тең деуімен
27$$$. 2s, 3p, 3d энергетикалық дең гейшелерде максимал электрон сандары:
A) 2
B) 6
C) 10
D) 12
E) 14
F) 32
G) 66
H) 55
28$$$. 3p, 3d, 5f энергетикалық дең гейшелерде максимал электрон сандары:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|