
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
«Бейорганикалық химия» пәнінен 2 страница
A) Бір атомның электрон жұ птарын басқ а атомның бас орбитасына беруі
B) Ә ртү рлі атомдардың электрондық орбитальдарының бү ркесуі
C) бір жә не сол атомның электрон бұ лттарының бү ркесуі
D) Атомдардан біреуінен электрон бұ лттарының толық жә не жартылай ығ ысуы
E) Бір атомның электрондарын басқ а атомның бос орбитальдарына беруі
76$. Na3[AlF6] молекуласында донорлы-акцепторлы байланыстар саны:
A) 3
B) 2
C) 5
D) 4
E) 6
77$. H5IO6 молекуласындағ ы гибридтену типі:
A) sp3d2-гибридтену
B) sd3-гибридтену
C) sp3d2f-гибридтену
D) sp2d-гибридтену
E) sp3d-гибридтену
F) sp2d2-гибридтену
78$. (ВС) байланыс ә дісіне сә йкес химиялық элементтің қ алыпты (қ озбағ ан кү йінде) валенттігі тең:
A) сыртқ ы қ абаттағ ы электрондар санына
B) топ нө міріне
C) жұ птаспағ ан электрондар санына
D) бос электрондық орбитальдар санына
E) период нө міріне
79$. ZnO-ін KOH-мен балқ ытқ анда тү зілген тұ здың массасы мынағ ан тең:
А)175
B)202
C)88
D)64
E)138
80$. 2HgО®2Hg+O2
Келтірілген реакцияның типін кө рсетің із
А)айырылу
B)қ опарылу
C)қ осылу
D)орынбасу
E)алмасу
81$. Zn + 2HCl = ZnCl2 + H2 келтірілген реакцияның типін кө рсетің із
А)орынбасу
B)қ осылу
C) ыдырау
D)алмасу
E)тізбекті
82$. Келтірілген реакцияның типін кө рсетің із 2Zn+O2®2ZnO
А)қ осылу
B)айырылу
C)алмасу
D)орынбасу
E)тізбекті
83$. Негіздік оксидтер қ атарын кө рсетің із:
А)CaO, MgO, Na2O
B)SiO2, CO2, P2O5
C)ZnO, Al2O3, BeO
D)Fe2O3, MnO2, N2O5
E)Cr2O3, CO2, ZnO
84$. Қ ышқ ылдық оксидтер қ атарын кө рсет
А)SiO2, Mn2O7, CrO3
B)Na2SO4, CuO, HCl
C)K2O, MgSO4, Cr2O3
D)Al2O3 , Na2O, NaCl
E)ZnO, BeO, Fe2O3
85$. Қ ышқ ыл тұ зды кө рсет:
А)Na HSO3
B)Na2SO4
C)CuCl2
D)AlOHSO4
E)Fe(OH)3
86$. Негіз тұ зды кө рсет:
А)(MgOH)2 SO4
B)K2HPO4
C)CuO
D)Fe2O3
E)H2S
87$. Суда еритін негізді кө рсет:
А)Са(OH)2
B)Al(OH)3
C)Zn(OH)2
D)Cr(OH)3
E)Be(OH)2
88$. Суда еритін оксидті кө рсет:
А)Na2O
B)ZnO
C)BeO
D)MnO2
E)Cr2O3
89$. 68, 4% хром жә не 31, 6% оттегі қ ұ рамды хром оксидін кө рсет:
А)Cr2O3
B)CrO3
C)CrO
D)Cr2O4
E)Cr2O7
90$. 20г қ ышқ ыл тұ з алу ү шін NaOH ерітіндісі арқ ылы ө ткізуге қ ажетті SO2 -нің кө лемі:
A) 4, 3л
B) 2, 24л
C) 11, 2л
D) 4, 48л
E) 67, 2л
91$. 25г орта тұ з алу ү шін, NaOH ерітіндісі арқ ылы ө ткізуге қ ажетті SO2 –нің кө лемі:
A) 4, 44
B) 2, 38
C) 67, 2
D) 34, 8
E) 10, 1
92$. Тө менде келтілрілген қ осылыстардың ішінде ең кү шті негіз:
A) Ba(OH)2
B) Be(OH)2
C) Mg(OH)2
D) Ca(OH)2
93$. Тө менде келтірілген қ осылыстардың ішінде ең ә лсіз қ ышқ ыл:
A) H2TeO3
B) H2SO3
C) H2SeO3
D) H2SO4
E) HNO3
94$. Ең берік сутектік қ осылыстың химиялық формуласы:
A) NH3
B) AsH3
C) SbH3
D) PH3
E) HNO3
95$. 1- Mg(OH)2,
2- Al(OH)3, 3- KOH, 4- Ca(OH)2 қ атарында негіз кү шінің арту реттілігін анық таң дар:
A) 2143
B) 3214
C) 2134
D) 4123
E) 1234
96$. Марганец оксидтерінің негіздік қ асиетінің арту реттілігін анық таң дар
1- MnO2, 2- Mn2O7, 3- MnO, 4- MnO3:
A) 2413
B) 3214
C) 2134
D) 4123
E) 1234
97$. 1- HClO, 2- HBrO, 3- HIO, 4- HClO2 қ ышқ ылдық кү шінің арту реттілігін анық таң дар:
A) 3214
B) 2413
C) 2134
D) 4123
E) 1234
98$. Бір лиганд алатын координациялық орын саны былай аталады:
A)дентанттылық
B)валенттілік
C)координациялық сан
D)координациялық сфера
E) изомерия
99$. Кешеннің геометриялық формасы-сызық тық, гибридтену тү рі:
A)sp
B)sp3d2
C)sp2d
D)sp3
E)sp2
100$. Кешеннің геометриялық формасы-октоэдр, гибридтену тү рі:
A)sp3d2
B)sp2d
C)sp3
D)sp
E)sp2
101$. Кешеннің геометриялық формасы-жазық квадрат, гибридтену тү рі:
A)sp2d
B)sp3d2
C)sp3
D)sp
E)sp2
102$. Кешеннің геометриялық формасы-тетраэдр, гибридтену тү рі:
A)sp3
B)sp
C)sp3d2
D)sp2d
E)s2
103$. Этилендиаминнің дентанттылығ ы ( NH2CH2CH2NH2) координациясының сиымдылығ ы:
A)2
B)1
C)3
D)4
E)5
F)6
104$. H[AuCl4] кешенді қ осылысының типі:
А) қ ышқ ыл
B) тұ з
C) бейэлектролит
D) негіз
E) аммиакат
105$. Na3[AlF6] кешенді қ осылысының типі:
А) тұ з
B) қ ышқ ыл
C) бейэлектролит
D) негіз
E) аммиакат
106$. [Ni(CO)4] кешенді қ осылысының типі:
А) бейэлектролит
B) қ ышқ ыл
C) аммиакат
D) негіз
E) тұ з
107$. [Ag(NH3)2]OH кешенді қ осылыстың типі:
А) негіз
B) қ ышқ ыл
C) бейэлектролит
D) тұ з
E) аммиакат
108$. [Co(NH3)4Cl2]ClO4 қ осылысында кешен тү зушінің заряды:
A)+3
B)+6
C)+2
D)-3
E)-6
109$. [Cu(NH3)4]2+ кешенді ионында металлдың орталық ионының тотығ у дә режесі мен координациялық санын кө рсет:
А) к. ч. = 4, ст. о. =+2
В) к. ч. = 2, ст. о. =+2
С) к. ч. = 6, ст. о. =+4
D) к. ч. = 4, ст. о. =+6
Е) к. ч. = 2, ст. о. =+4
110$. [Cо(NО2)6]3- кешенді ионында металлдың орталық ионының тотығ у дә режесі мен координациялық санын кө рсет::
А) к. ч. = 6, ст. о. =+3
В) к. ч. = 2, ст. о. =+2
С) к. ч. = 6, ст. о. =+4
D) к. ч. = 4, ст. о. =+6
Е) к. ч. = 2, ст. о. =+4
111$. [FeCl4]- кешенді ионында металлдың орталық ионының тотығ у дә режесі мен координациялық санын кө рсет::
А) к. ч. = 4 ст. о. =+3
В) к. ч. = 2, ст. о. =+2
С) к. ч. = 6, ст. о. =+4
D) к. ч. = 4, ст. о. =+6
Е) к. ч. = 2, ст. о. =+4
112$. [Cо(NН3)4Cl2]+ кешенді ионында металлдың орталық ионының тотығ у дә режесі мен координациялық санын кө рсет :
А) к. ч. = 6 ст. о. =+3
В) к. ч. = 2, ст. о. =+2
С) к. ч. = 6, ст. о. =+4
D) к. ч. = 4, ст. о. =+6
Е) к. ч. = 2, ст. о. =+4
113$. [Cu(NН3)4]SO4 қ осылысында кешенді ионның зарядын, тотығ у дә режесі жә не кешен тү зушінің координациялық санын анық таң дар:
А) +2, +2, 4
В) +4, +2, 4
С) +2, +4, 6
D) -2, +2, 4
Е) -2, -2, 6
114$. К[Ag(СN)2] қ осылысында кешенді ионның зарядын, тотығ у дә режесі жә не кешен тү зушінің координациялық санын анық таң дар:
А) -1, +1, 2
В) +1, +2, 4
С) -1, -1, 2
D) -2, +2, 4
Е) -2, -2, 6
115$. Стандартты жағ дайларда жай заттың жылу тү зуі (DН0) нешеге тең (кДж)?
A) 0
B) 12
C) -3
D) 1
E) -21
116$. Экзотермиялық реакцияны кө рсет:
A) ∆ Н< 0
B) DG< 0
C) ∆ S< 0
D) ∆ S> 0
E) ∆ Н> 0
117$. Эндотермиялық реакцияны кө рсет:
A) ∆ Н> 0
B) DG< 0
C) ∆ S< 0
D) ∆ S> 0
E) ∆ Н< 0
118$. Мына зат ү шін тү зілу энтальпиясы нө льге тең:
A) оттегі
B) ацетилен
C) калий гидроксиді
D) алюминий оксиді
E) азот қ ышқ ылы
119$. Стандартты жағ дайда ө здігінен жү ре алатын реакция:
A) 2NO(г)+О2 (г)=2NO2 (г); DH0< 0
B) N2 (г)+O2=2NO(г); DH0> 0
C) 2N2 (г)+O2=2N2O(г); DH0 = 0
D) 2NO(г)+О2 (г)=2NO2 (г); DS0 < 0
E) N2 (г)+O2=2NO(г); DS0=0
120$. Мына заттың тү зілу жылуы нө льге тең:
A) оттегі
B) ацетилен
C) калий гидроксиді
D) алюминий оксиді
E) азот қ шқ ылы
121$. Стандартты жағ дайда ө здігінен жү ре алатын реакция:
A) 2NO(г)+О2 (г)=2NO2 (г); DH0< 0
B) N2 (г)+O2=2NO(г); DH0> 0
C) 2N2 (г)+O2=2N2O(г); DH0 = 0
D) 2NO(г)+О2 (г)=2NO2 (г); DS0 < 0
E) N2 (г)+O2=2NO(г); DS0=0
122$. Реакцияның жылуының эффектісі-бұ л:
A) реакцияда сің ірілген немесе бө лінген жылу мө лшері;
B) тотығ у реакциясында бө лінген жылу мө лшері;
C) тотығ у реакциясында сің ірілген жылу мө лшері;
D) тотық сыздану рекциясында бө лінген жылу мө лшері;
E) кешен тү зу реакциясында бө лінген жылу мө лшері.
123$. Экзотермиялық реакциялар кезінде:
A) жү йенің энтальпиясы тө мендейді;
B) жү йенің энтальпиясы артады;
C) жү йенің энтропиясы тө мендейді;
D) жү йе энтропиясы артады;
E) Гиббс энергиясы ө згермейді.
124$. Эндотермиялық реакциялар кезінде:
A) жү йенің энтальпиясы артады;
B) жү йенің энтропиясы артады;
C) Гиббс энергиясы ө згермейді;
D) Жү йенің энтропиясы тө мендейді;
E) Жү йенің энтальпиясы тө мендейді.
125$. Энтальпия кө рсетеді:
A) реакцияның жылу эффектісін;
B) жү йенің ретсіздік ө лшемін;
C) молекуланың иондарғ а ыдырауын;
D) реакция ө німдерінің шығ ымын;
E) молекуланың полярлығ ын.
126$. Термохимиялық тең деу болып табылады:
A) жылу эффектісі кө рсетілген тең деу;
B) ө здігінен тотығ у-тотық сыздану тең деуі;
C) жылу бө лінуімен жү ретін тең деу;
D) жылу сің ірумен жү ретін тең деу;
E)энтропиясы кө рсетілген тең деу.
127$. 2NH3 (г) = N2 (г)+3H2(г) ү рдісінде энтропияның ө згеруі мына мә нге ие:
A) DS0> 0
B) DS0< 0
C) DS0=0
D) DН0> 0
E) DН0< 0
128$. CO2(к) = CO2(г) ү рдісінде энтропияның ө згеруі мына мә нге ие:
A) DS0> 0
B) DS0< 0
C) DS0=0
D) DН0> 0
E) DН0=0
129$. Стандартты жағ дайда ө здігінен жү ре алатын реакция:
A) DH< 0; DS> 0
B) DH< 0; DS< 0
C) DH> 0: DS< O
D) DH=0: DS=O
E) DG=0: DS=O
130$. Ретсіздікке ұ мтылуды сипаттайды:
A) энтропия;
B) энтальпия;
C) энергия Гиббса;
D) конденсация;
E) топ бойынша шығ ымы.
131$. Кристаллизация жә не конденсация ү рдістері мынағ ан алып келеді:
A) энтропияның тө мендеуіне;
B) энтропияның артуына;
C) жү йедегі тепе-тең дікке;
D) энтальпияның тө мендеуіне;
E) энтальпияның ө суіне.
132$. Гиббс энргиясы мынаның критериі болып табылады:
A) ү рдістің ө здігінен жү ру мү мкіндігіне;
B) тотығ у ү рдісіне электрон беру мү мкіндігіне;
C) тотық сыздану ү рдісінде электронды қ абылдау мү мкіндігіне;
D) Бейтараптану реакциясында энергияның бө лінуіне;
E) ыдырау реакциясында энергия сің ірілуіне.
133$. Реакцияның ∆ H, ∆ S, ∆ G мә ндері мынағ ан тә уелді:
A) ә рекеттесуші заттар табиғ атынан;
B) катализатор қ атысуымен;
C) диссоциация қ абілеттілігімен;
D) белсендіру энергияның мә нінен;
E) иондану энергиясының мә нінен.
134$. Функцияның -∆ H, +∆ S, -∆ G белгілерінің ө згерісі ү рдістің....... екенін кө рсетеді:
A) кез келген температурада мү мкін;
B) кез келген температурада мү мкін емес;
C) жоғ ары температурада мү мкін;
D) жоғ ары температурада мү мкін емес;
E) жү йеде тепе-тең дік орнағ ан.
135$. Ашық жү йенің ерекшелігі:
A) қ оршвғ вн ортамен масса жә не энергия алмасуы мү мкін
B) сыртқ ы ортамен масса жә не энергия алмасуы болмайды
C) сыртқ ы ортағ а тек жылу беру мү мкін
D) сыртқ ы ортамен тек масса алмасуы мү мкін
E) дене немесе бірнеше денелер ө зара ә рекеттесуі мү мкін
136$. Жабық жү йеге тә н ерекшеліктер:
A) қ оршағ ан ортамен зат алмасу болмай, тек энергия алмасуы мү мкін
B) қ оршағ ан ортамен масса жә не энергия алмасуы мү мкін
C) қ оршағ ан ортамен не массаның, не энергия алмасуы мү мкін емес
D) қ оршағ ан ортамен масса алмасуы мү мкін
E) дене немесе бірнеше дене ө зара ә рекеттесуі мү мкін
137$. Оқ шауланғ ан жү йенің ерекшеліктері:
A) Қ оршағ ан ортамен немесе, не энергия алмасуы мү мкін емес
B) қ оршағ ан ортамен зат жә не энергия алмасуы мү мкін емес
C) сыртқ ы ортағ а тек жылу беруі мү мкін
D) сыртқ ы ортамен тек масса алмасуы мү мкін
E) дене немесе бірнеше денелер ө зара ә рекеттесуі мү мкін
138$. Мұ зы бар термос-бұ л термодинамикалық жү йе:
A) оқ шауланғ ан
B) тепе-тең дікті
C) жабық
D) ашық
E) механикалық
139$. Ыдыстың суы бар жылытқ ыш (грелка)-бұ л термодинамикалық жү йе:
A) жабық
B) оқ шауланғ ан
C) тепе-тең дікті
D) ашық
E) қ айтымсыз
140$. Химиялық реакция жү ріп жатқ ан пробирка-бұ л термодинамикалық жү йе:
A) ашық
B) оқ шауланғ ан
C) жабық
D) тепе-тең дікті
E) қ айтымды
141$. Аргонды пісірілген ампула-бұ л термодинамикалық жү йе:
A) оқ шауланғ ан
B) тепе-тең дікті
C) жабық
D) ашық
E) механикалық
142$. Гесс заң ынан шығ атын дұ рыс емес формуланы кө рсет:
A) 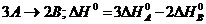
B) 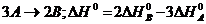
C) 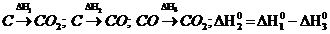
D)  E)
E) 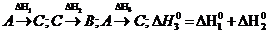
143$. Гесс заң ынан шығ атын дұ рыс емес формуланы кө рсет:
A) 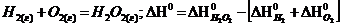 B)
B) 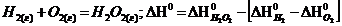 C)
C) 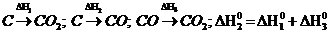
D) 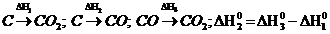
E) 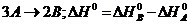
144$. Реакциядағ ы стандартты энтропияның дұ рыс емес мә ні: (1отв)
A) Cl2(г) + 5F2(г) = 2ClF5(г); ∆ S0 > 0
B) C(т) + СО2(г) = 2СО(г); ∆ S0 < 0
C) HgBr2(т) = Hg(ж) + Br2(ж); ∆ S0 > 0
D) 2О3(г) = 3О2(г); ∆ S0 > 0
E) SO2(т) + 2H2S(г) = 2S(т) + 2H2O (ж); ∆ S0 < 0
145$. аА + bВ = cC + dD + …. Реакциясының тү рі ү шін:
A) 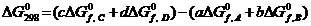
B) 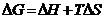
C) 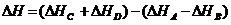
D) 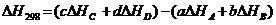
E) 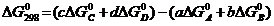
146$. N2(г) + 3H2(г) = 2NH3(г) реакциясының тү рі ү шін:
A) 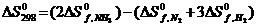
B) 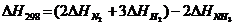
C) 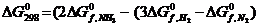
D) 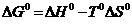
E) 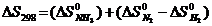
147$. ∆ S > 0 реакция ү шін:
A) C(графит) + СО2(г) = 2СО(г)
В) 3H2(г) + N2(г) = 2NH3(г)
С) CO(г) + Cl2(г) = COCl2(г)
D) ВаО(к) + СО2(г) = ВаСО3(к)
E) 2NО(г) + О2(г) = 2NО2(г)
148$. Гельмгольц энергиясы мынағ ан тең :
A) U – TS
B) U + pV
C) H + TS
D) H – TS
E) U + TS
149$. Жану энтальпиясы (Δ Н298) С2H5OH(ж) -реакция энтальпиясына тең:
A)С2H5OH(ж) + 3О2(г) = 2CO2(г) + 3H2O(ж)
B)С2H5OH(ж) + 3О2(г) = 2CO2(г) + 3H2O(г)
C)С2H5OH(ж) + О2(г) = 2C(гр) + 3H2O(ж)
D)С2H5OH(ж) + О2(г) = 2C(гр) + 3H2O(г)
E) С2H5OH(ж) + 2О2(г) = СO(г) + 3H2O(ж)
150$. CuSO4*5H2O(кр) тү зілу энтальпиясы-реакция энтальпиясына тең:
A) Cu(кр) + S(кр) + 4, 5O2(г) + 5H2(г) =
= CuSO4*5H2O(кр)
B) Cu(OH)2(кр) + H2SO4(ж) + 3H2O(ж) =
= CuSO4*5H2O(кр)
C) CuSO4(кр) + 5H2O(ж) = CuSO4*5H2O(кр)
D) CuO(кр) + H2SO4(ж) + 4H2O(ж) = CuSO4*5H2O(кр)
E) Cu(кр) + S(г) + 9O(г) + 10H(г) = CuSO4*5H2O(кр)
151$. Осы реакцияны жылу эффектісі (Δ Н) жә не барлық заттардың термодинамикалық кү йінің (температура, агрегаттық кү йі, қ ұ рамы жә не ерітінділер концентрациясы) мә ндері қ осымша кө рсетілетін реакция тең деуі былай аталады:
A) термохимиялық
B) термодинамикалық
C) химиялық
D) химиялық жылу
E) топодинамикалық
152$. Энтропия ү шін Больцман тең деуі:
A) S = k lnW
B) Δ S= S2 – S1
C) S = (H - G)/T
D) Δ S =Δ H/T
E) Δ S=(Δ H-Δ G)/T
153$. Бірдей сыртқ ы жағ дайларда максимальды энтропияғ а ие:
A) H2O(г. )
B) С(графит)
C) H2O(тв. )
D) H2O(жидк. )
E) C(алмаз)
154$. Сыртқ ы жағ дайлары бірдей болатын 1- NO, 2- N2O3, 3- N2O4, 4- N2O, 5- N2O5, 6- NO2 газ тә різді заттардың энтропиясының тө мендеу реттілігін анық таң дар:
A) 53241
B) 24531
C) 45312
D) 12345
E) 35421
155$. Сыртқ ы жағ дайлары бірдей болатын 1-сынап, 2-графит, 3-алмас, 4-қ орғ асын, 5-вольфрамның энтропияның арту реттілігін анық таң дар:
A) 32541
B) 24531
C) 45312
D) 12345
E) 35421
156$. Химиялық тепе-тең дік кү йдегі Гиббс энергиясының ө згерісі:
A) G=0
B) G> > 0
C) G < < 0
D) G > 0
E) G < 0
157$. Химиялық тепе-тең дік константасы, стандартты Гиббс энергиясы ө згерісінен байланыста қ атынасы ( K ) 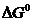 =... :
=... :
A) -RT lnK
B) R lnK
C) -R lgK
D) RT lgK
E) -RT lgK
158$. Берілген реакцияның белсендіру энергиясы-бұ л:
A) молекуланы белсендіруге қ ажетті энергия;
B) протонды белсендіруге қ ажетті энергия;
C) энтропияның белсендіруге қ ажетті энергия;
D) энтальпияның белсендіруге қ ажетті энергия;
E) электронды белсендіруге қ ажетті энергия
159$. Тура химиялық реакцияның жылдамдығ ы N2 + 3H2 = 2NH3:
A) k1*[N2]*[H2]3
B) k1/k2
C) [N2] + [H2]3
D) k1*[N2]*3[H2]
E) [N2]*3[H2]
160$. Кері химиялық реацияның жылдамдығ ы тең 2NO2 = 2NO + O2:
A) k2*[NO]2*[O2]
B) k2*[NO]*[O2]
C) [NO2]2
D) k2*[NO]*[O2]2
E) k1*[NO2]2
161$. Химиялық реакцияның молекулярлығ ы
2NО(г) + H2(г) = N2O(г) +H2O(г):
A) 3
B) 2
C) 1
D) 5
E) 4
162$. Химиялық тепе-тең дік кү йі қ ашан басталады:
A) тура жә не кері реакция жылдамдығ ы тең болғ анда;
B) тура реакция жылдамдығ ы кері реакция жылдамдығ ына тең болмағ анда;
C) тура реакцияның жылдамдығ ы керіден жоғ ары болғ анда;
D) тепе-тең дік тұ рақ тысы бірден артық болғ анда;
E) тепе-тең дік тұ рақ тысы бірден тө мен болғ анда;
163$. Химиялық тепе-тең діктің ығ ысуы мына принциппен анық талады:
A) Ле -Шателье
B) Паули
C) Гейзенберг
D) Вернер
E) Вант–Гофф
164$. H2 (г) + J2 (г) = 2HJ(г) жү йесінде қ ысымды кө теру тепе-тең дікті ығ ыстырады:
A) қ ысым ә сер етпейді
B) солғ а ығ ыстырады
C) оң ғ а ығ ыстырады
D) HJ тү зілу жағ ына
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|