
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
«Бейорганикалық химия» пәнінен 1 страница
«Бейорганикалық химия» пә нінен
5В072000 мамандығ ының студенттеріне арналғ ан ВОУД сұ рақ тары
1 жауап
1$. Газдың сутегі бойынша тығ ыздығ ы 16-ғ а тең болса, ол газдың молекулалық массасы қ анша:
А)32
B)36
C)16
D)9
E)4
2$. Ауа сутегінен неше есе ауыр:
А)14, 5
B)9, 6
C)29
D)7, 2
E)2
3$. Авогадро саны:
А)6, 02 × 1023
B)6, 02 × 10-23
C)6, 02× 1022
D)6, 02 × 1020
E)6, 02 × 1019
4$. Атомның салмақ тық бірлігі:
А) 12С изотопы массасының 1/12 бө лігі
B) 12С изотопы массасының 0, 12 бө лігі
C) 16О изотопы массасының 2, 53 бө лігі
D) 39К изотопы массасының 1, 24 бө лігі
E) 2Н изотопы массасының 1, 56 бө лігі
5$. Қ алыпты жағ дайдағ ы бір моль газдың кө лемі:
А)22, 4
B)44, 3
C)56, 6
D)11, 2
E)20, 5
6$. Қ алыпты жағ дайда температура мен қ ысым:
А)273 и 101, 3
B)298 и 113, 1
C)100 и 760
D)588 и 100
E)300 и 916, 5
7$. Гей-Люссак пен Бойль-Мариоттың біріккен заң дары:
А) 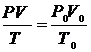
B) 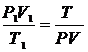
C) 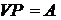
D) 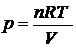
E) 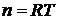
8$. 22, 4 л газ кө лемі сипатталады:
А)2730К ж 101, 3 Кпа –де 1 моль газдың кө лемі;
B)2730К ж 101, 3 Кпа –де газдың молярлық массасы;
C)2730К ж 101, 3 Кпа –де 1 моль сутегінің кө лемі;
D) 2730К ж 101, 3 Кпа –де 1 моль азоттың кө лемі
E) 2730К ж 101, 3 Кпа –де газдың молярлық массасы;
9. $ Х – затының эквивалентінің молярлық массасы-бұ л:
А) Х- затының бір эквивалентінің массасы
B)Х -затының (қ. ж. ) 5 литрінің массасы
C) Х- затының 1 молінің массасы
D)Х- затының 2 молінің массасы
E)Х- затының екі эквивалентінің массасы
10. $ Эквиваленттер заң ының математикалық ө рнегі:
А) 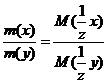
B)m(x)=M 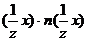
C)V( 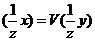 /V(xy)
/V(xy)
D)V( 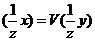 +V(xy)
+V(xy)
E)#
11$. (Қ. ж. ) 2 моль N2 қ ұ рамында молекула саны:
А)12, 04× 1023
B)6, 02× 1024
C)6, 02× 1023
D)3, 01× 1025
E)4, 48× 1022
12$. (Қ. ж. ) 32г О2 қ ұ рамында молекула саны:
А)6, 02× 1023
B)3, 01× 1024
C) 3, 01× 1023
DГ)6, 04× 1024
E)6, 12× 1023
13$. 112г газдың зат мө льшері(моль):
А)30, 1× 1023
B)3, 01× 1024
C) 3, 01× 1023
DГ)6, 04× 1024
E)6, 12× 1023
14$. 112 л газдың зат мө лшері (моль):
А)5
B)9
C)15, 5
D)2, 4
E)44, 8
15$. 6, 02× 1023 молекула газдың (қ. ж. )кө лемі:
А) 22, 4
B) 2, 24
C) 4, 48
D) 67, 2
E) 53, 2
16$. Сутегі эквивалентінің молярлық кө лемі:
А) 11, 2
B) 22, 4
C)2, 24
D) 1, 12
E) 67, 2
17$. Оттегі эквивалентінің молярлық кө лемі:
А) 5, 6
B) 22, 4
C) 2, 24
D) 11, 2
E) 67, 2
18$. Н2SO4 эквивалентінің молярлық массасы:
А) 49
B) 98
C) 64
D) 12
E) 56
19$. КОН эквивалентінің молярлық массасы:
А) 56
B) 11, 2
C) 44, 8
D) 22, 4
E) 24
20$. Н3РО4: эквиваленттік фактоp
А) 1/3
B) 1
C)4
D)2/3
E)2
21$. Al2(SO4)3-тің эквиваленттік факторы:
А)1/6
B) 0, 6
C) 1/3
D)0. 5
E)6. 3
22$. Эквиваленттік фактор-бұ л қ ышқ ылдық -негіздік (алмасу) реакциясында заттың бө лшегінің эквиваленттік ү лесінде бір сутегі катионын анық тайтын сан:
A) электрон
B) протон
C) нейтрон
D) позитрон
E) анион
23$. 4NH3 + 5O2 = 4NO + 6H2O химиялық реакциясында заттың химиялық формуласы мен эквиваленттік фактор арасындағ ы сә йкестікті анық таң дар
A) 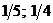
B) 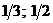
C) 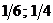
D) 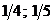
E) 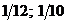
24$. 2H2S + 3O2 = 2SO2 + 2H2O химиялық реакциясында (қ. ж) 1 моль кү кіртсутектің эквивалентінің кө лемі:
A)11, 2 л
B)22, 4 л
C)7, 47 л
D)5, 6 л
E)4, 48 л
F)3, 73 л
G)2, 8 л
25$. Хлор атомының 3р орбиталіндегі электрондар саны:
А)5
B)3
C)2
D)6
E)7
26$. Теріс зарядты атомның қ ұ рам бө лігі:
А)электрон
B)протон
C)позитрон
D)нейтрон
E) нуклон
27$. 4-периодта s-, p-, d- f- элементтер саны:
А) 2, 6, 10, 0
B) 4, 1, 14, 4
C) 1, 4, 14, 5
D) 2, 4, 6 8
E) 1, 3, 5, 10
28$. Атомдағ ы электронның кү йін сипаттайды:
А) 4 квант сандар жиынтығ ымен;
B) тотығ у процесінің кө мегімен;
C) Больцман тұ рақ тысының мә німен;
D) Клечковский жә не Паули ережесімен;
E) Термодинамикалық функциялар жиынтығ ымен.
29$. Электрон табиғ аты:
А) Бө лшектік жә не толқ ындық қ асиеттері;
B) тотық тырғ ыштық қ асиеттері;
C) тотық сыздындырғ ыштық қ асиеттері;
D) диэлектрлік ө ткізгіштігі;
E) парамагнитті қ асиеттері.
30$. Кү кірт атомындағ ы протондар мен нейтрондардың қ осындысы:
A) 32
B) 15
C) 6
D) 8
E) 44
31$. Бір кванттық ұ яшық тағ ы электрондар санын анық тайтын принцип:
A) Паули
B) Гунда
C) Клечковского
D) Менделеева
E) Оствальда
32$. Атомдық орбитальдардың ә ртү рлі дең гейшелерде электрондармен толтыру ретін анық тайтын ереже:
A) Клечковского
B) Ле-Шателье
C) Вант-Гоффа
D) Паули
E) Гунда
33$. Бір дең гейше шегінде атомдық орбитальдар электрондардың орналасуын анық айтын ереже:
A) Гунд
B) Вант-Гофф
C) Аррениус
D) Ле-Шателье
E) Паули
34$. 4s - дең гейшеден кейін толтырылатын дең гейше:
A) 3d
B) 2d
C) 2p
D) 4p
E) 4d
35$. 6s – дең гейшеден кейін толтырылатын дең гейше:
A) 4f
B) 5d
C) 6p
D) 5f
E) 3d
36$. 1s2 2 s2 2p6 3 s2 3p6 3d54s1 электрондық формуласы мына элемент атомына сә йкес келеді:
A) хром
B) азот
C) кө міртек
D) кү кірт
E) оттегі
37$. Орбиталді квант саны сипаттайды:
A) атомдық орбиталь пішінін (формасын);
B) электронның ө з осі бойынша айналуын;
C) Атомның электрондар беруін;
D) Атомның электрондар қ осып алуын;
E) Дең гейдегі электрон энергиясын;
38$. Спин квант саны сипаттайды:
A) Электронның ө з осі бойын айналуын;
B) атомның орбиталь пішінін;
C) дең гейшедегі электрон энергиясын;
D) атомның электрондар беру қ абілетін.
E) дең гейдегі электрон энергиясын;
39$. Бас квант саны сипаттайды:
A) дең гейдегі электрон санын;
B) Атомдық орбитальдің бағ ытын;
C) электронның ө з осінен айналуын;
D) Атомдық орбиталь пішінін;
E) Атомның электрон беру қ абілетін.
40$. Орбиталь квант саны мына мә ндерді қ абылдайды:
A) 0 … (n-1)
B) 0, … ¥
C) +1/2, -1/2
D) -l, 0, + l
E) 0, ½, 1
41$. Бас квант саны мына мә ндерді қ абылдайды:
A) 1, 2. … ¥
B) 0 … (n-1)
C) +1/2, -1/2
D) -l, 0, + l
E) 0, ½, 1
42$. Магнит квант саны мына мә ндерді қ абылдайды:
A) -l, 0, + l
B) 1, 2. … ¥
C) 0 … (n-1)
D) +1/2, -1/2
E) 0, ½, 1
43$. Иондану энергиясы-бұ л:
A) бейтарап атомнан электронды ү зуге қ ажет энергия мө лшері;
B) диссоциациялану ү рдісіне қ ышқ ыл, негіз, тұ з молекуласының қ абілеттілігі;
C) Атомның электрон қ осып алуында бө лінген энергия мө лшерін;
D) Атомның электрон беру қ абілеттілігі;
E) Атомның электрон қ абылдау қ абілеттілігі.
21$. Кванттық энергия туралы болжамды алғ аш айтқ ан ғ алым:
A) М. Планк
B) Лу де Бройль
C) С. Аррениус
D) Д. И. Менделеев
E) Паули
F) Гунд
G) Клечковский
22$. Луи Де Бройль:
A) микробө лшектің қ озғ алысы-толқ ындық ү рдіс
B) диссоциация – қ айтымды ү рдіс
C) квант энергиясы сә улелену жиілігіне тә уелді
D) анық талмағ ыштық принципін ұ сынды
E) атомның ядролық моделін қ ұ рды
F) электролизді сандық сипаттады
G) заттың ең басты қ асиеті- массасының болуы
23$. Масса- энергия сақ талу заң ының ө рнектелуі:
A) 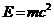
B) 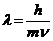
C) 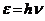
D) 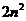
E) 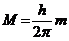
F) 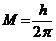
G) 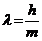
24$. М. Планк тең деуінің ө рнектелуі:
A) 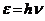
B) 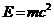
C) 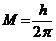
D) 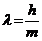
E) 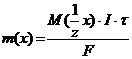
F) 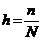
G) 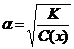
25$. Луи Де Бройль тең деуінің ө рнектелуі:
A) 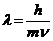
B) 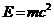
C) 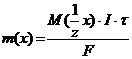
D) 
E) 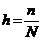
F) 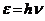
26$. В. Гейзенбергтің анық талмағ ыштық принципі:
A) бір уақ ытта микробө лшектің орны мен оның қ озғ алу санын дә л анық тау мү мкін емес
B) атомда барлық квант сандарының жиынтығ ы бірдей екі электрон бола алмайды
C) кванттық энергия сә улелену жиілігіне тә уелді
D) частице массой m, движущейся со скоростью ν, соответствует волна длиной λ
E) волновая функция называется орбиталью
F) орбиталь можно однозначно описать набором квантовых чисел
27$. Шредингердің толқ ындық тең деуі сипатталады:
A) атомның жә не оның энергиясының берілген орында электронның табылу мү мкіндігі
B) реакция жылдамдығ ының ә рекеттесуші массалар концентрациясына тә уелділігі
C) энергетикалық дең гейдегі электрондар саны
D) бө лшектердің парамагнитті қ асиеті
E) атомдық орбитальдардың кең істіктік бағ ыты
F) электрондық тығ ыздық тың радиальді таралуы
G) кез келген микробө лшектің қ озғ алысы-толқ ындық ү рдісі
28$. К электрондық қ абаттың қ абаттың максимальді сиымдылығ ы:
A) 2
B) 16
C) 8
D) 10
E) 24
29$. Максимальная емкость электронного слоя М:
A) 8
B) 18
C) 32
D) 14
E) 10
F) 2
30$. Максимальная емкость электронного слоя L:
A) 18
B) 2
C) 14
D) 10
E) 28
F) 34
31$. Максимальная емкость электронного N:
A) 32
B) 18
C) 8
D) 2
E) 10
32$. n = 3, l = 0, m = 0 квант сандарымен сипатталатын орбитальдің пішіні:
A) шар
B) гантель
C) квадрат
D) 4 лепестка
E) шар + гантель
33$. Ү лкен периодтарда d жә не f элементтердің атомдары радиустарының баяу тө мендеуі мынағ ан байланысты:
A) d- жә не f- сығ ылумен
B) сыртқ ы электрон қ абатының толуымен
C) электрон қ озғ алысының толқ ындық сипатымен
D) элементтің валенттік кү йімен
E) аяқ талғ ан қ абаттан электронның жойылуымен
34$. Кіші периодтарда элементтердің атом радиустарының кішіреюі мынағ ан байланысты:
A) сыртқ ы электрондық қ абаттың толуымен
B) d- жә не f-сығ ылуымен
C) электрон қ озғ алысының толқ ындық сипатымен
D) элементтің валенттік кү йімен
E) аяқ талғ ан қ абаттан электронның жойылуымен
35$. Периодтарда атомдық жә не иондық радиустардың ядро зарядтарының артуы бойынша:
A) тө мендейді
B) ө седі
C) ө згермейді
D) секірмелі ө згереді
E) бірден ө згереді
36$. Периодтарда атом радиустарының ең тө мендеуі байқ алады:
A) кіші периодтар элементтерінде
B) ү лкен период элементтерінде
C) d-элементтерінде
D) f-элементтерінде
E) s-, р-, d- жә не f-элементтерінде бірдей дә режеде
37$. Электронғ а ең жақ ын қ асиетке ие:
A) VII топтың р-элементтері
B) II топтың s-элементтері
C) VI топтың f-элементтері
D) d-элементтер
E) III тобының р-элементтері
38$. Иондану энергиясы ең тө мен мә нде болатын:
A) I топтың s-элементтері
B) II топтың s-элементтері
C) IV топтың р-элементтері
D) барлық d-элементтер
E) VII топтың р-элементтер
39$. Электронның ө зіне тә н электрон қ озғ алыс мө лшерінің меншікті моменті мына мә ндермен анық талады:
A) спин квант сандар
B ) бас квант сандар
С) қ осымша квант сандар
D) магнитті квант сандар
E) орбитальді квант сандар
40$. l орбитальді квант саны мына мә ндерді қ абылдауы мү мкін:
A) 0-ден (n - 1) дейін
B) 0-ден шексіздікке дейін
C) 1-ден n дейін
D) 1-ден (n - 1) дейін
E) 1-ден шексіздікке дейін
G) 0-ден n дейін
41$. m магнитті квант саны мына мә ндерді қ абылдауы мү мкін:
A) -l-ден +l-дейін
B) 0-ден шексіздікке дейін
C) 1-ден n
D) 1-ден (n - 1)-дейін
E) 1-ден шексіздікке дейін
G) 0-ден n дейін
42$. Бас квант саны 6-ғ а тең электрон қ абатындағ ы электрондардың максималь санын анық таң дар:
A) 72
B) 36
C) 18
D) 14
E) 10
F) 6
G) 2
43$. Қ осымша квант саны l = 4 болатын электрондық қ абаттағ ы электрондардың максималь саны:
A) 18
B) 32
C) 14
D) 8
E) 10
44$. n, l, m квант сандары мына тең деуді шешу нә тижесінде алынады:
A) Шредингер
B) Гейзенберг
C) Де-Бройль
D) Дирак
E) Ридберг
45$. Кестеде n, l, ml жә не ms электрондардың квант сандары келтірілген
| Электрон | первый | второй | третий |
| n | |||
| L | |||
| ml | +1 | -1 | |
| ms | +1/2 | +1/2 | +1/2 |
электрондар кү йін анық таң дар:
A) 5d3
B) 5f3
C) 5p3
D) 2p3
E) 3p3
46$. 5f, 4s, 7d электрондары мен осы электрондардың 2 бас квант саны мә ндерінің арасында сә йкестікті анық таң дар:
A) 5, 4, 7
B) 4, 5, 8
C) 7, 2, 0
D) 3, 4, 7
E) 2, 5, 6
47$. Берілген бас квант санды электрондардың максималь саны мен дең гейдегі орбитальдар саны мына формулағ а сә йкес анық талады:
A) 2n2 жә не n-1
B) 2n+1 жә не 2n2
C) n2 жә не 2n2
D) n-1 жә не n2
E) 2n2 жә не n2
48$. Қ осымша квант саны l = 2 болатын, электрондық қ абаттағ ы электрондардың максималь саны мынағ ан тең:
A) 10
B) 4
C) 14
D) 6
E) 2
49$. Ni, Cr, Br, Bа атомдарының қ алыпты кү йінде жұ птаспағ ан электрондар саны:
A) 2610
B) 3432
C) 5512
D) 6250
| 1. 4d | 2. 4f | 3. 5p | 4. 6p |
E) 4613
50$. Энергияның арту реті бойынша орналасу реттілігі:
A) 1324
B) 4123
C) 1432
D) 3241
E) 2314
51$. Қ осымша квант саны l мә ндері мен d, f, p, s электрондық орбитальдардың мә ндері арасындағ ы сә йкестікті анық таң дар:
A) 2310
B) 1320
C) 3201
D) 0321
E) 2130
52$. Металл атомдарының иондану энергиясының арту ретін анық таң дар
1- Be, 2- B, 3- Na, 4- Mg:
A) 3412
B) 3214
C) 2134
D) 4123
E) 1234
53$. 1-Be, 2- F, 3- Ca, 4- N элементтері атомдарының электртерістілігінің ө су ретін анық таң дар:
A) 3142
B) 3214
C) 2134
D) 4123
E) 1234
54$. 1- Азот, 2- Оттегі, 3- Кремний, 4- Фосфор химиялық элементтерін олардың атомдарының электронғ а жақ ын қ асиетінің тө мендеу реті бойынша орналастырың дар:
A) 2143
B) 3214
C) 2134
D) 4123
E) 1234
55$. Қ осылыстарында валенттігі топ нө мірінен артатын химиялық элементтер:
A) мыс, кү міс, алтын
B) мырыш, кү кірт, сынап
C) мыс, ксенон, осьмий
D) кү кірт, платина, темір
E) ксенон, платина, темір
56$. Азот молекуласында жұ п электрондардың жұ п электрондардың жалпы саны:
А) 3
B)2
C)1
D)5
E)4
57$. Ковалентті полюссіз молекулалар:
А) N2, O2
B) CO2, SO2
C) CaO, Na2O
D) H2O, NH3
E) CuOH, KOH
58$. s-электрон бұ лттарының кең істіктегі пішіні:
А) шар
B) гантель
C) сызық тық
D) квадрат
E) ромб
59$. р-электрон бұ лттарының кең істіктегі пішіні:
A) гантель
B) шар
C) сызық тық
D) квадрат
E) ромб
60$. Молекуласында бір σ -жә не екі π -байланысы бар:
A) N2
B) O2
C) H2
D) S2
E) Cl2
61$. Молекуласында тө рт σ -байланысы бар:
A) CH4
B) SO3
C) H2O
D) C2H4
E) C2H6
62$. Электртерістілігі ең жоғ ары элемент:
A) F
B) O
C) N
D) C
E) B
63$. H2SO3 молекуласында байланыстар саны:
A) 6
B) 3
C) 2
D) 4
E) 1
64$. Элемент-хлор байланысының иондану дә режесі мына қ атарда артады:
A) CCl4- BCl3- BeCl2- LiCl
B) BCl3- BeCl2- CCl4- LiCl
C) BeCl2- LiCl- CCl4- BCl3
D) LiCl- CCl4- BCl3- BeCl2
E) LiCl- BeCl2- BCl3- CCl4
65$. Элемент-хлор байланысының иондану дә режесі мына қ атарда артады:
A) BeCl2- MgCl2- CaCl2- BaCl2
B) BaCl2- BeCl2- CaCl2- MgCl2
C) BeCl2- CaCl2- MgCl2- BaCl2
D) MgCl2 - CaCl2- BaCl2- BeCl2
E) BaCl2 - CaCl2- MgCl2- BeCl2
66$. Байланыстың полярлану дә режесі мына қ атарда артады:
A) СH4- NH3- H2O - HF
B) HF - СH4- NH3- H2O
C) NH3- H2O – HF- СH4
D) H2O – HF- СH4- NH3
67$. Екіатомды молекулалардың полярлығ ы мына ретте артады:
| 1. HI | 2. HBr | 3. HF | 4. HCl | 5. Cl2 |
A) 51243
B) 32145
C) 43521
D) 21345
E)41253
68$. Екіатомды молекулаларда байланыстардың иондық сипатының арту реттілігін анық таң дар 1- CaCl2, 2- MgCl2, 3- Cl2, 4- HCl, 5- KCl:
A) 34215
B) 32514
C) 52134
D) 45123
E) 12345
E) HF - H2O- NH3- СH4
69$. Қ атардағ ы диамагнитті бө лшектер:
A) 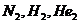
B) 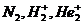
C) 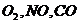
D) 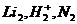
E) 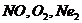
70$. Қ атардағ ы парамагнитті бө лшектер:
A) 
B) 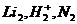
C) 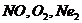
D) 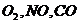
E) 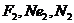
F) 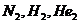
71$. Ең берік молекулааралық сутектік байланысы бар заттар:
A) HF
B) HCl
C) HBr
D) NH3
E) Н2О
72$. 1-С6Н6, 2-С2Н2, 3-С2Н4, 4-С2Н6 кө мірсутектерінде кө міртек-кө міртек байланыстарының ұ зындығ ының артуы реттілігін анық таң дар:
A) 2314
B) 3214
C) 2134
D) 4123
E) 1234
73$. 1-H2S, 2-H2O, 3-H2Te, 4-H2Se кө мірсутектерінде кө міртек-кө міртек байланыстарының ұ зындығ ының артуы реттілігін анық таң дар:
A) 3412
B) 3214
C) 2134
D) 4123
E) 1234
74$. А жә не В атомдары арасында ковалентті полюссіз байланыс атомдардың электртерістілігінің келесі қ атысында тү зіледі:
A) ЭО(A) = ЭО(В)
B) ЭО(A) < ЭО(В)
C) ЭО(A) > ЭО(В)
D) ЭО(A) < < ЭО(В)
E) ЭО(A) > > ЭО(В)
F) атомдардың кез келген электртерістілігі қ атынасында
75$. Химиялық донорлы-акцепторлы байланыс келесі нә тижесінде тү зіледі:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|