
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция 17 1 страница
04.3.0 Физическая термодинамика - 2 часа
Лекция 17
Агрегатные состояния вещества. Условия равновесия фаз: отношение масс вещества, находящемся в равновесном двухфазном состоянии. Анализ равновесного двухфазного состояния вещества с помощью термодинамического потенциала Гиббса. Фазовые переходы первого рода в двухфазной термодинамической системе: уравнение Клапейрона - Клаузиуса. Диаграммы состояний при фазовых переходах в термодинамической системе. Фазовые переходы второго рода в двухфазной термодинамической системе. Критические явления при фазовых переходах в термодинамической системе. Отличительные черты кристаллического состояния твёрдых тел. Классификация кристаллов твёрдых тел. Физические типы кристаллических решёток твёрдых тел. Дефекты в кристаллах твёрдых тел. Теплоёмкость кристаллов твёрдых тел.
Основные представления о строении жидкостей. Поверхностное натяжение и свободная поверхностная энергия. Равновесие смачивающей и несмачивающей капель жидкости на поверхности твердого тела. Капиллярный эффект. Формула Лапласа для поверхностного натяжения, дополнительное давление, создаваемое сферической поверхностью жидкости. Анализ равновесного состояния границы раздела между фазами вещества с помощью термодинамического потенциала Гельмгольца. Анализ равновесного состояния границы раздела жидкость - газ с помощью термодинамического потенциала Гельмгольца. Применение термодинамического потенциала Гельмгольца для определения температурной зависимости коэффициента поверхностного натяжения жидкости
Агрегатные состояния вещества. Условие равновесия фаз: отношение масс вещества, находящемся в равновесном двухфазном состоянии
Термодинамическийметод применим для описания не только однородныхпо физику - химическому составу сред, но и систем, состоящих из нескольких пространственно разнесённых частей, между которыми существует граница раздела. Проще всего описывать термодинамические системы, у которых составные части находятся в равновесныхсостояниях, а через границы раздела не происходит перенос вещества, энергии и импульса. Такая термодинамическая система является равновесной и для неё применимы методы равновесной термодинамики.
Если составные части термодинамической системы не находятся между собой в равновесии, то возникают термодинамическиепотоки через границы их раздела. Считая происходящие в системе процессы квазистатическими, а потоки малыми, можно использовать методы равновесной термодинамики и для неравновесной системы.
При описании пространственно неоднородныхсред применимо разбиение их на некоторое число однородныхпо своему составу частей, разделённых границами раздела. Макроскопическая часть среды, т.е. вещества, имеющая однородный физико - химический состав, называется фазой. Далее рассматриваются термодинамические системы, для описания состояния фаз которых применимы методы равновесной термодинамики.
Если среда однородна по всему своему объёму, то такая термодинамическая система будет однофазной, а если система состоит из двухили болееграничащих между собой однородных сред, то это двухфазнаяили многофазная термодинамическая система. Примером двухфазнойсистемы может служить стеклянный сосуд с налитой в него водой. В этом случае в системе имеются жидкаяи твёрдая фазы, которыми являются соответственно вода и стекло. Если в состав системы включить окружающий сосуд воздух, то она станет трёхфазнойсистемой. Смесь газов является однофазной системой, т.к. в этой смеси нет границы раздела.
Для равновесия фазнеобходимо, чтобы между ними наблюдалось тепловоеи механическоеравновесие. Первое из этих условий означает равенство T1 и T2 температур с разных сторон границы раздела фаз, т.е. T1 = T2 = T. Второе условие не обязательно соответствует равенству(4.1) из раздела
4. 1 "Физическая термодинамика" P1 и P2 давлений с разных сторон границы раздела, т.к. сама граница, если она не является плоской, может создавать дополнительное межфазноедавление.Поэтому в общемслучае условие механическогоравновесия имеет следующий вид:
P2 = P1 + ΔP12, (4. 413)
где ΔP12 - дополнительное давление на первуюфазу, создаваемое границей её раздела со второй. Если считать границуфаз плоской, то(4.413) условие будет эквивалентнопредположению о равенстве давлений по обе стороны от неё, т.е. P1 = P2 = P.
При фазовыхпревращениях процессына границе раздела носят согласно параграфу "Статистическое обоснование второго начала термодинамики: формула Больцмана для статистической энтропии" из раздела 4.2 "Физическая термодинамика" статистическийхарактер.
На (рис.44)границе раздела водаи пар, происходит постоянный процесс перехода молекул из водыв пар и обратно. В равновесномсостоянии они взаимно компенсируются. Изотермическое при T температуре сжатие водяногопара, что сопровождается отводом Qп теплоты, приводит при V = Vп объёме к образованию в Цл цилиндре под Пр поршнем, к которому приложен вектор F1 внешней силы, насыщенного пара воды mмассой с Pн п давлением. В состоянии, когда F модуль вектора F внешней силы достиг F2 значения, что сопровождается отводом Qп, Qв теплоты, часть насыщенного пара водыпревращается в воду mв массой, которая занимает Vв' объём, а оставшаяся часть насыщенного пара водыmп массой с Pн п давлением занимает Vп' объём. В состоянии, когда F модуль вектора F внешней силы достигает F3 значения, весь насыщенный парпревращается в воду m массой, которая занимает Vв объём. Двухфазному равновесному состоянию вода + пар соответствует горизонтальный участок изотермы.
|
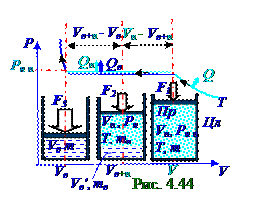
значении F модуля вектора F внешней силы, равном F3.
При значении F модуля вектора F внешней силы, равном F2, под Пр поршнем в Цл цилиндре при Pн п давлении насыщенного пара водыmв масса водыимеет с учётом (4.414) следующее значение: mв = Vв'/v0в ↔ Vв' = mвv0в ↔ Vв' = mвVв/m, (4.415) где Vв'- объёмводыmв массой, образовавшейся из насыщенного парав Цл цилиндре под Пр поршнем при значении F модуля вектора F внешней силы, равном F2.
При значении F модуля вектора F внешней силы, равном F2, под Пр поршнем в Цл цилиндре
mп масса насыщенного пара воды при Pн п давленииимеет с учётом (4. 414) следующее значение: mп = Vп'/v0п ↔ Vп' = mпv0п ↔ Vп' = mпVп/m, (4.416) где Vп'- объёмнасыщенного пара водыmп массойв Цл цилиндре под Пр поршнем при значении
F модуля вектора F внешней силы, равном F2.
Сумма (4.410) Vв' объёмаводыmв массой и (4.416) Vп' объёманасыщенного пара воды
mп массойв Цл цилиндре под Пр поршнем равняется (рис.4.44) следующему значению суммарногоVв+п
объёма насыщенный пар - вода на горизонтальном участке изотермы при значении F модуля вектора F внешней силы, равном F2:
Vв+п = Vв' + Vп' = (mвVв/m) + (mпVп/m) ↔ Vв+п = [mвVв/(mв+ mп )] + [mпVп/(mв+ mп )] ↔
↔ Vв+п = (mвVв + mпVп)/(mв+ mп ) ↔ Vв+п = mп[Vп+ (mв/mп)Vе]/mп[1 + (mв/mп)] ↔
↔ Vв+п = [Vп+ (mв/mп)Vе]/[1 + (mв/mп)] ↔ Vв+п + [(mв/mп)Vв+п] = [Vп+ (mв/mп)Vе] ↔
↔ [(mв/mп)Vв+п] - [(mв/mп)Vе] = Vп - Vв+п ↔ mв/mп = (Vп - Vв+п) /(Vв+п - Vв), (4.417)
где m = mв+ mп - масса насыщенного пара воды в Цл цилиндре под Пр поршнем при значении
F модуля вектора F внешней силы, равном F1, из которой на горизонтальном участке изотермы образовалась mв массаводыи осталась mп масса насыщенного пара воды; с другой стороны m - масса воды, которая образовалась в Цл цилиндре под Пр поршнем при значении F модуля вектора F внешней силы, равном F3, из всего насыщенного пара.
Согласно (4.417) в равновесном двухфазномсостоянии вода - пар, которому (рис.4.44) соответствует горизонтальный участок изотермы сжатия водяногопара при T температуре, отношение mв/mп массы mв водык mп массе насыщенного пара воды численно равно отношению длины отрезка Vп - Vв+п, который представляет собой разностьмежду Vп объёмом всегонасыщенного пара воды исуммарнымVв+п объёмом насыщенный пар - вода, к длине отрезка Vв+п - Vв, который представляет собой разностьмежду суммарнымVв+п объёмом насыщенный пар - вода и Vв объёмом воды, полученной из всего насыщенного пара.
Выражение (4.412) применимо для расчёта отношений масс вещества, находящемся в равновесном двухфазномсостоянии, и имеет следующий вид: mI/mII = (VII - VI+II)/(VI+II - VI), (4.418) где mI, mII - массы вещества, находящемся в равновесном двухфазномсостоянии, например, mI - масса кристалла, а mII - масса жидкости, полученная при плавлении части кристалла; VI - объём 1-ой фазы, когда, например, вся жидкостьпревратилась в кристалл; VII - объём 2-ой фазы, когда, например, весь кристаллпревратился в жидкость; VI+II- суммарный объём, занимаемый 1-ой и 2-ой фазой, например,кристалломи жидкостьюв равновесном двухфазномсостоянии.
Анализ равновесного двухфазного состояния вещества с помощью термодинамического потенциала Гиббса
Термодинамический G(P, T) потенциал Гиббса (4. 200) из раздела 4.1 "Физическая термодинамика"термодинамической системы при постоянных P давлении и T температуре, находящейся вравновесном двухфазномсостоянии с M1, M2 массами фаз, имеет следующий вид: G(P, T) = M1(t)φ1(P, T) + M2(t)φ2(P, T), (4.419) где φ1(P, T) = G1(P, T)/M1(t) , φ2(P, T) = G2(P, T)/M2(t) - соответственно удельные термодинамические потенциалыГиббса 1-ой фазыс M1(t) массой и 2-ой фазыс M2(t) массой.
При фазовыхпревращенияхобщаяM масса 1-ой фазыс M1(t) массой и 2-ой фазыс M2(t) массой остаётся неизменной, т.е. не зависит от момента t времени, в который производят измерение этой общейM массы, поэтому имеет место следующее выражение: M = M1(t) + M2(t), (4.420) где M1(t), M2(t) - соответственно массы 1-ой и 2-ой фаз термодинамической системы, находящейся вравновесном двухфазномсостоянии, в произвольный момент t времени.
Если M1(t) масса 1-ой фазы термодинамической системы, находящейся при постоянных
P давлении и T температуре вравновесном двухфазномсостоянии, в момент ti времени измерения этой M1(ti) массы уменьшилась на ΔM величину по сравнению с M1(ti-1) массой в предшествующий момент ti-1 времени, то согласно (4.415) на такую же ΔM величину увеличилась M2(t) масса 2-ой фазы в момент ti времени измерения этой M2(ti) массы по сравнению с M2(ti-1) массой в предшествующий момент ti-1 времени, поэтому термодинамический G(P, T) потенциал Гиббса в данный момент
ti времени имеет следующий вид: G(P, T) = [M1(ti) - ΔM]φ1(P, T) + [M2(ti) + ΔM]φ2(P, T). (4.421)
Исследование (4.421) функции G(P, T) = G термодинамического потенциала Гиббса на минимум в данный момент ti времени по независимой переменной M1(ti) = M1 массой 1-ой фазы термодинамической системы, находящейся при постоянных P давлении и T температуре вравновесном двухфазномсостоянии с (4.420) M2(ti) = M - M1(ti) = M - M1 массой 2- ой фазыэтой термодинамической системы, приводит к следующему выражению:
∂G/∂M1 = ∂[(M1 - ΔM)φ1+ (M - M1)φ2]/∂M1 = (φ1∂M1/∂M1 ) - (φ2∂M1/∂M1) = 0 ↔ φ1(P, T) = φ2(P, T), (4.422) где M - общая масса вещества в термодинамической системе, находящейся при постоянных
P давлении и T температуре вравновесном двухфазномсостоянии, является для этой термодинамической системы величиной постоянной; ΔM = M1(ti) - M1(ti-1) - приращение M1(ti) массы 1-ой фазы термодинамической системы, находящейся при постоянных P давлении и T температуре вравновесном двухфазномсостоянии, которое в данный момент ti временипостоянно;
φ1 = φ1(P, T) = G1(P, T)/M1(ti), φ2 = φ2(P, T) = G2(P, T)/M2(ti) - соответственно удельные термодинамические потенциалыГиббса 1-ой фазыс M1(ti) массой и 2-ой фазыс M2(ti) массой в термодинамической системе, находящейся при постоянных P давлении и T температуре вравновесном двухфазномсостоянии, которые в данный момент ti временипостоянны.
Согласно (4.422) минимум термодинамического потенциала Гиббса у двухфазной термодинамической системы, находящейся при постоянных P давлении и T температуре, свидетельствует о равновесномсостоянии этой термодинамической системы, которое сопровождается равенствомв данный момент ti времени φ1(P, T), φ2(P, T) удельных термодинамических потенциаловГиббса 1-ой и 2-ой фаз.
Уравнение P давленияв зависимости от T температурына границе раздела
2-ух фаз термодинамической системы, находящейся в данный момент ti времени вравновесном двухфазномсостоянии, может быть получено из решения (4.422) φ1(P, T) = φ2(P, T) выражения относительно P давленияв f функции от T температуры, т.е. P = f(T). Например, этим P = f(T) уравнением является (рис. 4.44) горизонтальный участок изотермы на границе раздела
насыщенный пар - вода, а также этим P = f(T) уравнением является (рис. 4.46) кривая плавленияна границе раздела жидкость - твёрдое тело.
Фазовые переходы первого рода в двухфазной термодинамической системе: уравнение Клапейрона - Клаузиуса
Равенствов данный момент ti времени (4.422) φ1(P, T) = φ2(P, T), т.е.φ1 = φ2, удельных термодинамических потенциаловГиббса на границе раздела 1-ой и 2-ой фаз в термодинамической системе, находящейся вравновесном двухфазномсостоянии, но различиеих следующих первых производных по независимымP давлению и T температуре свидетельствует о фазовом переходе первого рода: (∂φ1/∂T)P ≠ (∂φ2/∂T)P; (∂φ1/∂P)T ≠ (∂φ2/∂P)T, (4.423) где индексы "P", "T" при первых производных означают, что при определении частной производной по независимойT температуре постояннымпараметромявляется P давление, а при определении частной производной по независимомуP давлению постояннымпараметромявляется T температура.
Характерной особенностью фазовых переходов первого рода является поглощениеили выделениетеплоты при их осуществлении. К фазовым переходам первого родаотносятся превращения при испарении, конденсации, плавлениии кристаллизациивещества.
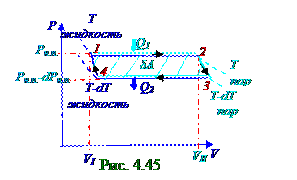
Цикл (рис.4.19) из раздела 4. 1 "Физическая термодинамика" Карно включает
(рис. 4.45) горизонтальные 1-2, 3-4 участки изотермы, в пределах которых происходит постоянный равновесныйпроцесс перехода молекул из жидкостив насыщенный пар и обратнопо (4.422) фазовому переходу первого рода, и две 2-3, 4-1 адиабаты.
В результате изотермического1-2 процесса от нагревателяс T температурой происходит передача рабочему телуQ1 теплоты, в результате чего из 1- го состояния жидкость, т.е. 1-ая фаза,
m массой VI объёмом испаряется и превращается в насыщенный парPн.п. давлением. В результате изотермического 1-2 процесса во 2- ом состоянии вся жидкость в результате равновесногоизотермического расширения при T температуре и Pн.п. давлении 2-ух фаз термодинамической системы жидкость- насыщенный пар переходит в фазовое состояние насыщенный пар m массой
VII объёмом.
В результате 2-3 процесса происходит (4.68) из раздела 4. 1 "Физическая термодинамика" адиабатическое расширение насыщенного пара, сопровождающееся уменьшением его температуры от T до T-dT значения иуменьшением его давления от Pн.п до Pн.п.- dPн.п значения.
|
Pн.п.-Pн.п давлении 2-ух фаз термодинамической системы насыщенный пар - жидкость переходит в фазовое состояние m массой VI объёмом.
В результате 4-1 процесса происходит (4.68) из раздела 4. 1 "Физическая термодинамика" адиабатическое сжатие жидкости, сопровождающееся увеличением его температуры от T-dT до
T значения иувеличением его давления от Pн.п.- dPн.п до Pн.п значения.
КПД (4.123) из раздела 4.1 "Физическая термодинамика" (рис. 4.45) тепловой машины вциклическом процессе имеет следующий вид: η = δA/Q1, (4.424)
где δA - работа, выполненная рабочим телом - насыщенным паром в циклическом процессе при его переходе из 1- го в 3- ье состояние и затем возвращения из 3- го в 1- ое состояние, численно равна заштрихованной площади между горизонтальными 1-2, 3-4 участками изотермы и 2-3, 4-1 адиабатами. Эта заштрихованная площадь, вследствие (рис. 4.45) малости приращения dT, dPн.п соответственно температуры и давлении 2-ух фаз термодинамической системы жидкость- насыщенный пар между 2 - мя горизонтальными 1-2, 3-4 участками изотермы, приблизительноравна площади заштрихованногопрямоугольника, поэтому δA работа, выполненная рабочим телом - насыщенным паром в циклическом процессе имеет следующий вид: δA = P(VII - VI ) - (P -dP)(VII - VI ) ↔ ↔ δA = dP(VII - VI ) = dP(mv0II - mv0I) = m(v0II - v0I)dP, (4.425) где dP - малое приращение давления в термодинамической системе, находящейся вравновесном двухфазномсостоянии; VII - объёмнасыщенного пара m массой, который вследствие (рис.4.45) малости приращения dT, dPн.п соответственно температуры и давлении 2-ух фаз термодинамической системы жидкость- насыщенный пар между 2 - мя горизонтальными 1-2, 3-4 участками изотермы, приблизительно одинаков в 2, 3 состояниях на 2-3 адиабате; VI - объёмжидкости m массой в
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|