
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Атомдардың күйлерін жуықтап есептеу. Томас-Фермидің статистикалық әдісі
39. Атомдардың күйлерін жуықтап есептеу. Томас-Фермидің статистикалық әдісі
Томас-Фермидің статистикалық әдісінің мәнісі мынада: атомдардағы электрондардың үлестірілуі толқындық функциямен емес, координаттан тәуелді қандай да бір 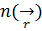 тығыздықпен сипатталады деп есептелінеді. Бұлай есептелуді себебі атомның көптеген электрондары үлкен кванттық сандармен сипатталатын күйлерде болып, бұл электрондарға сәйкес келетін де Бройль толқындарының ұзындығы атомдардың өлшемінен әлдеқайда кіші болады. Ал мұндай қасиетке ие электрондарды жартылай классикалық тұрғыдан қкарастырып, олардың импульсін координаттың функциясы деп айтудың жөні бар.
тығыздықпен сипатталады деп есептелінеді. Бұлай есептелуді себебі атомның көптеген электрондары үлкен кванттық сандармен сипатталатын күйлерде болып, бұл электрондарға сәйкес келетін де Бройль толқындарының ұзындығы атомдардың өлшемінен әлдеқайда кіші болады. Ал мұндай қасиетке ие электрондарды жартылай классикалық тұрғыдан қкарастырып, олардың импульсін координаттың функциясы деп айтудың жөні бар.
Статистикалық физикада барлық 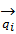 жалпыланған координаттар мен
жалпыланған координаттар мен 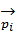 жалпыланған импульстер кеңістігі болып табылатын фазалық кеңістік ұғымы енгізіледі. Фазалық кеңістік жүйенің күйін немесе фазасын анықтайды.
жалпыланған импульстер кеңістігі болып табылатын фазалық кеңістік ұғымы енгізіледі. Фазалық кеңістік жүйенің күйін немесе фазасын анықтайды.
Импульсі нөлден 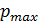 –ға дейінгі аралықта өзгеретін электрон үшін физикалық кеңістіктегі dV элементінің фазалық көлемін табалық
–ға дейінгі аралықта өзгеретін электрон үшін физикалық кеңістіктегі dV элементінің фазалық көлемін табалық
dV 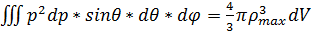
Бұл көлемдегі ұя саны немесе күй саны
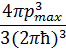
Томас-Фермидің теңдеуі:
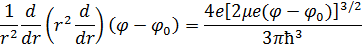
40. Элементтердің периодтық жүйесі. Электрондық конфигурация. Паули прнципі. Электрондық қабат және электрондық қабыршық.
1869 жылы орыс ғалымы Д. И. Менделеев химиялық элементтердің атомдық массасы артқан кезде олардың негізгі қасиеттерінің периодты түрде қайталанып отыратынын байқады. Элементтерді жүйелеу барысында атомдардағы электрондардың дербес күйлерінің сақталуына негізделген электрондық конфигурация ұғымының маңызы зор. Оларды табу үшін қарастырылып отырған электронды атом ядросы мен сол атомның басқа барлық электрондары туғызып тұрған тиімді орталық симметриялы өрісінде қозғалады деп есептейді.
Атомдағы электрондардың күйін n, l, 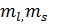 кванттық сандарымен сипаттау барысында бұған қосымша Паули принципі басшылыққа алынады.
кванттық сандарымен сипаттау барысында бұған қосымша Паули принципі басшылыққа алынады.
Фермиондар Паули принципіне бағынады. Ол принципке сəйкес спиндері жартылай бүтін бөлшектер жүйесінде бір күйде тек бір ғана бөлшек бола алады. Көпэлектронды атомның негізгі күйінің электрондық конфигурациясы энергиялық деңгейлердің Паули принципіне сəйкес энергиясы арта отырып толуы арқылы анықталады. Яғни
1s, 2s, 2p, 3s, 3p, [4s, 3d], 4p, [5s, 4d], 5p,
[6s, 4f, 5d], 6p, [7s, 5f, 6d],…
Энергиялары бір-біріне жақын және басқа күйлерден едәуір энергиялық аралықпен ажыратылатын күйлерді электрондық қабаттар деп атайды. Ал қабаттар электрондық қабықтардан тұрады.
Кванттық сандары n және l болатын қабықтарда барлығы 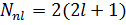 элеетрон бола алады. Ал n кванттық санымен анықталған қабаттарда бола алатын электрондардың саны
элеетрон бола алады. Ал n кванттық санымен анықталған қабаттарда бола алатын электрондардың саны 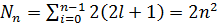
Қабықтардың толуының идеалды схемасы
| Қабат нөмірі | Электрондық күй | Күйдің толық саны |
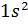
| ||
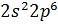
| ||
| 3 | 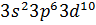
| |
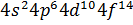
| ||
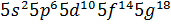
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|