
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
16.6. ПОСЛЕДСТВИЯ УДАЛЕНИЯ РАЗЛИЧНЫХ ОТДЕЛОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Изучению в эксперименте впервые этот вопрос был подвергнут в лаборатории Е. С. Лондона. Удаление кардиального отдела желудка у собак вело к булимии и полифагии. Прием пищи часто заканчивался рвотой, которая напоминала приступ удушья и сопровождалась сокращением шейных мышц. Особенности рвоты объяснялись тем, что она возникала при наличии пищи в пищеводе (пищеводная рвота).
Выключение привратника (наложение гаст-роэнтероанастомоза) вызывало нарушение эвакуации пищевого химуса из желудка, тем более выраженное, чем с более низким отделом тонкой кишки накладывался анастомоз. Удаление дна желудка вело к нарушению его резервуар-ной и секреторной функций. Расстройства были более выражены при полном удалении желудка, однако его функции постепенно брали на себя нижележащие отделы пищеварительного тракта.
После хирургических операций, таких как пилоропластика, гастрэктомия, антрэктомия, приводящих к нарушению функций антрально-го отдела желудка или привратника, из-за быстрой эвакуации содержимого желудка в кишечник у ряда больных наблюдается специфический симптомокомплекс, известный как «демпинг-синдром». Ранний демпинг-синдром развивается в течение первого часа после еды, когда появляются чувство быстрого насыщения, жидкий стул, вздутие и боли в животе. Отмечаются также вегетативные реакции в виде покраснения лица, потливости, тахикардии. Эти симптомы связаны с поступлением большого количества гипертонического химуса из желудка или его культи в проксимальные отделы тонкой кишки. При этом происходит рефлекторная стимуляция моторики, обусловливающая диарею и
внезапное увеличение содержания жидкости в гонкой кишке, что ведет к ее растяжению. Вследствие этого возможна гиповолемия (уменьшение объема плазмы). Симптоматика усиливается в результате высвобождения кишечных гормонов и вазоактивных медиаторов (брадикинин, серо-тонин и др.), которые и вызывают вегетативные расстройства. Поздний демпинг-синдром включает в себя головокружение, головные боли, дрожание, сердцебиение, потливость, голод, спутанность сознания и иногда обмороки через 1,5-3 ч после еды. Симптомы могут появиться и рань-
ше, если пищевые продукты содержат большое количество простых углеводов, особенно сахарозу. Этот синдром обусловлен гипогликемией. Вначале происходит быстрое увеличение количества глюкозы в крови (гипергликемия) из-за резкого поступления сахаросодержащих компонентов пищи из желудка в проксимальные отделы тонкой кишки, которое сменяется гипогликемией. Быстрое всасывание углеводов стимулирует высвобождение инсулина, который циркулирует в крови дольше, чем глюкоза, и в конечном итоге развивается гипогликемия.
Глава 16 / ПАТОФИЗИОЛОГИЯ ПИЩЕВАРЕНИЯ
Глава 17 ПАТОФИЗИОЛОГИЯ ПЕЧЕНИ
Печень представляет собой важнейший железистый орган, обеспечивающий постоянство внутренней среды организма. Она была названа «большой химической лабораторией» (К. Людвиг). Это уникальный и сложно функционирующий орган, являющийся центральным в метаболизме белков, углеводов, жиров и играющий важную роль в метаболизме лекарственных препаратов. В печени происходит:
1) образование желчных пигментов, синтез холестерина, синтез и секреция желчи;
2) обезвреживание токсичных продуктов, поступающих из желудочно-кишечного тракта;
3) синтез белков, в том числе протеинов плазмы крови, их депонирование, переаминирование и дезаминирование аминокислот, образование мочевины и синтез креатина;
4) синтез гликогена из моносахаридов и неуглеводных продуктов;
5) окисление жирных кислот, образование кетоновых тел;
6) депонирование и обмен многих витаминов [А, РР, В, D, К), депонирование ионов железа, меди, цинка, марганца, молибдена и др.;
7) синтез подавляющего большинства ферментов, обеспечивающих все метаболические процессы;
8) регуляция равновесия между свертывающей и антисвертывающей системами крови, образование гепарина;
9) разрушение некоторых микроорганизмов, бактериальных и других токсинов;
10) депонирование плазмы крови и форменных элементов, регуляция системы крови;
11) кроветворение у плода.
17.1. НЕДОСТАТОЧНОСТЬ ПЕЧЕНИ
17.1.1. Причины недостаточности печени
Деятельность печени определяется сложнос-гью и многообразием ее функций. При заболева-аиях печени характерно неравномерное выпадение той или иной ее функции и возможность длительной компенсации функционального со-
стояния. Печеночная недостаточность может возникнуть при многих заболеваниях печени. Наиболее часто встречаются вирусные поражения печени: гепатит типа А (эпидемический гепатит, или болезнь Боткина), типа В, B+D, С, G и др. Возбудителями могут быть также риккет-сии, спирохеты, пневмококки, стрептококки и др. Нередко встречаются алкогольные поражения печени, токсические, вызванные лекарственными препаратами (антибиотики, сульфаниламиды, наркотические средства, туберкулоста-тические препараты, транквилизаторы, антигель-минтики, препараты нитрофуранового ряда, ци-тостатики и др.), промышленными ядами (че-тыреххлористый углерод, бензол, толуол, ФОС, хлороформ, нитрокраски, кислоты, щелочи, свинец и др.), а также грибным ядом (фаллоидин, фаллоин, содержащиеся в бледной поганке) и высокотоксическими метаболитами, содержащимися в плесневых грибах (афлатоксины и др.). Причинами заболеваний печени могут быть метаболические расстройства (гемохроматоз, болезнь Вильсона - Коновалова, дефицит с^-анти-трипсина, гликогенозы, галактоземия, врожденный тирозиноз), длительный холестаз (первичный и вторичный холестатический гепатит с переходом в билиарный цирроз), обструкция печеночных вен (веноокклюзионная болезнь, синдром Бадда - Киари), нарушения иммунитета (аутоиммунный гепатит).
Острые гепатиты могут переходить в хронические. Хронический активный гепатит переходит в конечную стадию заболеваний печени -цирроз. Цирроз печенихарактеризуется избыточным развитием фиброзной ткани и образованием регенераторных узлов с нарушением архитектоники печени. Он является следствием некроза печеночных клеток. Печеночная недостаточность может быть исходом любого хронического заболевания печени.
17.1.2. Печеночно-клеточная недостаточность
Печеночно-клеточная недостаточность - нарушение одной, нескольких или многих функций печени, возникающих вследствие повреж-


 дения гепатоцитов.Выделяют острую и хроническую печеночную недостаточность. Острая печеночная недостаточность- это синдром, который связан с массивными некрозами гепатоцитов, приводящими к острому тяжелому нарушению функций печени. Наиболее частыми причинами острой печеночной недостаточности являются молниеносные формы острого вирусного либо токсического гепатита. Реже играют роль цитомегаловирус, вирус инфекционного моно-нуклеоза, риккетсиозы, микоплазмозы и смешанные грибковые инфекции, приводящие к тяжелым некрозам печени. Кроме того, причинами острой печеночной недостаточности могут быть острый жировой гепатоз у беременных, синдром Рея, состояние после операции, а также абсцессы печени, гнойные холангиты, сепсис.
дения гепатоцитов.Выделяют острую и хроническую печеночную недостаточность. Острая печеночная недостаточность- это синдром, который связан с массивными некрозами гепатоцитов, приводящими к острому тяжелому нарушению функций печени. Наиболее частыми причинами острой печеночной недостаточности являются молниеносные формы острого вирусного либо токсического гепатита. Реже играют роль цитомегаловирус, вирус инфекционного моно-нуклеоза, риккетсиозы, микоплазмозы и смешанные грибковые инфекции, приводящие к тяжелым некрозам печени. Кроме того, причинами острой печеночной недостаточности могут быть острый жировой гепатоз у беременных, синдром Рея, состояние после операции, а также абсцессы печени, гнойные холангиты, сепсис.
Хроническая печеночная недостаточностьразвивается в позднюю стадию цирроза печени, а также после оперативных вмешательств по портосистемному шунтированию. Печеночная недостаточность может привести к печеночной энцефалопатии и печеночным комам. Печеночная энцефалопатия- это метаболические нарушения в мозге, которые проявляются изменением интеллекта, психики и нарушением мотор-но-вегетативной деятельности (нейропсихичес-кий синдром). Печеночная кома- это терминальная стадия печеночной энцефалопатии, характеризующаяся утратой сознания, отсутствием рефлексов и нарушением основных функций органов.
Патогенез печеночной энцефалопатии обусловлен резким снижением обезвреживающей функции печени. Это приводит к накоплению в крови токсических продуктов метаболизма - азотистых соединений, таких как аммиак, короткоцепочеч-ные жирные кислоты (масляная, валериановая), фенолы, меркаптаны, ароматические аминокислоты. Механизм токсического действия аммиака связан с нарушением энергетического обмена мозга, а короткоцепочечные жирные кислоты тормозят передачу нервного возбуждения в ганглиях за счет взаимодействия с мембранными липидами нервных клеток. Однако концентрация в крови аммиака и короткоцепочечных жирных кислот не имеет тесной связи со степенью нарушений нервно-психического состояния при энцефалопатии и коме. Есть данные, говорящие и в пользу других факторов, оказывающих токсическое воздействие на ЦНС. Так, нередко у
больных циррозом печени возникают нарушения кислотно-щелочного равновесия, когда выявляется метаболический ацидоз, связанный с накоплением в крови пировиноградной, молочной кислот и трикарбоновых кислот цикла Кребса. В связи с ацидозом повышается проницаемость клеточных мембран и в мозг усиленно поступают токсические вещества. Развивается отек мозга. При этом возникает компенсаторная гипервентиляция для выведения углекислого газа и развивается респираторный алкалоз. Возникает гипокапния, резко снижается мозговой кровоток, и тормозятся процессы биологического окисления, так как уменьшается потребление мозгом кислорода и глюкозы. Нарушение кислотно-щелочного равновесия при печеночной недостаточности взаимосвязано и с изменениями электролитного обмена. Повышение проницаемости клеточных мембран способствует тому, что электролиты передвигаются по градиенту концентрации: во внеклеточное пространство выходит калий, а внутрь клетки поступают натрий и ионы водорода, что и способствует внутриклеточному ацидозу. Во внеклеточном пространстве возникает гипокалиемический метаболический алкалоз. Аммиак переходит из среды с высокими показателями рН в среду с более низкими показателями, что и ведет к проникновению его внутрь клеток мозга, усиливая токсический эффект.
При печеночной энцефалопатии происходит абсорбция токсинов, появляющихся в кишечнике вследствие бактериальной флоры (эшерихии, протей). Нормальные процессы брожения в толстой кишке заменяются процессами гниения, в результате чего образуется большое количество путресцина, кадаверина, индола, скатола, которые при наличии шунтов и нарушений функций печени не обезвреживаются, а попадают в кровь, вызывая тяжелую интоксикацию.
В патогенезе печеночной энцефалопатии играют роль и массивные некрозы печени, в результате которых в кровь поступает большое количество гистаминоподобных веществ, накапливается избыток аминокислот, нарушается нормальный синтез белка и возникает дисбаланс аминокислот в сыворотке крови - повышается концентрация фенилаланина, тирозина, метио-нина, триптофана и понижается концентрация таких аминокислот, как валин, лейцин, изолей-цин. Нарушения в обмене аминокислот ведут к
синтезу ложных нейромедиаторов, прерывающих передачу возбуждения в синапсах ЦНС; в частности, источником ложных нейромедиаторов может быть фенилаланин. Играет роль и нарушение синтеза протромбина и других прокоагу-лянтов, что является одной из причин возможного развития кровотечения.
В патогенезе печеночной энцефалопатии, кроме того, играют роль гипогликемия, нарушения водно-электролитного обмена, газового состава артериальной крови с развитием гипоксе-мии, гемодинамические расстройства, а также почечная недостаточность, связанная с нарушением кровоснабжения почек и эндотоксинеми-ей.
Острая печеночная энцефалопатия может быстро перейти в печеночную кому, если не исключаются факторы, провоцирующие ее развитие (белковая пища, прием диуретиков, не сберегающих К', седативных средств и др.). Энцефалопатия (гепатоцеребральный синдром), возникшая в результате хронической печеночной недостаточности, может длиться годами с периодическими эпизодами прекомы.
Печеночная кома развивается в терминальной стадии гепатоцеребрального синдрома и характеризуется тяжелой недостаточностью печени с потерей сознания больного. Клинические проявления комы и энцефалопатии складываются из психических, неврологических, мышечных и вегетативных симптомов с нарастающей во времени интенсивностью. У больных обостряются характерологические и появляются личностные особенности психики: обидчивость, подозрительность, болезненная пунктуальность, ворчливость, склонность к конфликтам и истерическим формам реагирования («ком в горле», «дрожь в теле» и др.). потливость, тахикардия ит.д.
Различают четыре стадии печеночной энцефалопатиив соответствии с критериями, принятыми Интернациональной ассоциацией поизучению печени.
Стадия I - продромальная.Появляются начальные изменения психики - замедление мышления, нарушение поведения, дезориентация больного в окружающей действительности, расстройства сна (сонливость днем, бессонница ночью), слезливость, слабодушие. Пациенты могут впадать в периоды оцепенения с фиксацией взгляда. Характерным и достаточно ранним симптомом является изменение почерка (дизграфия). ЭЭГ, как правило, не изменена.
Стадия II- начинающаяся кома. Усугубляются симптомы I стадии. У части больных появляются судороги и психомоторное возбуждение, во время которого они пытаются убежать из палаты. Формируются стереотипные движения, например хлопающий тремор рук (асте-риксис), оглушенность. Больные могут стать неопрятными, фамильярными. Часто повышается температура тела, появляется печеночный запах изо рта. На ЭЭГ обнаруживаются незначительные начальные изменения.
Стадия III- ступор.Пациенты пребывают в длительном сне, прерываемом редкими пробуждениями. В неврологическом статусе отмечаются ригидность мускулатуры, маскообразное лицо, замедление произвольных движений, грубые нарушения речи (дизартрия), гиперрефлексия, клонус коленной чашечки и др. На ЭЭГ выявляются глубокие нарушения, форма кривой приближается к изолинии.
Стадия IV - кома. Теряется сознание, отсутствует реакция на болевой раздражитель, в начальной фазе отмечаются патологические рефлексы. В дальнейшем зрачки расширяются, рефлексы угасают, падает АД, может появиться дыхание Куссмауля или Чейна - Стокса и наступает смерть.
Патогенетические факторы, обусловливающие развитие печеночной энцефалопатии и комы, идентичны.
При тяжелой паренхиматозной недостаточности печени возникает вариант эндогенной печеночной энцефалопатии с неблагоприятным прогнозом (при остром фульминантном гепатите, острой дистрофии печени) и возможно развитие эндогенной (истинной) печеночной комы. У других же больных превалирует фактор портока-вального шунтирования и имеет место портоси-стемная энцефалопатия с более благоприятным прогнозом, однако и в этих случаях в терминальной стадии возможно развитие экзогенной (пор-токавальной, шунтовой, ложной) комы.
При истинной печеночио-клеточной недостаточности развиваются следующие синдромы:
1)синдром нарушенного питания(ухудшение аппетита, тошнота, боли в животе, неустойчивый стул, похудание, появление анемии). В основе этого синдрома лежат нарушения обменных процессов;
2) синдром лихорадки (до 38° и даже до 40°С) с ядерным сдвигом лейкоцитарной формулы влево. Этот синдром связан с некрозами
гепатоцитов, поступлением токсических продуктов в кровь, бактериемией (возможно поступление микроорганизмов в кровь из кишечника);
3) синдром желтухи- массивный некроз часто сопровождается нарастанием желтухи;
4) синдром эндокринных расстройств. Наблюдаются снижение либидо, атрофия яичек, бесплодие, гинекомастия, атрофия молочных желез, матки, нарушение менструального цикла, что обусловлено накоплением эстрогенов или уменьшением их инактивации, нарушением функций гипофиза, накоплением в организме вазоактивных веществ. Возможно развитие сахарного диабета и вторичного альдосте-ронизма;
5) синдром нарушенной гемодинамики - накопление гистаминоподоб-ных и других вазоактивных веществ приводит к диффузной вазодилятации (компенсаторное повышение сердечного выброса в сочетании с ги-потензией). Снижение синтеза альбуминов и падение онкотического давления, а также развитие вторичного гиперальдостеронизма обусловливают отечно-асцитический синдром;
6) специфический печеночный запах (fetor hepaticis) связан с выделением метилмеркаптана. Это вещество образуется из ме-тионина, который накапливается в связи с нарушением в печени процессов деметилирования и может содержаться в выдыхаемом воздухе;
7) «п е че но ч ны езнаки» - телеанги-оэктазии (главным образом на ладонях) и паль-марная эритема;
8) синдром геморрагического диатеза - снижение синтеза факторов свертывания крови и частые кровотечения обусловливают возможность развития ДВС-синдрома.
Печеночную недостаточность характеризуют следующие лабораторные показатели: в сыворотке крови уменьшается содержание альбумина (чрезвычайно важный показатель!) и факторов свертывания, снижается уровень холестерина, нарастает содержание билирубина, отмечается накопление фенола, аммиака и повышение активности аминотрансфераз.
17.1.3. Экспериментальное моделирование патологии печени
Известен ряд экспериментальных методов,
используемых для изучения функций печени в физиологических и патологических условиях.
Наложение фистулы Экка - метод, примененный в 1877 г. русским исследователем Эк-ком в лаборатории Н.В. Тарханова. Он заключается в следующем: между нижней полой и воротной венами у собак создается анастомоз. Воротная вена выше соустья перевязывается и вся кровь, оттекающая из органов брюшной полости, поступает непосредственно в нижнюю полую вену, минуя печень (рис. 162). Этот эксперимент позволил изучить обезвреживающую, а также мочевинообразовательную функции печени.
После операции Экка у животных уже через 3-4 дня при кормлении мясной пищей или через 10-12 дней при использовании молочно-рас-тительной диеты, появлялись атаксия, манежные движения, периодически клонические и тонические судороги. В крови нарастало содержание аммиака, который в норме обезвреживается в печени, уменьшался синтез белков, нарушался обмен холестерина и образование желчи.
Обратная фистулаЭкка - Павлова.В 1893 г. И.П. Павлов предложил после наложения соустья на воротную и нижнюю полую вены перевязывать выше соустья не воротную, а нижнюю полую вену. При этом в печень устремляется кровь не только из пищеварительного тракта по воротной вене, но и из задней половины туловища. Животные с такой фистулой живут годами. На этой экспериментальной модели изучается функциональное состояние печени в разных условиях пищевой нагрузки.
Полное удаление печени.Производится в два приема. Вначале воспроизводится обратная фистула Экка - Павлова. Последствием этой опера-
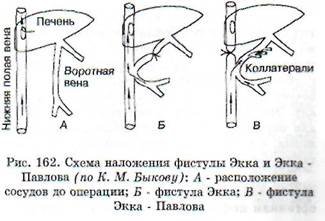
ции является развитие коллатерального кровообращения. В результате часть венозной крови из задней части тела через v. azygos и внутренние грудные вены отводится в верхнюю полую вену, минуя печень. Через 3-4 недели после первой операции проводят вторую: воротная вена перевязывается и печень удаляется. В ближайшие часы после удаления печени у собак появляется мышечная слабость, адинамия, резко понижается содержание сахара в крови и при снижении его ниже 2,5 ммоль/л возможно развитие гипогликемической комы с последующей гибелью животного. Введением глюкозы можно несколько продлить жизнь животного. Одновременно в крови нарастает количество аммиачных соединений и понижается содержание мочевины. Собаки после такой операции живут не более 12-15 часов. Удаление печени является, по существу, экспериментальной моделью печеночной комы. После частичного удаления печени (до 3/4 органа) очень резких нарушений обмена не происходит ввиду того, что оставшаяся часть печени сохраняет свои функции и реализует компенсаторные возможности.
При изучении функциональной роли печени в норме и при патологии применяется также ангиостомический метод Е. С. Лондона,предложенный в 1919 г. К стенкам крупных кровеносных сосудов (воротная и печеночная вены) пришиваются металлические канюли (нержавеющие или серебряные), свободные концы которых выводятся через покровы брюшной стенки наружу. Канюли позволяют систематически брать кровь из сосудов и вводить в них различные вещества. Метод ангиостомии дал много ценного в изучении роли печени в билирубино-образовании, углеводном, белковом, жировом и солевом обменах.
Экспериментальной моделью является и метод перфузии изолированной печени.Донорами печени являются преимущественно лабораторные животные: крысы, кролики, кошки. В настоящее время для этих целей используется и печень крупных животных: собак, свиней и телят. Эта экспериментальная модель применима для изучения роли печени в процессах метаболизма, а также в решении вопросов трансплантации органа.
Для экспериментального воспроизведения заболеваний печени пользуются введением в организм инфекционных и токсических аген-
тов. Сильным гепатотропным ядом является СС14 (четыреххлористый углерод). Парентеральное введение 0,2 мл/100 г 80% масляного раствора этого вещества вызывает альтерацию и некробиоз гепатоцитов в центральных зонах печеночных долек. Для указанных целей используют также хлороформ, семена гелиотропа. Жировой гепатит воспроизводится путем введения сернокислого гидразина и алкоголя. Токсическое действие алкоголя на печень выражается в сосудистых расстройствах и очаговых дистрофически-деструктивных изменениях паренхимы.
17.1.4. Нарушение обезвреживающей и клиренсной функций печени
Печень участвует в обезвреживании токсических продуктов как эндогенного происхождения, так и поступивших извне. Обезвреживанию подвергаются токсические продукты обмена аминокислот - фенол, скатол, индол, аммиак. Деток-сикация осуществляется путем окислительных процессов, восстановительных реакций, а также путем гидролиза. Окисление является наиболее важной реакцией, которая требует присутствия восстановленного НАДФН2 и молекулярного кислорода. Важную роль играет и компонент транспортной системы - цитохром Р150. Некоторые соединения обезвреживаются путем включения их в синтез веществ, используемых в метаболизме (например, включение аммиака в синтез мочевины, нуклеиновых кислот).
Важной реакцией детоксикации является конъюгация, в результате которой происходит инактивация или повышение растворимости и ускорение выведения образующихся веществ. Обезвреживание наступает за счет соединения с глюкуроновой или серной кислотой. Так инак-тивируются стероидные гормоны, билирубин, желчные кислоты, ароматические углеводороды и др. Обезвреживание в организме наступает и с помощью связывания с глицерином, таурином, цистеином, когда образуются парные соединения желчных, бензойной и никотиновой кислот. Осуществляется и химический клиренс крови путем поглощения ряда веществ из крови и выделения их из организма желчью в неизмененном виде.
В печени происходят фиксация и фагоцитирование различных микробов за счет активной
деятельности клеток ретикулоэндотелиальной системы. Введенные в ушную вену кролика взвеси микроорганизмов задерживаются в печени, селезенке и костном мозге. Фиксация микробов печенью происходит и при введении их непосредственно в воротную вену. Купферовские клетки печени обладают не только выраженной фагоцитарной активностью по отношению к микробам, но обеспечивают очищение крови от эндотоксинов кишечной микрофлоры. Способность печени метаболизировать чужеродные соединения может быть усилена введением в организм веществ-индукторов. Некоторые из них, например фенобарбитал, стимулируют в гепатоцитах метаболизм ряда ксенобиотиков, индуцируя синтез цитохрома Р450 и НАДФН2-цитохром-С-редук-тазы. Индуцирующие агенты могут не только усиливать интенсивность окислительно-восстановительных процессов, но и влиять на различные энзимные системы клетки, превращающие чужеродные вещества. Так, при введении фенобарбитала увеличивается содержание внутриклеточных белков (лигандина и др.), связывающих ксенобиотики, а также повышается активность фермента глюкуронилтрансферазы.
При ряде заболеваний печени, особенно при циррозах, ее обезвреживающая функция, как правило, угнетается. Выпадает функция ретикулоэндотелиальной системы («блокада» фагоцитоза продуктами распада клеток), появляются гемодинамические изменения (портокаваль-ные анастомозы, снижение кровоснабжения печени). Результаты этих нарушений сравнивают с последствиями портокавального шунтирования, когда системный кровоток наполняется продуктами, поступившими из кишечника по воротной вене. Это приводит к эндотоксемии - возникают лихорадка, лейкоцитоз, гемолиз эритроцитов, почечная недостаточность, что особенно выражено при печеночной коме.
17.1.5. Роль печени в нарушении обмена веществ
Нарушение белкового обмена.При тяжелых заболеваниях печени наблюдаются самые разнообразные нарушения белкового обмена и изменения биохимического состава крови. В норме аминокислоты, поступающие в организм с пищей, а также образующиеся в процессе катаболизма, метаболизируются в печени. Часть из них
подвергается дезаминированию с превращением в кетокислоты, которые могут, в свою очередь, включаться в цикл трикарбоновых кислот (цикл Кребса). Другая часть аминокислот превращается в аммиак и мочевину (цикл Кребса - Гензе-лайта). Мочевина - это главный конечный продукт белкового обмена. При хронических заболеваниях печени максимальная скорость образования мочевины значительно снижается. Однако мочевинообразование относится к самым устойчивым функциям печени, и в эксперименте доказано, что даже при удалении 90-95% печеночной ткани функция дезаминирования и синтеза мочевины остается сохраненной. При тяжелых хронических заболеваниях печени не находят снижения концентрации мочевины в сыворотке крови. Однако при острых заболеваниях печени в стадии печеночно-клеточной недостаточности отмечается повышение концентрации аммиака в крови, что свидетельствует о нарушении цикла Кребса - Гензелайта.
К малым концентрациям аммиака организм адаптирован, но повышение его уровня в сыворотке крови является токсичным. Установлены две причины гипераммониемии - шунтовая и ферментная. Шунтовая возникает при гиперпродукции аммиака в кишечнике, который при наличии венозных коллатералей поступает в систему общего кровотока, минуя печень, что ведет к энцефалопатии. Ферментная же гиперам-мониемия развивается при нарушении в работе ферментов, участвующих в цикле преобразования мочевины, что наблюдается, как правило, у подростков или детей. Выделяют врожденные и приобретенные ферментопатии, ведущие к гипераммониемии, К врожденным ферментопати-ям относятся гиперлизинемия (дефект дегидро-геназы лизина), пропионовая ацидемия (дефект карбоксилазы пропионовой кислоты), метилма-лониевая ацидемия (дефект метилмалонилмута-зы) и орнитемия (дефект орнитиновой кетокис-лотной трансаминазы). К приобретенным фер-ментопатиям относится синдром Рея, возникающий у детей до 10 лет под влиянием вирусных инфекций (грипп, ветряная оспа) и интоксикаций (ацетилсалициловой кислотой и др.). Развивается острый жировой гепатоз с порто-печеночной недостаточностью и нарушается митохон-дриальный отрезок преобразования мочевины. Поражение ферментов цикла мочевины прерывает превращения в цепи аммиак - мочевина.
При этом синдроме значительно возрастает концентрация аммиака в сыворотке крови, ведущая к тяжелой энцефалопатии, часто отмечаются ги-погликемический синдром и рвота. Кроме того, выраженное повышение концентрации аммиака в сыворотке крови наблюдается и при тяжелых заболеваниях печени - циррозах, когда гиперам-мониемия нарастает не только при печеночной недостаточности, но ипри портокавальных анастомозах, так как аммиак поступает из портального кровотока в общий, минуя печень.
В последние годы в диагностике заболеваний печени возросла роль определения концентрации мочевой кислоты в сыворотке крови. Мочевая кислота - конечный продукт обмена пуриновых соединений, уровень которой повышается, как правило, при подагре. Нередко концентрация мочевой кислоты в сыворотке крови нарастает при острой алкогольной интоксикации (остром алкогольном гепатите) - «вторичная подагра алкоголика ».
Белки плазмы синтезируются на полирибосомах шероховатой эндоплазматической сети гепатоцитов, откуда они попадают в плазму. Снижение их уровня обычно отражает нарушение белково-синтетической функции печени, хотя это может быть вызвано и увеличением объема циркулирующей плазмы, потерей белка через кишечник или с мочой. Гепатоциты синтезируют практически весь альбумин, до 85% глобулинов, а также фибриноген, а^антитрипсин, гаптоглобулин, церулоплазмин, трансферрин.
Печень является основным местом образования факторов свертывания крови: фибриногена (фактор I), протромбина (фактор II), факторов V, VII,IX и X, а также ингибиторов коагуляции и фибринолиза. Образование факторов II,VII, IX и X зависит от метаболизма витамина К и нормальной абсорбции жиров в кишечнике. При заболеваниях печени часто встречаются разнообразные нарушения коагуляции, а именно: дефицит свертывающих факторов крови (II, VII, IX, X из-за нарушения печеночного синтеза и неадекватной абсорбции витамина К), дисфиб-риногенемия, диссеминированная внутрисосуди-стая коагуляция. Тяжелое повреждение печени ведет к уменьшению синтеза белков. Прежде всего это проявляется в снижении уровня протромбина, учитывая его короткий (12 часов) период полураспада, затем может снизиться концентрация фибриногена (период полураспада 4
дня) и позже в сыворотке крови падает содержание альбуминов (период полураспада 20 дней). В клинической практике определяют протром-биновый индекс (по Квику), отражающий суммарную активность факторов свертывания крови - протромбина, проконвертина, акцелерина и фактора Стюарта - Прауэра. Отчетливое снижение протромбинового индекса отмечается при острых и хронических заболеваниях печени, когда наблюдается значительный некроз гепатоцитов. Внезапное и резкое снижение протромбинового индекса у больных с заболеваниями печени всегда свидетельствует о выраженной печеноч-но-клеточной недостаточности и надвигающейся печеночной коме. Если коагулопатия нарастает в связи с холестазом или расстройством функций кишечника (из-за приема антибиотиков широкого спектра действия), то возможно улучшение показателей на фоне внутримышечного введения витамина К (10 мг). Однако если ги-попротромбинемия связана с печеночной недостаточностью, то корригировать свертывание экзогенным введением витамина К не удается.
Некоторые образующиеся в печени белки относятся к белкам, называемым реагентами острой фазы. Их уровень в плазме возрастает при повреждениях ткани печени (например, при тяжелом активном гепатите), при системных заболеваниях (ревматоидный полиартрит и др.), при бактериальных инфекциях и ожогах. Это - фибриноген, С-реактивный белок, гаптоглобин, aj-антитрипсин, компонент СЗ-комплемента и церулоплазмин. Механизм ответа острой фазы сложен: участвуют цитокины (интерлейкин-1, ин-терлейкин-6, фактор некроза опухолей - ФНО). Цитокины не только стимулируют синтез белков острой фазы, но иподавляют синтез альбумина, трансферрина и других белков.
При тяжелых поражениях паренхимы печени отмечается нарушение метаболизма аминокислот, что ведет к повышению уровня свободных аминокислот в сыворотке крови, значительная часть которых выделяется с мочой (амино-ацидурия).Характерным будет повышение в плазме уровня метионина и ароматических аминокислот - тирозина и фенилаланина и понижение уровня аминокислот с разветвленной цепью - валина, лейцина и изолейцина. Так, в норме содержание аминного азота в сыворотке крови -50-80 мг/л, а при тяжелых заболеваниях печени оно возрастает в 3-4 раза (до 300 мг/л). Соот-
ношение аминного азота к общему азоту увеличивается до 1:10 (норма - 1:25). Эти изменения объясняются нарушением функций печени и портосистемным шунтированием крови. У больных с минимальным поражением паренхимы печени также наблюдаются изменения концентраций аминокислот, в частности снижение концентрации пролина в плазме, что может говорить о повышении синтеза коллагена. При фуль-минантном же гепатите отмечается генерализованная аминоацидурия с преимущественной экскрецией цистина и тирозина, что является прогностически неблагоприятным признаком.
Наиболее важным проявлением нарушений белкового метаболизма является гипоальбуми-немия, обусловленная снижением синтеза альбумина, что связано либо с уменьшением числа гепатоцитов, либо с нарушением их функций. Уменьшение поступления аминокислот с пищей также может способствовать нарушению синтеза. Организм пытается компенсировать снижение синтеза альбумина путем уменьшения скорости его разрушения. У здорового человека в печени за сутки образуется 12-15 г альбумина. При тяжелых хронических заболеваниях печени, в частности при циррозах в стадии печеночной недостаточности, его образование уменьшается более чем в 2-3 раза (до 4 г). Однако уровень альбумина при заболеваниях печени снижается медленно в связи с весьма продолжительным периодом его полураспада. Поэтому при острой печеночной недостаточности концентрация альбумина может оказаться нормальной и нарушение альбуминсинтезирующей функции печени проявится только через две-три недели. При повреждении паренхимы печени прежде всего снижается уровень протромбина, который имеет короткий период полураспада, и содержание фибриногена. Определение этих факторов является крайне ценным, так как нарушение их синтеза быстро улавливается биохимическим исследованием. Однако иногда их опережают клинические симптомы повышенной кровоточивости, которые могут быть первыми проявлениями нарушения белкового обмена. Позднее снижается содержание альбумина, что ярко выражено именно при хронических заболеваниях печени. У этих больных в стадии печеночной недостаточности (в частности, при декомпенсиро-ванном циррозе печени) уровень альбумина в сыворотке крови снижается до 30 г/л и ниже.
При циррозе печени с нарастанием печеночной недостаточности снижаются и показатели свертывания крови. Развивающееся при этом снижение протромбинового индекса ниже 80% (до 50 - 40%) не нормализуется введением витамина К.
В состав а2- и р-глобулинов в основном входят липопротеиды. При синдроме холестаза повышение уровня этих глобулинов коррелирует с количеством липидов в сыворотке крови. Высокий уровень а2- и особенно р-глобулинов при билиарном циррозе печени служит дифференциально-диагностическим признаком отличия этого цирроза от других. В а2-фракцию также входят белок церулоплазмин, а2-антитромбин, гап-тоглобин и а2-макроглобулин. Церулоплазмин - основной медьсодержащий белок плазмы, определяющий ее оксидантную активность. Низкая концентрация церулоплазмина может наблюдаться при болезни Вильсона - Коновалова и при декомпенсированных циррозах печени любой этиологии. Значительно реже снижение содержания этого белка отмечается при хронических гепатитах, а также при опухолях печени. Высокий уровень церулоплазмина может в
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|