
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Приклади інших способів зварювання. 1 страница
Приклади інших способів зварювання.
Дифузійне зварювання в вакуумі (ДЗВ). На початку 50–х років з’являється принципово новий спосіб зварювання — дифузійне зварювання в вакуумі (рисунок 5).
|
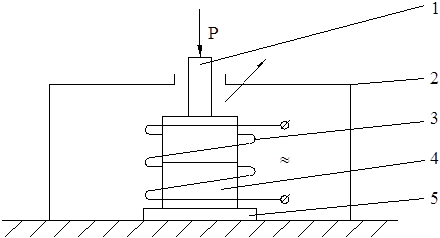
1 — пуансон; 2 — вакуумна камера; 3 — нагрівник (індукційний,
радіаційний, у тліючому розряді, променевий нагрів, прохідним
струмом); 4 — деталі, що зварюються; 5 — зварювальний стіл
Рисунок 5 — Принципова схема дифузійного зварювання в вакуумі
Перші теоретичні розробки ДЗВ пов’язані з Н. Ф. Козаковим.
ДЗВ прецизійний спосіб зварювання в твердій фазі, Тзв = (0.7 – 0.8)Тпл,
де Тпл — температура плавлення найбільш легкоплавкого із матеріалів, що з’єднуються. Цім способом з’єднують понад 650 пар різнорідних матеріалів: метал + метал, метал + неметал, неметал + неметал.
Зварювання в електричному полі. В кінці 60–х років на Україні і в Росії починається теоретична розробка і практичне використання зварювання в електричному полі. Це прецизійний (особливо точний) спосіб зварювання в твердій фазі, Тзв = (0.1 – 0.3)Tпл найбільш легкоплавкого із матеріалів, що з’єднуються. Принципова схема способу наведена на рисунку 6.
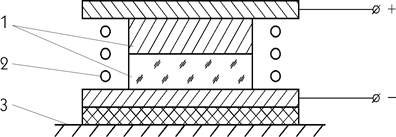
1 — виріб, що зварюється; 2 — нагрівник
(радіаційний нагрів); 3 — зварювальний стіл
Рисунок 6 — Принципова схема зварювання в електричному полі
Під дією нагріву та великого електричного потенціалу в діелектрику (одна із деталей, що зварюється) відбувається поляризація. У зоні контакту виникає подвійний електричний шар, здатний створити зусилля притягання, достатнє для руйнування мікронерівностей. Після досягнення фізичного контакту між двома поверхнями відбуваються електрохімічні реакції і утворюється зварне з’єднання.
Вчені в курсі ТЗП. Засновником широкого запровадження електродугового зварювання плавленням у промисловості є Є. О. Патон (народився 5 березня 1870 року у Ніцці, Франція, у сім’ї російського консула).
Є. О. Патон почав свій творчий шлях в області мостобудування. З 1929 року (у віці 59 років) в житті Євгена Оскаровича почався новий період життя. Він почав працювати в області електричного зварювання. Цією проблемою він займався до кінця життя (помер 12 серпня
1953 року). У 1929 році він засновує при Академії наук УРСР невелику лабораторію, яка у 1934 році була перетворена у науково–дослідний інститут електрозварювання АН УРСР. У 1935 році він засновує кафедру зварювання у КПІ. З 1946 року по 1953 рік Є. О. Патон керує проектуванням та виготовленням більше 100 зварних мостів.
Послідовниками Євгена Оскаровича Патона були його син Борис Євгенович Патон, а також К. К. Хренов, Г. І. Тіходєєв, В. І. Дятлов,
Г. І. Лесков, які розробили та пояснили теорію дугового розряду.
В. І. Дятлов розробив принцип саморегулювання зварювальної дуги, на якому працюють близько 50% зварювальних тракторів у всьому світі.
А. А. Єрохін, В. В. Фролов та Н. Н. Прохоров зробили великий вклад в розвиток металургійної та фізико–хімічної теорії, Н. А. Окерблом розробив методи розрахунків зварювальних напруг та деформацій,
Н. Н. Рикалін розробив теорію теплових процесів при зварюванні.
Зміст та значення курсу ТЗП. Знання теоретичних основ зварювання дозволяє вдосконалювати старі та розробляти нові способи зварювання, технологічні процеси та зварювальне обладнання.
Курс ТЗП є основним (базовим) для подальшого вивчення спеціальних дисциплін відповідного напрямку.
Курс базується на дисциплінах: фізика (в тому числі фізика твердого тіла), хімія (в тому числі фізична хімія), вища математика, опір матеріалів, електротехніка, матеріалознавство та інших.
Курс ТЗП складається з розділів:
— джерела енергії при зварюванні;
— теорія дугового розряду;
— термічні не дугові джерела енергії;
— термопресові процеси;
— пресово-механічні процеси;
— термодинаміка;
— теплові процеси при зварюванні;
— термодеформаційні процеси при зварюванні;
— металургія зварювання;
— здатність металів до зварювання;
— кристалізація металу шва та технологічна міцність.
1 Джерела енергії при зварюванні
1.1 Агрегатний стан речовини
Речовина в залежності від температури та тиску може знаходитись у наступних станах: твердому, рідкому, газоподібному та у вигляді плазми.
Газ — це один з агрегатних станів речовини, в якому його частинки не пов’язані між собою міжмолекулярними силами притягання, та хаотично переміщуються, заповнюючи весь можливий об’єм. При нормальних температурах та тиску середня відстань між молекулами в газі приблизно у 10 разів більша, і тому їх густина значно менша, ніж у рідині та твердих тілах. При звичайних атмосферних умовах гази електронейтральні, тобто є діелектриками. У будь–якому газі знаходяться іони, але їх недостатньо, щоб газ став електропровідним. Усі гази при звичайних умовах можна рахувати ідеальними газами, тобто газами, у яких можна нехтувати силами взаємодії між молекулами.
Рідина — це речовина у конденсованому стані, проміжному між твердим та газоподібним. Як і тверді тіла, рідина має велику густину, малу стисливість, подібно газам добре тече та не має стабільної форми. Відстань між молекулами порядку 10–1 нм. Зв’язок між молекулами рідини електростатичний (згідно закону Кулона)
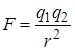 , (1.1)
, (1.1)
де q1, q2 — заряд молекул;
r — відстань між молекулами.
Завдяки сильним зв’язкам між молекулами рідина має поверхневий натяг. Завдяки цій властивості можливо виконувати зварювання у стельовому та вертикальному положеннях. Будова рідини характеризується ближнім порядком, тобто для кожної молекули кількість її ближніх сусідів та їх розташування однакове.
Тверді тіла — це фізичні тіла, які мають стабільну форму, а також для них характерна об’ємна пружність та пружність форми.
Тверді тіла поділяються на два види:
— кристалічні;
— аморфні.
Кристалічні тіла — це тверді тіла, які мають упорядковане розташування утворюючих їх частинок (атомів, іонів, молекул). В ідеальних кристалах частинки розташовуються суворо періодично в трьох вимірах, утворюючи кристалічну гратку. Найменший об’єм атомів, багаторазове повторювання якого може відтворити кристалічну гратку, має назву — елементарна кристалічна гратка. Типи кристалічних граток: кубічна К6, кубічна об’ємноцентрована К8, кубічна гранецентрована К12, тетрагональна К6, тетрагональна об’ємноцентрована К8, тетрагональна гранецентрована К12, гексагональна К6, гексагональна щільноупакована К12.
Густота «упакування» частинок у кристалах характеризується координаційним числом (К), яке показує скільки ближчих рівновіддалених частинок оточує кожну частинку в кристалі. Будова твердих тіл характеризується дальнім порядком. Деякі речовини (залізо, кварц та інші) у різних інтервалах температур та тиску мають у рівноважному стані різну кристалічну структуру (поліморфізм).
У кристалічній гратці мають місце дефекти:
— пружні викривлення;
— викривлення поверхневого шару кристалічної гратки;
— точкові (атоми впровадження та заміщення);
— лінійні (лінійні дислокації);
— об’ємні (гвинтові дислокації, пори, ліквація).
Аморфні тіла — це сильно переохолоджена рідина. Будова аморфних тіл характеризується близьким порядком. Вони ізотропні — у всіх трьох вимірах властивості однакові. Аморфні тіла характеризуються відсутністю температури плавлення.
Аморфні тіла бувають:
— природні (смола, янтар);
— штучні (зварювальні шлаки, скло).
Плазма — сильно іонізований газ, для якого зберігаються умови квазінейтральності (об’ємні густини позитивних та негативних електричних зарядів приблизно однакові). Плазма утворюється при електричних розрядах у газах, при нагріванні газів до температур, достатніх для процесу термічної іонізації. Плазма електропровідна, а тому навколо плазми існують електричні та магнітні поля.
Будова скла. Головним елементом структури силікатного скла є тетраедри [SіO4]–4 (рисунок 1.1), котрі з’єднуючись між собою вершинами утворюють безперервну одномірну, двомірну та тривимірну просторову структуру.
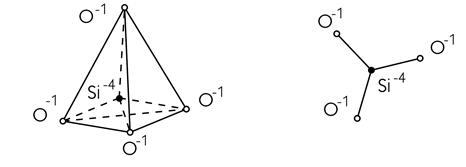
Рисунок 1.1 — Схема аніону 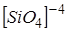
Окремі тетраедри з’єднуються за допомогою місткового кисню
(рисунок 1.2).
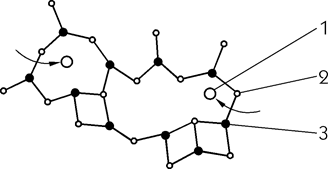
1 — модифікатор; 2 — кисень; 3 — кремній
Рисунок 1.2 — Будова скла з модифікаторами
Розрізняють два види кисню:
а) містковий, який забезпечує зв’язок тетраедрів між собою. Цей зв’язок дуже міцний;
б) немістковий кисень, за допомогою якого здійснюється зв’язок структурної сітки з модифікатором. Зв’язок неміцний, його руйнування відбувається під час нагрівання скла.
Компоненти скла, які здатні самостійно утворювати безперервну сітку (SіO2, B2O3, P2O5), мають назву склоутворювачів. Компоненти скла, які не здатні самостійно утворювати безперервну сітку, мають назву модифікаторів. Це, як правило, оксиди елементів першої та другої груп періодичної системи. Катіони модифікаторів розташовуються у вільних місцях структурної сітки, компенсуючи надлишковий заряд складного аніону. Зв’язок модифікатору з структурною сіткою значно слабший, ніж зв’язки у самій структурній сітці, а тому при нагріванні та прикладенні електричної напруги зв’язки руйнуються, модифікатор легко мігрує в середині структурної сітки, забезпечуючи цим самим електропровідність.
Ситал. Ситал — це полікристалічний матеріал, який отримують при кристалізації звичайного скла за рахунок введення у скло кристалізаторів (наприклад, титана). Будова ситалу наведена на рисунку 1.3.
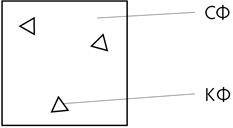
СФ — склофаза; КФ — кристалічна фаза
Рисунок 1.3 — Будова ситалу
Розмір кристалів 1 – 2 мкм. Ситал має двофазну структуру (склофазу та кристалічну фазу). Об’єм кристалічної фази може бути 20 – 90 % від усього об’єму. Ситал має велику міцність, термостійкість (стійкість до різких перепадів температур), до динамічних навантажень, стійкість до хімічних реагентів.
Докладніше по п. 1.1 дивись [2, 4, 16, 17].
1.2 Будова атому
Згідно з квантово–механічною моделлю атому всі види матерії мають хвильові властивості. Згідно де-Бройлю кожна частинка, що рухається, має хвильові властивості і може бути охарактеризована довжиною хвилі та частотою. У загальному випадку атом складається з позитивно зарядженого ядра, навколо якого у певній послідовності розташовуються негативно заряджені частинки (електрони), які знаходяться у постійному русі (рисунок 1.4).
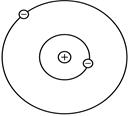
Рисунок 1.4 — Схема будови атому
Енергія та просторове розташування електронів визначається орбіталью, яку займає електрон. Будова атому визначається чотирма
квантовими числами:
1. Головне квантове число (n) — це ціле позитивне число, яке характеризує енергетичний рівень електрона. При n = 1 електрон знаходиться на самому низькому по енергії дозволеному стані, який зветься основним станом. Чим більше n, тим більша енергія електрона.
2. Орбітальне квантове число (l) визначає форму електронної хмари. Кожному значенню l відповідає електронна хмара визначеної форми. Наприклад, при l = 0 електронна хмара має форму сфери, а при l = 1 — форму гантелі. Число l може приймати значення від 0 до n – 1 включно. Стан електрона із значеннями l = 0, 1, 2, 3, 4 позначається літерами s, p, d, f, g.
3. Магнітне квантове число (m) — визначає кількість орбіталей кожного типу і приймає цілі значення, які обмежені значеннями числа l в межах від –l до +l (–l, 0, +l).
4. Спінове квантове число (s) завжди має два дозволених значення:
+1/2 та –1/2. Воно вказує на те, що електрон, який знаходиться на будь–якій орбіталі може характеризуватися одним із двох протилежних напрямків обертання навколо своєї вісі.
Згідно принципу заборони Паулі в атомі не може бути двох електронів, що мають однакові 4 квантові числа. Фізичний зміст цього принципу полягає у тому, що в кожній точці простору в одну мить не можуть знаходитися два електрони. Тому два електрони можуть зайняти одну орбіталь при умові, що вони мають протилежні спіни. Два електрона, що знаходяться на одній орбіталі мають, назву спарених.
Докладніше по п. 1.2 дивись [16].
1.3 Елементарні зв’язки в твердих тілах
Міцність твердого тіла пояснюється присутністю елементарних зв’язків, які поділяються на:
1) полярні, якщо центр позитивного заряду не співпадає з центром негативного заряду;
2) неполярні.
Полярні зв’язки поділяються на:
— гетерополярні — це ті, які утворюються з різнойменно заряджених частинок (іонний зв’язок);
— гомеополярний зв’язок (металевий та ковалентний зв’язки).
В загальному випадку є наступні види елементарних зв’язків:
1) міжмолекулярний;
2) водневий;
3) іонний;
4) ковалентний;
5) металевий.
У чистому вигляді при зварюванні жоден зв’язок не має місця.
1.3.1 Міжмолекулярний зв’язок (сили Ван–дер–Ваальса)
Утворення зварного з’єднання в твердій фазі починається з утворення міжмолекулярних зв’язків. Цей зв’язок утворюється між неполярними молекулами. В них за рахунок постійного переміщення електронів відбувається короткочасне зміщення центрів негативних та позитивних зарядів, тобто молекула короткочасно перетворюється у диполь. Навколо нього утворюється електричне поле, яке поляризує сусідню молекулу, перетворюючи її в диполь. Поруч знаходяться два диполя, які притягаються електростатично протилежно зарядженими кінцями. Величина зв’язку залежить від відстані, тому на початку зварювання молекулярні зв’язки малі.
Сили Ван–дер–Ваальса починають проявлятися на відстанях між тілами приблизно в 1 мкм і мають величину 10–5 Н (енергія зв’язку
10–3 Дж·моль–1).
По мірі утворення фізичного контакту (коли дві поверхні зближені до атомарного рівня) міжмолекулярні сили ростуть і при відстані 1 нм зусилля розриву може досягнути до 100 МПа.
В цьому випадку енергія міжмолекулярних зв’язків досягає
104 Дж·моль–1.
Якщо за допомогою електричного поля штучним шляхом на поверхні створити високу густину постійно діючих диполів, то енергію зв’язку двох поверхонь можна підвищити до 105 Дж·моль–1 (це використовується при зварюванні в електричному полі). Сили Ван–дер–Ваальса діють між будь–якими атомами, молекулами. В загальному випадку вони дуже малі, тому молекулярні кристали відрізняються низькою температурою плавлення. Ці сили є лише додатком при інших видах зв’язків, між поверхнями, що зварюються.
1.3.2 Іонний зв’язок
Його відносять до електростатичних видів зв’язків і виникає він, якщо поряд знаходяться два атоми, один з яких має високу ступінь електронегативності, а другий — електропозитивності. Другий атом перетворюється на позитивний іон за рахунок втрати електрону, а перший в негативний іон за рахунок придбання електрону. Поряд знаходяться два протилежно заряджених іона, котрі взаємодіють відповідно до закону Кулона (1.1). Прикладом є молекула NaCl.
Міцність зв’язку — 105–107 Дж·моль–1. Зв’язки відрізняються відсутністю просторової спрямованості, насиченості, а тому речовини з таким зв’язком характеризуються ізотропними властивостями.
До електростатичних видів зв’язків відносять також взаємодії: іон–диполь, диполь–диполь.
Взаємодія іон–диполь. Молекула води полярна. Кисневий «кінець» збагачений електронами порівняно з водневим «кінцем» тому, що електронегативність кисню більша, ніж водню. Якщо в іонному зв’язку один із іонів замінити полярною молекулою, то поміж залишившимся іоном і протилежно зарядженим «кінцем» полярної молекули виникає електростатичне притягання (рисунок 1.5).
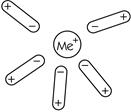
Рисунок 1.5 — Схема взаємодії іон–диполь
Якщо іон, який приймає участь у іон–дипольній взаємодії, замінити на другу полярну молекулу, то має місце диполь–дипольна взаємодія.
Якщо у зв’язок диполь–диполь входить атом водню, то утворюється водневий зв’язок, який міцніший, ніж звичайний диполь–дипольний зв’язок (це пояснюється малим іонним радіусом атому водню). Водневий зв’язок має місце при зварюванні в електричному полі.
1.3.3 Ковалентний зв’язок
Два чи більше атомів можуть утворювати зв’язок, якщо вони узагальнюють між собою валентні електрони. Найбільш відомий такий зв’язок, коли об’єднуються два електрони від двох атомів (по одному від кожного). Кожне з ядер міцно зв’язане з двома електронами і в решті два ядра утримуються поруч друг з другом.
Якщо ковалентний зв’язок утворено двома однаковими атомами, то молекула неполярна (Н2, Сl2, N2). Якщо ковалентний зв’язок утворюється при взаємодії різнойменних атомів — зв’язок полярний. Енергія ковалентного зв’язку приблизно 105 Дж·моль–1, що визначає високу температуру плавлення і міцність кристалів (кремній, германій).
Міцні зв’язки ковалентного типу утворюються не тільки в атомних кристалах, але й при з’єднанні металів з оксидами металів, напівпровідниками, інтерметалідами з напівпровідниковими властивостями та металоїдами.
Донорно–акцепторна взаємодія. У простих ковалентних зв’язках кожний атом дає однакову кількість електронів і орбіталей. В деяких речовинах з ковалентним зв’язком атоми, що з’єднуються, віддають на утворення зв’язків неоднакову кількість електронів. При цьому в одного атома повинні бути незв’язані електрони, а у другого вільні орбіталі. Утворюється донорно–акцепторний чи координаційно–ковалентний зв’язок.
Цей зв’язок виникає при зварюванні металів з неметалами. Якщо зварюється метал з керамікою, і кераміка складається з кислотних оксидів (акцептор електронів), то для утворення зварного з’єднання з металом на останньому потрібно створити плівку низького основного оксиду (донор електронів).
1.3.4 Металевий зв’язок
Це різновид ковалентного зв’язку, але узагальнюються не кілька орбіталей і електронів, а усі валентні електрони, котрі одночасно притягуються до всіх ядер іонів кристалічної гратки. При цьому утворюються загальні рівні енергій по всьому об’єму кристалу. Кількість рівнів буде одного порядку з кількістю атомів у даному об’ємі металу. Рівні близькі між собою і утворюють енергетичні смуги чи зони, які іноді розглядаються як розчеплення валентних рівнів. Міцність зв’язку 105 Дж·моль-1. Властивості зв’язку ізотропні. Металевий зв’язок утворюється при зварюванні металів.
Докладніше по п. 1.3 дивись [16].
1.4 Фізико-хімічні основи утворення зварного з’єднання
1.4.1 Механізм утворення зварного з’єднання
Відповідно до законів термодинаміки будь–який процес у природі іде самовільно без витрат зовнішньої енергії, якщо вільна енергія системи зменшується. У процесі зварювання відбувається зменшення сумарної вільної поверхні з’єднуємих тіл за рахунок об’єднання двох контактуючих поверхонь, що веде до зменшення вільної енергії усієї системи.
Однак на практиці самовласне зварювання тіл не відбувається по ряду причин, які наведені далі.
1. Наявність забруднення поверхні.
2. Наявність шорсткості поверхні.
3. Наявність поверхневого енергетичного бар’єру.
В об’ємі твердого тіла хімічні зв’язки між атомами симетричні (зрівноважені). У атомів, які знаходяться на поверхні, з одного боку хімічний зв’язок відсутній (якщо це вакуум) або ослаблений (якщо це повітря, рисунок 1.6), а тому атоми прилеглі до поверхні притягають їх до себе, зменшуючи відстань між кристалографічними площинами. Таким чином на поверхні твердого тіла має місце викривлення кристалічної гратки, а будь–яке викривлення пов’язано із прибутком енергії, тому на поверхні твердого тіла має місце поверхневий енергетичний бар’єр (рисунок 1.7).
Рисунок 1.6 — Викривлення кристалічної гратки
поверхневого шару твердих тіл
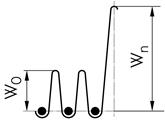
W0 — енергія, яка необхідна атому для переміщення в середині
кристалічної гратки;
Wn — енергія, яка необхідна атому для виходу в навколишнє
середовище
Рисунок 1.7 — Енергетичний бар’єр потенційної енергії
системи атомів на поверхні кристалу
4. Некогерентність кристалічної гратки (рисунок 1.8).
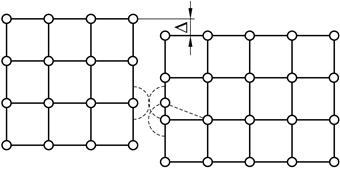
D — величина зміщення
Рисунок 1.8 — Схема зміщення кристалографічних осей
кристалічних граток тіл, що з’єднуються
Для забезпечення процесу зварювання не достатньо наявності фізичного контакту, необхідно, щоб енергетичні поля атомів перекривалися. В тому випадку, якщо вони не перекриваються, хімічний зв’язок не утворюється і зварювання не відбудеться (це є некогерентність кристалічної гратки). Для уникнення цього, необхідно витратити енергію, щоб змістити атом для перекриття електронних полів цих атомів.
5. Наявність сил відштовхування.
Поверхня будь–якого твердого тіла має негативний заряд. Наявність електронної хмари навколо будь–якого твердого тіла забезпечує негативний заряд на його поверхні. Два тіла, які мають негативний заряд відштовхуються одне від одного, тому для зварювання потрібна енергія для подолання сил відштовхування.
6. Відсутність ненасичених хімічних зв’язків (активних центрів).
Для забезпечення процесу зварювання на поверхні, що зварюється, необхідно мати ненасичені (вільні) зв’язки.
1.4.2 Енергія активації
Енергія активації — зовнішня енергія, яка вводиться в зону зварювання і необхідна для приведення двох контактуючих поверхонь у реакційний стан.
Енергія активації необхідна для:
1) очищення поверхні;
2) створення фізичного контакту;
3) подолання некогерентності кристалічної гратки;
4) подолання сил відштовхування;
5) створення активних центрів;
6) подолання поверхневого енергетичного бар’єру.
Для енергії активації використовується слідуючи види енергії:
1) термічна (Т);
2) механічна (М);
3) термомеханічна (ТМ);
4) електрична;
5) інші.
Потрібно розрізнять енергію активації та енергію інтенсифікації процесу зварювання. Без енергії активації зварювання неможливе, а енергія інтенсифікації може посилити процес зварювання.
1.4.3 Двостадійність процесу зварювання
Процес зварювання відносять до топофізичних реакцій (тобто реакцій, які відбуваються на поверхні). Для них характерна двостадійність (рисунок 1.9):
1) фізична взаємодія (А);
2) хімічна взаємодія (Б).
|
|
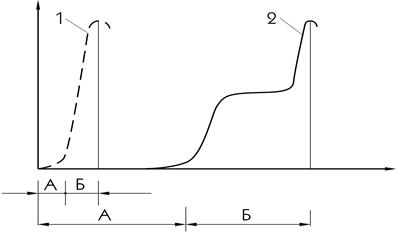
1 — швидке протікання процесу зварювання;
2 — повільне протікання процесу зварювання;
sв— міцність зварного з’єднання;
t — час зварювання
Рисунок 1.9 — Схема двостадійності процесу зварювання
На стадії А має місце очищення поверхонь, які зварюються, і забезпечення фізичного контакту. На стадії Б має місце активація поверхонь, утворення хімічного зв’язку та хімічна взаємодія і утворення зварного з’єднання. Вид цих процесів визначається властивостями матеріалів, що зварюються, способом та режимом зварювання.
Додатково по пунктам 1.4.1-1.4.3 дивись [13, 14].
1.4.4 Контактування шорстких поверхонь
У початковий момент зварювання два тіла контактують в окремих точках (рисунок 1.10).
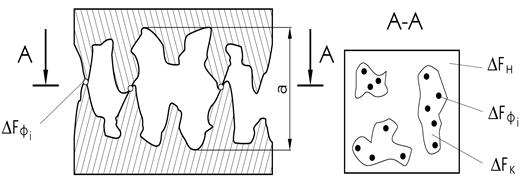
a — максимальна відстань між западинами поверхонь;
DFфі — площина елементарного фізичного контакту;
Fн — номінальна площина контакту (це площина
поперечного перерізу тіл у зоні зварювання);
Fк — контурна площина контакту (площина у межах
якої утворюються окремі мікроконтакти)
Рисунок 1.10 — Схема механічного контакту двох твердих тіл
Розрізняють слідуючи види контакту:
1) фізичний контакт (відстань між поверхнями сумірна з розмірами елементарної кристалічної гратки);
2) механічний контакт (роз’ємне з’єднання з товщиною межових шарів від частин міліметру до частин мікрометру);
3) електричний (будь–який механічний, крізь який протікає електричний струм);
4) контакт з’єднання — це механічний контакт, перетворений у процесі зварювання у нероз’ємне з’єднання;
5) фактичний контакт (та частина механічного контакту, по якому забезпечується фізичний контакт).
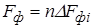 , (1.2)
, (1.2)
де Fф — площина фізичного контакту;
n — кількість елементарних точкових контактів, де відбувається
фізичний контакт.
Для зварювання необхідно, щоб Fн = Fф.
1.4.5 Будова металевої поверхні на повітрі
Ювенільна поверхня — це ідеально чиста поверхня. Її можливо здобути у вакуумі (1.3·10-6 Па). Якщо поверхню алюмінію перемістити з вакууму на повітря, то на ній за час 2·10-9 с утворюється мономолекулярний шар оксиду, а за 15 секунд він буде досягати величини приблизно 12·10-4 мкм.
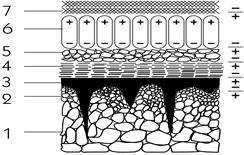
1 — відносно впорядкована структура металу в об’ємі;
2 — розупорядкована структура приповерхневого шару металу;
3 — оксидний шар (товщина до 700 Ǻ, 1Å=10-8 см);
4 — шар іонів кисню; 5 — молекули води;
6 — молекули жиру; 7 — пилоподібні частинки
Рисунок 1.11 — Схема основних видів адсорбованих
шарів на поверхні металу
На поверхні металу перед зварюванням завжди знаходяться і шари газів, що тяжко видаляються, води та інших речовин.
Якщо хімічний склад оксиду відповідає хімічній формулі, то це буде стехеометричний склад.
По товщині оксид можна розбити на три зони:
1) надлишок іонів металу ( зона прилягає до металу);
2) стехеометричний склад;
3) надлишок іонів кисню.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|