
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
№ 8 дәріс Тақырыбы «Коллоидты жүйелердің коагуляциясы мен тұрақтылығы»
№ 8 дә ріс Тақ ырыбы «Коллоидты жү йелердің коагуляциясы мен тұ рақ тылығ ы»
Мақ саты: Коллоидты жү йелердің коагуляциясы жә не тұ рақ тылығ ымен танысу.
Жоспар
1. Коллоидты ерітінділердің коагуляциясы.
2. Ұ ю кинетикасы.
3. Коллоидтардың тұ рақ тылығ ы.
4. Ұ юдың тү рлері.
Тақ ырыптың қ ысқ аша мазмұ ны:
Коллоидты ерітінділердің коагуляциясы. Коллоидты системалар дисперсті фаза мен дисперсті орта арасындағ ы ө зара ә рекеттесудің ә лсіз болатындығ ымен, тұ рақ сыздығ ымен, уақ ыт ө ткен сайын ө зінің дисперстілігін кемітуге бейімділігімен сипатталады. Коллоидты бө лшектедің ірілену жылдамдығ ы ә р тү рлі. Мысалы, алтын сияқ ты асыл металдардың золі ө те тұ рақ ты, ал кейбір топтағ ылар айлап, апталап, тә уліктеп қ ана ө згеріссіз қ алады, келесі бір топтағ ылар тұ рақ тылығ ы сағ атпен, минутпен, тіпті секундпен ө лшенеді. Коллоидты ерітінділердің термодинамикалық тең сіздігі мен олардың бұ зылу жылдамдық тарының араларында белгілі бір тә уелділік жоқ. Мұ ндай ө згерістерді тек жекеленген коллоидты системадағ ы бө лшектердің ірілену механизімін нақ тылы зерттеп қ ана сипаттауғ а болады. Коллоидты ерітінділердің дисперстілігін азайтудың екі тә сілі бар. Олардың бірі қ айта кристалдану кезінде кездесетін ұ сақ бө лшектердің ірілерге келіп енуімен жү зеге асады. Келесісі – дисперсті фазадағ ы бө лшектердің бір-біріне жабысуы. Екінші тә сіл жиі кездеседі жә не оны коагуляция, яғ ни коллоидты ерітіндінің ұ юы деп атайды. Коагуляция процесі кезіндегі дисперстіліктің ө згерісін система лайлығ ының кө беюінен байқ ауғ а болады. Ал жоғ ары дисперсті металл золіндегі ұ ю қ ұ былысы бояу тү рінің ө згеруі арқ ылы жү реді, мысалы, алтын золі ұ йығ анда, оның рең і қ ызыл тү стен кө гілдірге тү рленеді. Ұ ю процесінің бірде жылдам, бірде баяу жү руінің мә ні қ олданбалы жағ дайлар ү шін ө те қ ажетті болғ андық тан, оны зерттеудің орны ерекше. Ендеше коллоидты ерітінділерді ұ йыту қ ұ былыстарының бірден-бір кө п таралғ ан тү рлерін қ арастырайық.
Электролиттер арқ ылы ұ йытқ андағ ы негізгі заң дылық тар. Коллоидты системаларды алғ аш зерттеген ғ алымдарғ а электролит мө лшерінің ө згерісіне сә йкес зольдер тұ рақ тылығ ының да ө згеретіні сол кездің ө зінде-ақ белгілі болғ ан ( Ф. Сельми, Т. Грэм, М. Фарадей, Н. Борщов). Бертін келе нақ тылы мә ліметтер жинақ талып, негізгі теориялық қ орытындылар жасалды. Бұ л ретте, ә сіресе, электролит арқ ылы коллоидты ерітінділердің ұ ю теориясына ә йгілі совет ғ алымдары Б. В. Дерягин шә кірттерімен, Г. А. Ребиндер жә не оның ғ ылыми мектебі, Ю. М. Глазман жә не басқ алар ү лкен ү лес қ осты. Сонымен тә жірибе кезіндегі мә ліметтер мен теориялық ерітінділерді электролит кө мегімен ұ йыту заң дылық тарын ұ ю ережелері деген атпен былай топтастыруғ а болады: 1) ұ юды (коагуляцияны) кез келген электролит тудырады, бірақ оның жылдамдығ ы электролит концентрациясы белгілі бір мә нге жеткенде ғ ана байқ алады; осы мә ннен асқ анда коллоидты ерітіндінің ұ юы байқ алатын ең кіші концентрацияны «ұ ю табалдырығ ы» дейді; 2) коллоидты бө лшек зарядына, тек электролиттегі кері зарядталғ ан ионның ғ ана ұ йыту қ абілеті байқ алады жә не мұ ндай электролиттің валенттілігі кө бейген сайын оның ұ йыту қ абілеті де артады; мұ ны кү кіртті мышьяк гидрозолінің ұ юын зерттегенде 1882 жылы Шульц пен 1900 жылы Гарди бірінші болып анық тағ андық тан, Шульц-Гарди ережесі деп атайды; 3) органикалық қ атардағ ы иондардың ұ йыту ә сері, олардың адсорбциялық қ абілетіне орай ө седі; 4) бейорганикалық иондар қ атарында, олардың гидротациялану активтілігі валенттілік тө мендеген сайын ұ йытушылығ ы артады; мысалы, бір валенттті катиондар мен аниондар қ атарындағ ы олардың гидротациялану жә не ұ йыту активтіліктері келесі жү йе бойынша ө згереді:
ұ йыту активтілігінің ө суі
Li+ Na+ R+ Rb+
гидратация дә режесінің ө суі
ұ йыту активтілігінің ө суі
CI- Br- I- CNS-
гидратация дә режесінің ө суі
Мұ ндай бір валенттіліктегі гидротация дә режесінің кему ретіне орай орналасқ ан қ атарларды лиотропты немесе Гофмейстер қ атары деп те атайды; 5) кө бінесе ұ ю процесі басталғ ан уақ ытта дзета-потенциал тө мендеп, ө з шегіне (шамамен 0, 036) жетеді; 6) электролит қ осып ұ йытылғ ан коллоидты ерітіндідегі тұ нбағ а ұ йып тү скен шө гінді де, ә рқ ашан оны осы кү йге жеткізген иондар бірге болады; мысалы, барий хлоридінің кө мегімен кү кіртті мышьяктің золін ұ йытқ анда тұ нбағ а тү скен теріс зарядталғ ан бө лшектерден тұ ратын шө гіндімен бірге барий катионының едә уір саны кездеседі.
Ұ ю процесін теориялық тұ рғ ыдан зерттеудің екі тү рлі мақ саты бар: зольдердің агрегаттық тұ рақ тылығ ын қ амтамассыз ететін жағ дайды анық тау; толық не жартылай тұ рақ тылығ ынан айырылғ ан системалардың ұ ю жылдамдығ ын зерттеу. Мұ ндағ ы екінші мә селенің шешлуі біршама жең ілдеу. Смолуховский тә жірибе нә тижесінде алынғ ан деректерге қ айшы келе бермейтін ұ ю қ ұ былысының кинетикалық теориясын ұ сынды.
Ұ ю кинетикасы. Ұ ю жылдамдығ ы жалпы химиялық реакциялардың жылдамдығ ы сияқ ты берілген белгілі уақ ыт аралығ ындағ ы бө лшек санының, яғ ни концентрациясының ө згеруімен сипатталады. Мұ нда да химиялық кинетикадағ ыдай теріс таң бамен алынғ ан белгілі мерзімге қ атынасты ө згерген концентрация бө ліндісінің туындысына тең. Ұ ю жылдамдығ ы оны ұ йытатын электролит концентрациясына тә уелді. Бірінші ұ ю жылдамдығ ы баяу, сондық тан да ондағ ы зольді тұ рақ ты деуге болады. екіншісінде электролит концетрациясының болмашы ө згерісіне ұ ю жылдамдығ ы ә рі сезімтал, ә рі тез ө седі. Ал ү шіншіден ұ ю жылдамдығ ы электролит концентрациясына тә уелсіз, яғ ни электролит концентрациясы ө ссе де ұ ю жылдамдығ ы аз ө згеріп, соң ында ешбір ө згеріссіз қ алады. Тез ұ ю теориясын бұ рында айтылғ андай Смолуховский зерттеп, ұ сынды. Бұ л теорияғ а орай, тез ұ ю кезіндегі колоидты бө лшектердің кез келген жә не ә рбір қ ақ тығ ысуы, олардың бірігіп, жабысып, іріленуіне ә келеді деген болжам бар. Берілген мерзім ішіндегі қ ақ тығ ыс саны, ондағ ы бө лшектердің броундық қ озғ алыс интенсивтілігімен анық талады. Ол ө з теориясын ұ сынарда ә рбір коллоидты бө лшектің айналасында кү ш ө рісі болады деген ұ ғ ымды басшылық қ а алды. Бұ л ойғ а орай, шар тә різді бө лшектің радиусы R, ал оның бетінен бастап тартылу кү ші α қ ашық ты дейін ә сер ететін болса, онда ә рекеттесуші кү штің ө рісі (R+ α )-ғ а тең болады. Бұ л сфераны тартылу сферасы дейді. Смолуховский теориясы бойынша ұ ю процесі жү ру ү шін осы сфералар бірімен-бірі тү йіссе де жеткілікті. Ондағ ы ұ юды химиялық қ айтымсыз ре-акциялармен салыстыруғ а болады. Ұ ю процесін сандық тұ рғ ыдан сипаттау ү шін химиялық кинетикадағ ы формальді тең деулерді қ олдана береді. Осы тұ ста шамамен келесі жү йені ү лгі тұ туғ а болады: біріншілік бө лшектер деп аталатын жә не ұ ю процесі басталмай тұ рғ анда, яғ ни зольдердің ө зі қ ұ ралатын бө лшектердің екеуі ө зара қ ақ тығ ысқ анда, екіншілік делінетін ірі бө лшектер туындайды; екіншілік бө лшектер біріншілік бө лшектермен қ ақ тығ ысқ анда ү шіншілік бө лшектер пайда болады; сонан соң одан да жоғ ары ретті айталық тө ртінші бө лшектер не екі екіншілік, не біріншілік пен біріншілік бө лшектер қ ақ тығ ысқ анда туындайды; мұ ндай процестер қ айталана келіп, бірнеше ретті бө лшектерді қ ұ райды. Смолуховский теориясын басшылық қ а ала отырып, қ орытындыланғ ан тең деулер мен оны пайдаланып жү ргізген есептеулер, тә жірибе кезіндегі деректерге қ айшы келмейді. Ә йтсе де кейбір шектеулер бұ л теорияның ә лі де болса толық еместігін кө рсетті. Олар мынадай: теория жылдам ұ юғ а арналғ ан, яғ ни кез келген тартылу сферасы бө лшектердің бірігіп, жабысатын жайғ а ә келеді. Бұ л теориядағ ы негізгі тең деулерді қ орыту кезінде барлық біріншілік бө лшектер ә рі шар тә різді, ә рі бірдей деген болжамғ а сү йенеді, яғ ни золь монодисперсті деп қ абылданады.
Бертін келе, Смолуховский ө з теориясын баяу ұ ю облысына да таратуғ а тырысады. Ол осы мақ сатпен ә рекеттесетін бө лшектердің ә серлігін ескеретін коэффициент енгізді. Егер қ ақ тығ ысқ ан ә р бө лшек бірігіп, жабысуғ а қ атысса, онда α =1, яғ ни ұ ю тез жү реді, ал 0< α < 1 болса, онда ұ ю баяу жү реді. Баяу ұ ю процесіне арналғ ан тең деуді мына тө мендегідей ө рнектеуге болады:
1
Σ G = C (1)
1+ α k C0 t
мұ ндағ ы С – концентрация; k – жылдамдық константасы; t – уақ ыт. Бұ л тең деу кейде тә жірибе кезінде алынғ ан деректермен тура келе бермейді жә не α коэффициенті мен золь қ асиетін байланыс тыра ө рнектейтін мә ліметте жоқ.
Г. Мюллер коллоидты система полидисперсті болатын жағ даймен ондағ ы бө лшек тү рлері таяқ ша жә не жалпақ табақ ша тә різді болып келетін тү рге арналғ ан теорияны ұ сынды. Бұ л теорияғ а орай, коллоидты системаның ұ ю процесі Смолуховский болжамындағ ыдан тезірек жү реді. Осындай полидисперсті системадағ ы бө лшек тү рінің ө згеше болып келуі де ұ ю жылдамдығ ын тездетуге де септігін тигізеді, ө йткені бө лшектердің қ ақ тығ ысуына ілгерілмелі броундық қ озғ алыспен қ атар, айналмалы броундық қ озғ алыста ық пал етеді. Мюллердің теориялық болжамы Вигнер, Туорил, Маршал жә не басқ а да ғ алымдардың ғ ылыми-зерттеулерінде ү йлесімді қ олдау тапты.
Коллоидтардың тұ рақ тылығ ы. Дисперстік жү йелердің тұ рақ тылығ ы деп олардың қ асиеттерінің (дисперстігінің, дисперстік ортада біркелкі таралуының, фазааралық ә рекеттесудің ) уақ ыт ө ту барысында ө згеріссіз қ алуын (тұ ракты болуын) айтады. Демек, тұ рақ тылық деп дисперстік жү йелердің ірілену жә не шө гу қ ұ былыстарына қ арсы тұ ра алу қ абілетін айтады. Дисперстік жү йенің тұ рақ тылығ ының теориялық жә не практикалық маң ызы бар.
Песковтың ұ сынысы бойынша дисперстік жү йелердің тұ рақ тылығ ын екіге бө ліп: 1) шө гу қ ұ былысына қ арсы тұ ра алу жә не 2) бө лшектердің бірігіп, ірілену қ ұ былысына қ арсы тұ ра алу қ абілеті деп қ арастырғ ан жө н. Бірінші тұ рақ тылық ты седиментациялық тұ рақ тылық деп атайды. Екіншісін - агрегаттық тұ рақ тылық деп атайды. Агрегаттық тұ рақ тылық тың ө зі термодинамикалық жә не кинетикалық тұ рақ тылық болып екіге бө лінеді.
Термодинамикалық тұ рақ ты жү йелер бір фаза екінші фазаның кө лемінде ұ сақ бө лшектер (тамшылар) тү рінде ө з бетімен таралуы нә тижесінде тү зіледі. Термодинамикалық тұ рақ ты жү йелерді лиофилъдік жү йелер деп атайды. Бірақ термодинамикалық тұ рақ сыз жү йелер кинетикалық тұ рғ ысынан тұ рақ ты болуы мү мкін. Мұ ндай жү йелерді кинетикалық тұ рақ ты жү йелер деп атайды. Кинетикалық тұ рақ ты жү йелерді лиофобтық жү йелер деп атайды. Лиофобтық жү йелер белгілі бір уақ ыт аралығ ында ғ ана тұ рақ ты болады, одан кейін оның агрегаттық тұ рақ тылығ ы бұ зылады.
Қ атты бө лшектердің бір-бірімен байланысып іріленуін коагуляция деп, ал тамшылардың қ осылып іріленуін коалесценция деп атайды. Бө лшектердің (тамшылардың ) іріленуі, сонымен бірге, изотермиялық айдау барысында да байқ алады. Изотермиялық айдау деп тұ рақ ты температурада кіші бө лшектердің еріп, тамшылардың буланып, ү лкен бө лшектерге (тамшыларғ а) конденсациялануы нә тижесінде бө лшектердің одан ә рі қ арай ірілену қ ұ былысын айтады.
Лиофобтық жү йелердің агрегаттық тұ рақ тылығ ы коагуляция жылдамдығ ы арқ ылы сипатталады. Б. В. Дерягинның кө зқ арасына сә йкес агрегаттық тұ рақ тылыктың негізі болып сынама қ ысым (П) саналады. Сынама қ ысым (1-сурет) екі бө лшек (1) бір-біріне жакындағ анда арасындағ ы дисперстік ортаның (қ абыршақ тың ) (2) қ атты жұ қ аруының нә тижесінде пайда болады.
Сынама қ ысым деп жұ қ а қ абыршақ тағ ы тепе-тең дік кү йді сақ тап қ алу ү шін қ абыршақ қ а тү сірілетін қ ысымды айтады. Сынама қ ысым екі бө лшек арасындағ ы қ абыршақ тағ ы қ ысымнан ( 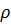 ) дисперстік ортаның кө леміндегі қ ысымды (
) дисперстік ортаның кө леміндегі қ ысымды ( 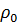 ) алып тастағ анғ а тең:
) алып тастағ анғ а тең:
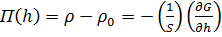 (2)
(2)
Мұ ндағ ы һ - қ абыршақ тың қ алың дығ ы; S - жанасушы бет ауданы. 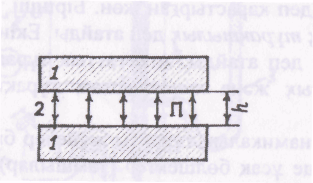
1-сурет. Сынама қ ысымның пайда болуының сызба-нұ скасы
Сынама қ ысым бө лшектер арасындағ ы тартылыс (теріс қ ұ раушы бө лігі) жә не тебіліс (оң қ ұ раушы бө лігі) кү штерінен қ ұ ралады. Сондық тан оның мә ні оң немесе теріс те болуы мү мкін. Сынама қ ысымның теріс қ ұ раушы бө лігін фазалардағ ы атомдар мен молекулалар арасындағ ы тартылыс кү штері кұ райды. Тартылыс кү штерінің ішіндегі кең тарағ аны Ван-дер-Ваальс кү штері.
Оң қ ұ раушы бө лігін бө лшектер арасындагы электростатикалық тебіліс кү штері қ ұ райды. Электростатикалық тебіліс кү штері бө лшек пен дисперстік ортаның арасында қ ос электрлік қ абаттың тү зілуі нә тижесінде пайда болады.
Жалпы термодинамикалық жә не кинетикалық тұ рақ тылық тарды қ амтамасыз ететін мынадай факторлар бар:
3. Электростатикалық фактор, ол Қ ЭҚ -тың болуымен қ амтамасыз етіледі;
4. Адсорбциялық -солъваттық фактор, ол бө лшектің дисперстік ортамен ә рекеттесуі нә тижесінде фазааралық керілудің кемуімен қ амтамасыз етіледі;
3. Энтропиялық фактор, ол тек ультрамикрогетерогенді жү йелерге ғ ана тә н жә не жылулық қ озғ алыстың нә тижесінде бө лшектердің дисперстік ортада біркелкі таралуына ұ мтылысымен қ амтамасыз етіледі;
4. Қ ұ рылымдық -механикалық фактор, ол фазааралық бө лу бетінде серпімділік жә не беріктік қ асиеттері бар адсорбциялық қ абаттардың тү зілуімен қ амтамасыз етіледі;
5. Гидродинамикалық фактор, ол бө лшектердің беттік қ абатындағ ы дисперстік ортаның тұ тқ ырлығ ының артуымен қ амтамасыз етіледі;
6. Аралас факторлар. Ол жоғ арыдағ ы факторлардың бірнешеуінің бір мезгілде ә сер етуі нә тижесінде іске асады.
Ұ юдың тү рлері. Тұ рақ тылық зонасының кезектесуі. Коллоидты ерітінділерге кейбір электролитті қ осқ анда тұ рақ ты екі облыстың пайда болуы байқ алады, олардың біреуі тө менгі, ал екіншісі одан жоғ ары концентрацияғ а сә йкес келеді. Бұ л қ ұ былысты кө бінесе «дұ рыс емес қ атарлар» деп атайды. Тұ рақ тылық зонасының кезектесуі ұ йытушы иондары кө пвалентті болып келетін электролиттерге тә н. Тұ рақ тылық зонасының кезектесу себебін тү сіну ү шін зольдердің тұ рақ тылығ ы, бө лшектегі зарядтың шамасы мен белгісін сипаттайтын электрофорез жылдамдығ ын салыстыру керек. Мұ ндағ ы С – электролит концентрациясы, оның мә ні абцисса осінде, υ – электрофорез жылдамдығ ы ордината осінде ө рнектеледі. Тұ рақ тылық зоналарынан жә не ұ ю облыстарынан тұ рады.
Бө лшек зарядының абсолюттік шамасының азаюы ұ юдың нә тижесінде болады. Сонан соң бө лшек қ айтадан заряд ала бастайды, бірақ та оның мә ні кері болғ андық тан, тұ рақ тылығ ы артады. Электролит концентрациясын онан ә рі жоғ арылату бө лшектегі заряд шамасының кемуіне ә келеді жә не осы тұ ста золь де ұ йиды. Тұ рақ тылық пен зарядты салыстыру «дұ рыс емес қ атарлар» қ ұ былысының беткі қ абаттың қ айта зарядталуынан екенін кө рсетеді.
Потенциал анық таушы иондарды алмастыру нә тижесінде де беткі қ абаттың заряды ө згеруі мү мкін. Мысалы, теріс зарядталғ ан иодты кү міс золіне аз мө лшермен азот қ ышқ ылды кү міс ерітіндісін ақ ырын қ осу арқ ылы, ондағ ы кристалл торына кү міс катионын енгізуге болады; мұ нда электролит концентрациясы жоғ арылағ ан сайын бө лшектегі зарядтың абсолюттік шамасы кемиді, сонан соң кристалл торын толық тыратын кү міс катионының енуі салдарынан беткі қ абат оң зарядталып, зарядтың нө лдік нү ктесі арқ ылы ө теді. Зонаның кезектесуіне екінші себеп – зарядталғ ан беткі қ абатқ а кері иондардың адсорбциялануы. Кө п валентті иондардың ә серін жан-жақ ты зерттеу кө п валентті металл иондары адсорбцияланғ анда беткі қ абаттағ ы қ айта зарядталу қ ұ былысының жү рмейтінін кө рсетеді.
Коллоидтардың ө зара ұ юы. Егер бір системада екі не одан да кө п коллоидты ерітінді болса, онда кейбір коллоидты ерітінді басқ аның ә серінен ұ йиды екен, яғ ни коллоидты ерітінділер бірін-бірі ұ йытады. Мұ ндай қ ұ былысты зерттеу XIX ғ асырдың аяғ ында басталды. Тә жірибе кезінде анық талғ ан жайларғ а қ арағ анда коллоидты системадағ ы бө лшектер зарядының қ осындысы заряд белгісімен қ оса есептегенде нө лге тең болса, онда зольдер біріне-бірі барынша ә сер етеді. Ондағ ы бө лшектердің электрокинетикалық тартылысы зольдердің ө зара ұ юындағ ы жалғ ыз себеп емес. Ионды атмосфера қ ұ рамы мен дисперстік фазаның табиғ аты ә ртү рлі болатын аттас зарядталғ ан зольдердің ұ юы мү мкін, сондық тан бө лшектер арасында адсорбциялық жә не химиялық ә рекеттесулер пайда болуы ық тимал.
Сенсибилизация. Коллоидты системаларды тұ рақ тандыру мақ сатымен оларғ а жоғ ары молекулалық қ осылыс ерітіндісін, олардың арасындағ ы активті белокты жиі қ осады. Алайда, коллоидты ерітіндіге қ осылғ ан жоғ ары молекулалық қ осылыс мө лшері аз болса, онда кері қ ұ былыс жү ріп кетуі мү мкін, яғ ни коллоидты ерітінді тұ рақ сызданады немесе тұ рақ тылығ ы тө мендейді. Бұ л қ ұ былысты Г. Фрейндлих сенсибилизация десе, Н. Песков астабилизация (тұ рақ сыздану) деп атады.
Зольдегі белок бө лшектері мен макроиондары заряд белгісі ә р тү рлі болғ ан жағ дайда сенсибилизация ө те айқ ын болады. Мұ ндайда бө лшектің беткі қ абатына адсорбцияланғ ан белок оның зарядын нейтралдап, ондағ ы ионды атмосфераның пайда болуына байланысты туындайтын тұ рақ тылық ты тө мендетеді. Коллоидты ерітіндідегі белоктың азғ антай концентрациясы берік қ озғ аушы қ абатты тудыра алмайды. Сондай-ақ, сенсибилизация себебін белоктағ ы заряды бар ірі иондардың бірден ө зімен аттас бірнеше бө лшектерге адсорбцияланатынымен тү сіндіреді. Мұ ндай адсорбция коллоидты бө лшектерді біріктіріп, желімдеп қ оятындай кө рінеді.
Пептизация. Пептизация деп ұ йығ ан коллоидты ерітіндінің қ айтадан зольге айналуын айтады. Пептизация ұ ю процесіне кері қ ұ былыс екен. Ендеше, оны тұ рақ тандырушы ретінде де қ арастыруғ а болады. ө згертпейтін жә не олар бірігіп бө лшектер қ ұ рылымын кө беймейтін жағ дайда ғ ана жү руі мү мкін. Пептизация тек коллоидты ерітінді ұ йығ ан кезде, ондағ ы ерітіндіні пепризациялау ү шін, ә уелі оны ұ йытқ ан электролитті жуу арқ ылы жойып, сосын оғ ан тұ рақ тандырғ ыш қ осады. Бө лшектердің беткі қ абатында потенциал анық таушы қ ызметін орындай алатындай иондары бар электролиттер жиірек тұ рақ тандырғ ыш ретінде қ олданылады. Оларды пептизациялаушы электролиттер деп атайды. Жаң адан тұ нбағ а тү скен темір гидроксидін хлорлы темір кө мегімен пептизациялау нақ тылы зерттелген.
Пептизация қ ұ былысын тү сіндіру мақ сатымен, потенциал қ исық тарын ө рнектейтін ә дісті пайдалануғ а болады. П. Ребиндер зерттеулері кө рсетіп отырғ андай, дамығ ан сольватты немесе адсорбциялық қ абаттағ ы бө лшектер ә рекеттескен кездегі потенциалдық қ исық тар келтірілген, яғ ни осы ә рекеттесу энергиясының концентрациясының ә ртү рлі мә нде болғ андағ ы ө згерісі кө рсетілген. Ондағ ы минимумдардың пайда болуы, бө лшектер аралығ ы ө те қ ысқ арғ анда туындайтын тебіліс кү шіне байланысты. Сол секілді сольватты немесе адсорбциялық қ абаттар сығ ылғ ында да тебіліс кү ші пайда болады екен. Сонымен коллоидты ерітінді ұ йығ ан кездегі бө лшектердің кү йі суретте кө рсетілген потенциал шұ ң қ ыры (А) арқ ылы сипатталады.
Коллоидты ерітіндіні ұ йытатын электролит концентрациясы оны жуу салдарынан ө те тө мендеп кетеді де диффузиялық қ абат кең ейеді, ал бұ л қ осымша тебіліске ә келеді. Егер жылулық қ озғ алыстың энергиясы бө лшектердің ара қ ашық тығ ына қ арай ө згеретін потенциал тосқ ауылынан артық болса, онда осы аралық алыстағ ан сайын бө лшектер тарала келіп, пептизация жү реді. Кө бінесе пептизацияны жақ сы жү ргізу ү шін механикалық жолмен араластыру ә дісін де жиі қ олданады.
Негізгі тү сініктер: коагуляция, ұ ю, коллоидтардың тұ рақ тылығ ы, коллоидтардың ө зара ұ юы, агрегаттық тұ рақ тылық, кинетикалық тұ рақ тылық, термодинамикалық тұ рақ тылық, сынама қ ысым, Ван-дер-Ваальс кү штері
Ө зін-ө зі бақ ылау сұ рақ тары:
1. Коллоидты ерітінділердің коагуляциясы.
2. Ұ ю кинетикасы.
3. Коллоидтардың тұ рақ тылығ ы.
4. Ұ юдың тү рлері.
Қ олданылғ ан ә дебиеттер:
Мұ сабеков Қ. Б., Ә бдиев Қ. Ж. Коллоидтық химия: Оқ улық. -Алматы: 2011. -155-162 б.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|