
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тақырыбы: Беттік құбылыстар
№ 7 дә ріс
Тақ ырыбы: Беттік қ ұ былыстар
Мақ саты: Беттік қ ұ былыстармен танысу.
Жоспар
1. Беттік қ ұ былыстар
2. Беттік керіліс, беттік энергия
3. БАЗ жә не БИЗ ұ ғ ымдары
4. Беттік керілісті ө лшеу ә дістері
Тақ ырыптың қ ысқ аша мазмұ ны:
1см2 фазалар бө ліну бетіне тиесілі беткі қ абаттағ ы артық энергия беттік керіліс немесе беттік энергия деп аталады.
1см2 фазалар бө ліну бетін тү зу ү шін жасалғ ан жұ мыс немес оғ ан эквивалентті 1см2 фазалар бө ліну бетіне тиесілі беткі қ абаттағ ы артық энергия беттік керіліс немесе беттік энергия деп аталады. Ол эрг/см2, СИ бірлігінде беттік энергия ө лшемі Дж/м2, беттік керілу ө лшемі Н/м деп белгіленеді. Судың мынадай фазалар бө ліну бетіндегі бетік керіліс мә ндері ә р тү рлі: су-бензол, су-ауа, су-су буы, су-азот. Сондық тан ә р тү рлі заттардың беттік керілісін олар бірдей фазамен шекаралас болса ғ ана салыстыруғ а болады. Ә детте беттік керілісті зат-ауа бө ліну бетінде анық тайды. Жекелеген сұ йық тық ү шін бө ліну беті тү зілу кезінде s мә ні лезде, 0, 001 с-та орнығ ады.
Полярлығ ы жуық сұ йық тық тар бір-бірімен кез-келген қ атынаста араласа алады жә не олардың арасындағ ы беттік керілу нольге тең болу керек. Ал бір-бірінде шектеулі еритін сұ йық тық тардың бө ліну бетіндегі беттік керіліс мә ні осы сұ йық тық тардың ауамен бө ліну бетіндегі беттік керіліс мә ндерінің айырымына тең. Бұ л ереже Г. Н. Антонов ережесі деп аталады:
s(бензол-су)=s(су-ауа)-s(бензол-ауа) Антонов ережесі.
Беттік керіліс дегеніміз фазалар бө ліну бетінің 1см2 на келетін бос энергияның артық мө лшері десек, онда осы артық мө лшердегі энергияны беттік ауданғ а кө бейте отырып берілген гетерогенді жү йенің бос беттік энергиясын (Гиббстің беттік энергиясын) табамыз.
s(2)sG= беттік керіліс, эрг/смsМұ ндағ ы: G=бос беттік энергия, эрг; 2; S=фазалар бө ліну беті, см2
Беттік керіліс кө п факторларғ а тә уелді
1. Зат табиғ атына тә уелді
2. Температурағ а тә уелді
3. Бө где заттардың болуына тә уелді.
Термодинамиканың екінші заң ына сай, жү йенің тұ рақ ты тепе-тең дігінің шарты бос энергияның минимумы. Жү йенің беттік энергиясы σ неғ ұ рлым ү лкен болса, жү йе соғ ұ рлым тұ рақ сыз, ал σ неғ ұ рлым кіші болса, жү йе соғ ұ рлым тұ рақ ты болып келеді. Қ атты денелер де ө з беттік қ абатын азайтуғ а тырысады, алайда қ атты агрегаттық кү йдегі зат бө лшектерінің арасындағ ы айтарлық тай ү лкен кү штер беткі қ абаттың ө здігінен азаюына мү мкіндік бермейді.
G=ss → min екі ө здігінен жү ретін процестер арқ ылы жү зеге асады:
1 . s → min болса, яғ ни фазалар бө ліну бетін азайту есебінен. Бұ л жағ дайда коагуляция, коалесценция, сияқ ты бө лшектердің ірілену процестері ө здігінен болып тұ рады. Коагуляция жә не коалесценция процестері нә тижесінде фазалар бө ліну беті S азаяды, яғ ни, бос беттік энергия мө лшері де азаяды.
2. → min, s = const болса, яғ ниs фазалар бө ліну беті тұ рақ ты болғ ан жағ дайда беттік керілісті азайту. Ол беттік қ абатта беттік керілісі тө мен заттардың ө здігінен жинақ талуы-концентрленуі нә тижесінде жү зеге асуы мү мкін. Мұ ндай процестерге адсорбция, адгезия, шылану жатады. Адсорбция дегеніміз фазалар бө ліну бетінде заттардың ө здігінен жинақ талуына ә келетін сорбциялық процесс. Адсорбция кезінде беттік керілісті азайту есебінен бос беттік энергия кемиді. Егер жү йенің беттік, фазалар бө ліну бетінің ауданы s ү лкен болса, онда G да ү лкенsкерілісі болады. Сондық тан коагуляция да ү лкен жылдамдық пен жү реді, мұ ндай жү йелерді агрегативті тұ рақ сыз жү йелер деп атайды. Кейде дисперстігі дә л сондай жү йелерде коагуляция процесі ө те баяу, тіпті білінбейді де, мұ ндай жү йелер агрегативті тұ рақ ты деп аталады. Бұ дан мынадай қ орытынды жасауғ а болады: тұ рақ ты коллоидты жү йелер алу ү шін коллоидты бө лшектер бетінде БАЗ-ды адсорбциялау арқ ылы беттік энергияны азайтуғ а болады.
Ал беттік қ абаттың ішкі (толық ) энергиясы Гиббс-Гельгольц тең деуімен байланысты:
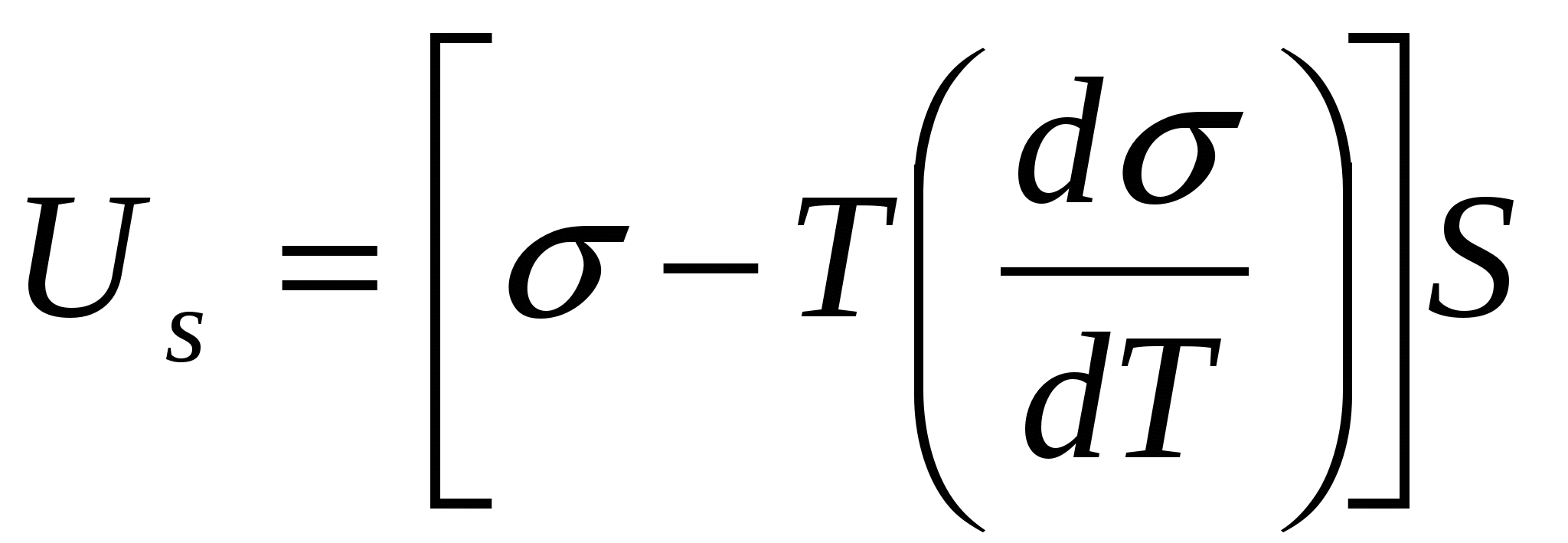 (3)
(3)
Мұ ндағ ы Us- ішкі (толық ) энергия, Дж; 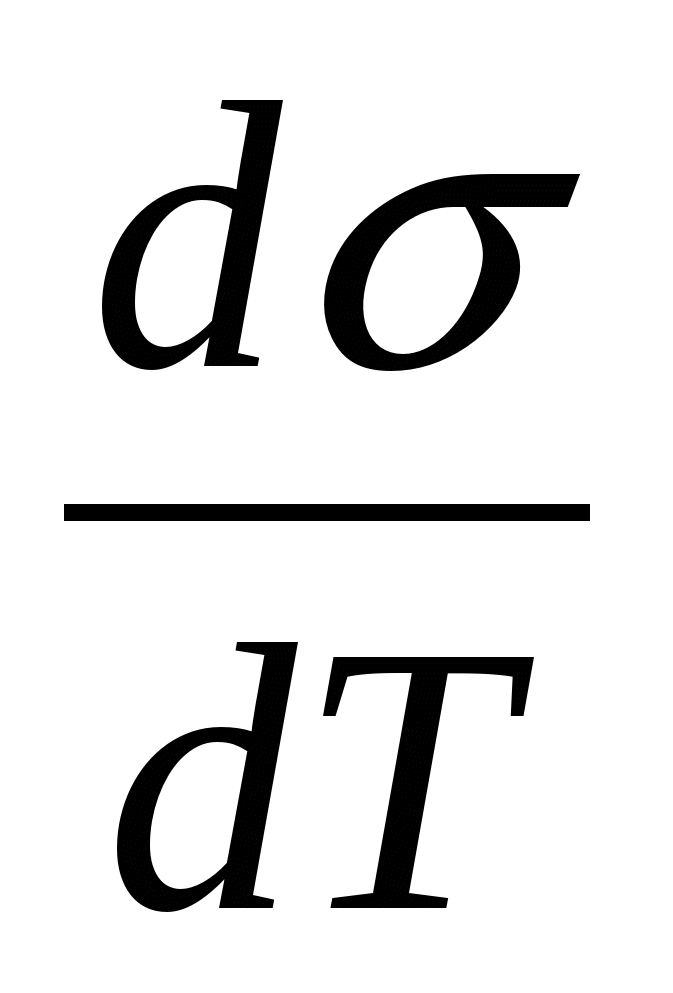 - беттік керілістің температуралық коэффициенті, Дж/(м2∙ К).
- беттік керілістің температуралық коэффициенті, Дж/(м2∙ К).
БАЗ-дар дегеніміз молекуласында полярлы да, яғ ни дипольдік моменті айтарлық тай ү лкен топтар (-ОН, -СООН, -NH2, -SH, -CN, -NO2, -NCS, -CHO, -SO3H) жә не полярлы емес (ароматикалық немесе алифатиклық радикалдар немесе кө мірсутектік тізбек) те топтары бар органикалық қ осылыстар. Мысалы біратомды спирттер, бірнегізді май қ ышқ ылдары. БАЗ молекулалары сулы ерітіндіге тү скенде фазалар бө ліну бетіне шығ уғ а ұ мтылады жә не бө ліну бетіндегі олардың концентрациясы ерітінді кө лемі ішіндегіден ә лдеқ айда жоғ ары болады. Бө ліну бетінде олар топтарының табиғ атына сә йкес орналасады: полярлры птотарымен суғ а бағ ытталып, полярлы емес топарымен ауағ а бағ ыталады. БАЗ молекулаларын дифильді деп атайды. Бө ліну бетінде БАЗдар қ алың дығ ы бір молекуладай қ абат тү зеді (сұ йық тық бетін осындай пленкамен жабады).
Беттік керілуді ө лшеу ә дістері:
- Тамшыларды санау ә дісі
- Кө піршіктер тү зілуінің ең жоғ ары қ ысымы ә дісі (Ребиндер ә дісі)
- Сұ йық тық тың капиллярмен кө терілу ә дісі
Беттік керілу, оны анық тау ә дістері физика курсында толық талданады. Сондық тан да бұ л тарауда сұ йық тар мен қ атты денелерде кездесетін беттік керілу туралы қ ысқ аша қ арастырамыз. Беттік керілу бетке перпендикуляр бағ ытта сұ йық молекуласын ішке қ арай тартатын ішкі қ ысым кү шінің ә серінен пайда болатын қ ұ былыс. Ішкі қ ысым молекулалық ә рекеттесу кү штің нә тижесінде пайда болатындық тан, оның мә ні зат полюстілігіне тә уелді, яғ ни берілген заттың полюстігі артқ ан сайын ішкі қ ысым да кө бейеді. Мысалы, судың ішкі қ ысымы 14800 атм., бензолдікі 3800 атм. Демек, бензолдан гө рі судың полюстігі артық.
Ішкі қ ысым сұ йық тың беткі қ абатына орналасқ ан молекулаларды ішке тартады жә не сұ йық тың беттік шамасын (ауданын) барынша азайтуғ а, кішірейтуге тырысады. Сұ йық тың беттік мө лшерін азайтуғ а себепші болатын барлық шектің бірлік ө лшеміндегі ұ зындығ ына ә сер етуші кү шті беттік керілу кү ші немесе жай ғ ана беттік керілу дейді. Оның ө лшем бірлігі – дин/см жә не бұ л кү ш сұ йық бетіне ә рқ ашан перпендикуляр бағ ытталғ ан. Сұ йық тың беттік қ абатын кө бейту ү шін ішкі қ ысыммен байланысқ ан кедергіні жең уге бағ ытталғ ан жұ мыс жү ргізу керек. Мұ ндағ ы қ айтымды жә не изотермалық процестің бірлік ө лшеміндегі бетті тудыруғ а арналғ ан жұ мыс, осы беттің ү лесті бос энергиясына тең жә не ол эрг/см2-пен ө лшенеді. Ал, егер эрг-дин∙ см екенін еске алсақ, онда бір шаршы сантиметр бетті жасауғ а қ ажетті ү лесті бос энергия шамасы осы беттегі беттік керілу кү шіне тең еледі екен (дин/см). Олай болса, осы айтылғ анғ а орай беттің ү лесті бос энергиясы беттік керілуге тең; бұ л екі шамада бір таң бамен (δ ) ө рнектеледі. Ескерте кететін бір жай, беттік бос энергия жү йенің бір компанентті сұ йық болғ анда беттік керілу кү шіне тең еледі, яғ ни таза су, бензол, спирт, май сияқ ты жеке сұ йық тардағ ы беттік бос энергияның шамасы оның беттік керілу кү шіне тең екен.
Фазааралық шектің беткі қ абатында бос энергияның артық болуын ә р тү рлі ә дістер кө мегімен дә лелдеуге болады. Мысалы, сұ йық фазаның ішкі ортасына орналасқ ан молекуланың ө зін қ оршағ ан молекулалармен ә рекеттесу кү ші орташа кү шке айналады жә не ол кү ш ө рісінің симметриялы болуына байланысты нө лге тең еледі. Газ бен сұ йық фазаларының арасындағ ы шекті қ абаттағ ы молекулалар газдан гө рі сұ йық молекуласымен кө бірек ә рекеттесетіндіктен, ондағ ы тең ә серлі кү ш сұ йық қ а қ арай, яғ ни сұ йық фазаның беткі қ абатына перпендикуляр бағ ытталады. Кө лем ө згеріссіз қ алатын жағ дайдағ ы беткі қ абаттың ауданын кө бейту молекулааралық ішкі кү шке қ арсы жұ мыс жү ргізу кезінде фаза кө леміндегі молекулаларды беткі қ абатқ а шығ арады. Изотермалық жағ дайда жү ргізілетін бұ л жұ мыс беткі қ абаттағ ы бос энергияның артуына тең. Дә л осы сияқ ты қ атты заттарды ұ нтақ тау кезінде де ондағ ы байланыс ү зіліп, ә рбір бө лшек саны артқ ан сайын беткі қ абатта кө бейеді жә не фазааралық беткі қ абат артқ андық тан, бос энергия жоғ арлайды. Мұ ндай беткі қ абат ауданына сә йкес кө бейіп отыратын бос энергия туралы ойды кез келген фазааралық беткі қ абаттарғ а пайдалануғ а болады.
| Адсобция изотермасы |
| Адсорбцияның S тә різді изотермасы |
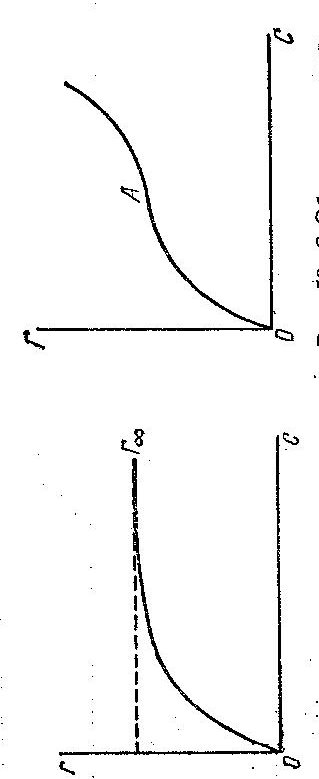
1-сурет. Адсорбция изотермасы
Негізгі тү сініктер: беттік керіліс, беттік энергия, Антонов ережесі, агрегативті тұ рақ сыз жү йелер, агрегативті тұ рақ ты жү йелер.
Ө зін-ө зі бақ ылау ү шін тапсырмалар:
1. Беттік қ ұ былыстар жә не беттік керіліс туралы ұ ғ ым.
2. БАЗ жә не БИЗ.
3. Антонов ережесі.
4. Агрегативті тұ рақ сыз жә не тұ рақ ты жү йелер.
Қ олданылғ ан ә дебиеттер:
Мұ сабеков Қ. Б., Ә бдиев Қ. Ж. Коллоидтық химия: Оқ улық. -Алматы: 2011. - Б. 48-51, Б. 113-122.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|