
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Осмостық қысым
Шынайы ерітінділердің осмостық қ ысымын Нолле ашты. Бір жағ ы жабық, екінші жағ ында шала ө ткізгіші бар, шыны тү тікті қ ант ерітіндісімен толтырып, тү тікті суғ а батырғ анда ондағ ы ерітіндінің кө лемінің жоғ арылайтындығ ын байқ ағ ан. Себебі, шала ө ткізгіш арқ ылы су тү тік ішіне ө теді. Мұ ндай қ ұ былысты осмос, ал осмосты тудыратын кү штерді осмостық қ ысым деп атайды.
Айтарлық тай сұ йытылғ ан коллоидты ерітіндінің осмостық қ ысымын тө мендегі тең деу арқ ылы табуғ а болады
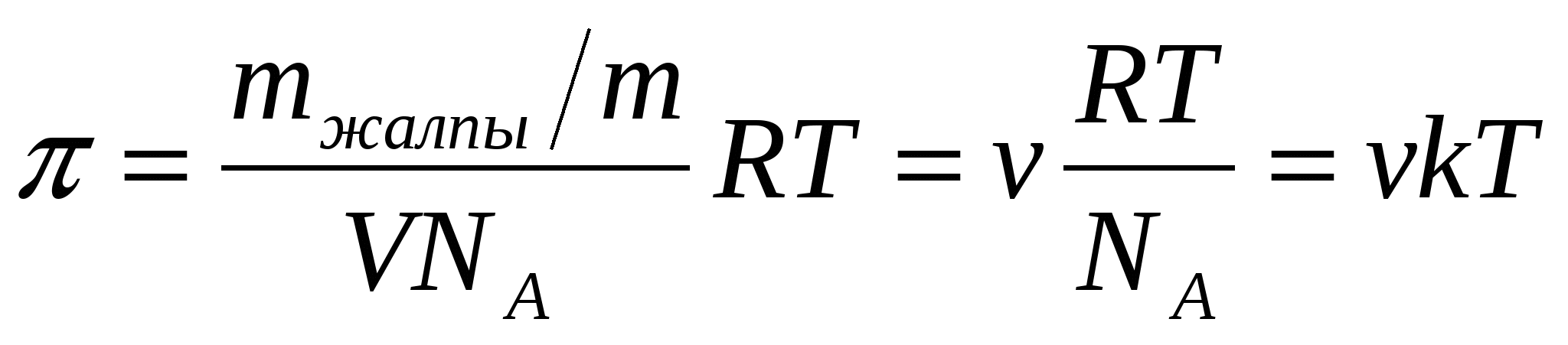
Мұ ндағ ы:
mжалпы – еріген зат массасы
m – бө лшек массасы
V – жү йе кө лемі
NA – Авагадро саны
Т – абсолюттік температура
ν - сандық концентрация
Бұ л тең деу шынайы ерітінділердің осмостық қ ысымын табуғ а арналғ ан Вант – Гофф тең деуімен ұ қ сас:
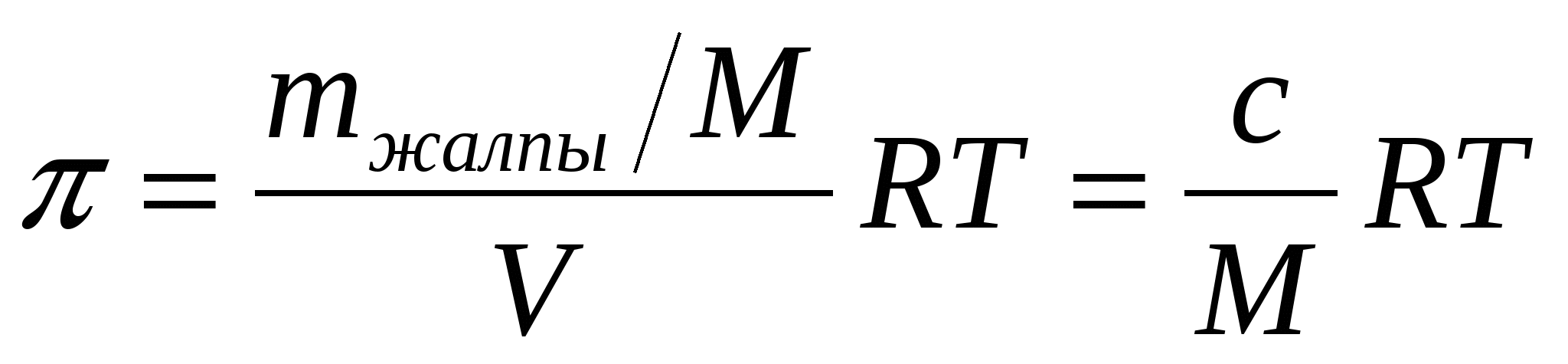
Мұ ндағ ы:
М – 1 моль еріген заттың массасы
с - салмақ тық концентрация
Екі тең деудегі айырмашылық тек 1моль еріген зат массасы мен бө лшек массасында. Шынайы ерітінділермен салыстырғ анда лиозольдердің осмостық қ ысым мә ні тө мен жә не тұ рақ сыз болады. Бірдей температуралық жағ дайлардағ ы осмостық қ ысымдары π 1 жә не π 2 екі жү йе ү шін былай жазуғ а болады:
π 1 =ν 1 (RT/ NA)
π 2 = ν 2 (RT/ NA)
Тең деулерді бір – біріне бө лсек, π 1 / π 2 =ν 1 / ν 2
Дисперсті фаза табиғ аты жә не салмақ тық концентрациясы бірдей, бірақ бө лшек ө лшемінде айырмашылық бар екі коллоидты жү йе ү шін:
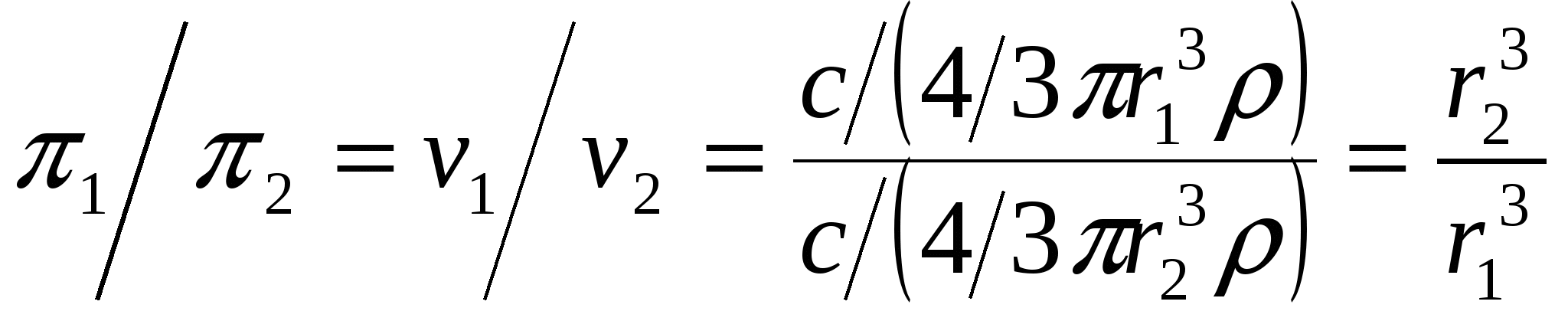
Мұ ндағ ы: r1 жә не r2 - 1 – ші жә не 2-ші жү йелердегі бө лшектер радиусы, ρ -дисперсті фаза тығ ыздығ ы.
Агрегация жә не дезагрегация процестері коллоидты жү йелерде тіпті ә лсіз сыртқ ы ә сердің ө зінен жылдам жү ретіндіктен лиозольдердегі осмостық қ ысымның тұ рақ сыздығ ы осымен тү сіндіріледі. Лиозольдердегі осмостық қ ысым мә ні тө мен жә не тұ рақ сыз болғ андық тан, коллоидты бө лшектер ө лшемін немесе сандық концентрациясын анық тауда осмометрия, эбулиоскопия, криоскопия ә дістері қ олданылмайды.
Коллоидты ерітінділерге нағ ыз ерітіндідегідей осмостық қ ысым тә н. Ол да газ қ ысымы секілді ерітіндінің коллигативті (біріккен, орташа) қ асиеті екен, яғ ни ол тек еркін қ озғ алатын коллоидты бө лшектерге ғ ана тә уелді. Егер коллоидты бө лшектірдің кө лемі мен массасының нағ ыз ерітінділердегі молекула кө лемі мен массасынан ү лкен екенін ескерсе, онда бірдей кө лемдік концентрациядағ ы коллоидты жә не нағ ыз ерітінділерді алып, белгілі бір кө леміндегі коллоидты бө лшекті жә не молекуланы салыстырғ анда, коллоидты бө лшектер аз болады. Мінекей, сондық тан да бірдей концентрациядағ ы коллоидты ерітіндінің осмостық қ ысымы нағ ыз ерітіндімен салыстырғ анда аз болады. Мысалы, массалық концентрациясы 10 г/л болатын алтын золінің осмостық қ ысымы 45 Па, осындай концентрациядағ ы сахароза ерітіндісінің осмостық қ ысымы 7250 Па. Сондай-ақ , гидрофобты коллоидты ерітіндідегі ө лшенетін осмостық қ ысымының бір бө лігі қ осымша электролиттердің кездесуімен байланысты болады.
Коллоидты ерітінділер нағ ыз ерітінділерге ө те ұ қ сас болғ андық тан, оғ ан Вант-Гофф формуласын қ олдануғ а болады:
ПV = nRT немесе П = nRT/V
мұ ндағ ы П – зольдің осмостық қ ысымы; n- колоидты бө лшектердің мольдік ө лшемі; V- зольдің кө лемі. Коллоидты бө лшектің мольдік ө лшемі деп Авогадро саны қ абылданады.
Егер берілген зольде ν коллоидты бө лшек болса, онда 1 мольде NA бө лшек бар. n=ν / NA ескерсек, (39) тең деу:
ПV = (ν / NA)RT, П = ν / V· RT/ NA
болады.
Коллоидты ерітінділердің бә рі дерлік ө те тө менгі бу серпімділікпен сипатталып, қ айнау температурасы мен қ ату (кристалдану) температуралары тө менгі мә нге, кейде мү лдем ө лшеуге келе бермейтін шамағ а ғ ана ө згереді. Мысалы, бө лшек ө лшемі 4нм, концентрациясы 0, 001% алтын золінің қ ату температурасы 0, 000 0040 – қ а ғ ана тө мендейді екен.
Осмостық қ ысым (П) берілген бірлік кө лемдегі бө лшек саны (п) мен коллоидты бө лшектердің орташа радиусы (r) арасындағ ы белгілі бір байланысты табуғ а септеседі. Ұ сақ талғ ан заттың бірлік кө лемдегі массасы:
m = 4/3 π r3dn,
мұ ндағ ы d- ерітінді тығ ыздығ ы. Осы тең деуге негіздей, бірдей температура мен дисперстік ортадағ ы екі дисперсті системағ а арнап, келесі ө рнекті жазуғ а болады:
4 /3 π r31dn1= 4 /3 π r32dn2 немесе r31n1 = r32n2
П1 / П2 = n1 /n2 = r3 2 / r3 1 = D3 1 / D3 2
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|