
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
№ 6 Зертханалық сабақ
№ 6 Зертханалық сабақ
Тұ здар гидролизі.
Жұ мыстың мақ саты: Гидролиз реакциясының жү ру заң дарын оқ ып ү йрену. Ерітінді ортасын анық тауды ү йрену.
№1 Тә жрибе. Электролиттердің электр ө ткізгіштігін тексеру.
Кө мір электродтарды стаканғ а салып, оны электр шамымен қ осып, тоқ қ а қ осу керек.
-
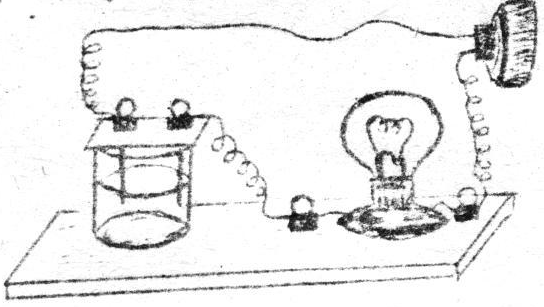 Стаканғ а 20-30 мл дистильденген су қ ұ йың дар. Шам жана ма?
Стаканғ а 20-30 мл дистильденген су қ ұ йың дар. Шам жана ма? - Стаканғ а 2-4грамм қ ант салып дистильденген суда ерітің дер. Шам жана ма?
- Электродтарды жақ сылап жуып қ ұ рғ атың дар да стакандағ ы қ ұ рғ ақ ас тұ зына (NaCl) тигізің дер. Шам жана ма? Енді 20-30 мл дистильденген су қ ұ йып тұ зды ерітің дер. Шам жана ма? Жеке дистильденген су жә не қ ұ рғ ақ тұ з электр тоғ ын ө ткізбейді, ал ас тұ зының ерітіндісі тоқ ө ткізеді. Неге?
- Тө рт стаканғ а 20-30 мл 0, 1 н мына ерітінділерді қ ұ йың дар: бірінші стаканғ а- тұ з қ ышқ ылын, екіншіге- натрий гидроксидін, ү шіншіге- сірке қ ышқ ылын, тө ртіншіге- аммиак ерітіндісін. Осы ерітінділердің электр ө ткізгіштігін тексерің дер. Электродтарды ерітіндіге салғ ан сайын алдын-ала жеке стаканда тұ рғ ан дистильденген сумен жақ сылап жуып отыру керек. Тә жірибе кезінде шамның жарық тығ ына қ арап, қ ышқ ылдар мен негіздердің кү ші туралы айтың дар.
- Соң ғ ы екі стакандағ ы ерітінділерді (сірке қ ышқ ылы мен аммиакты) бір-біріне қ ұ йып, шамның жарық тығ ын салыстырың дар. Неге шамның жарық тығ ы ә р тү рлі?
№2 Тә жрибе. Ерітіндінің рН-ын универсиал индикатор қ ағ азымен анық тау.
Натрий карбонаты жә не гидрокарбонаты ерітіндісінің, қ орғ асын нитраты ерітіндісінің рН-ын анық таң дар. Ол ү шін 3 пробиркағ а 2-3 мл осы ерітінділерден қ ұ йың дар, универсал индикатор қ ағ азын бір-екі секундтай осы ерітіндіде ұ стаң дар. Қ ағ азды алып, индикатор шкаласымен салыстырың дар. Тексеріп отырғ ан ерітіндінің рН-ын анық тап, реакция ортасын жазың дар жә не сутегі ионының концентрациясын есептең дер.
№3 Тә жрибе. Тұ здар ерітіндісінің ортасын анық тау.
4 пробиркағ а 5-6 мл дистильденген су қ ұ йып, 2-6 кристалдан мына тұ здарды салың дар да, ерітің дер: 1-ге натрий ацетатын, 2-ге натрий силикатын, 3-ге кү міс нитратын, 4-ге алюминий сульфатын. Бірінші жә не ү шінші пробиркадағ ы ерітінділердің рН-ын универсал индикатор қ ағ азымен, екінші пробирканы фенолфталеинмен, тө ртінші пробирканы метилоранжбен тексерің дер. Сосын бірінші пробиркағ а 1-2 тамшы фенолфталеин, ал ү шінші пробиркағ а 1-2 тамшы метилоранж тамызың дар. Бірінші жә не ү шінші пробиркаларда ерітінділер тү сі ө згереді ме? Кө рген қ ұ былыстарың ды жазып тү сіндірің дер. Алынғ ан тұ здардың гидролиз реакцияларының тең деуін молекулалық жә не иондық тү рде жазың дар.
№4 Тә жрибе. Қ ышқ ыл тұ здар гидролизі.
2 пробиркағ а 2-3 мл-ден мына тұ здардың ерітіндісін қ ұ йың дар: біреуіне натрий карбонатын, біреуіне- натрий гидрокарбонатын Екі пробиркағ а да 1-2 тамшыдан фенолфталеин тамызың дар. 2-ерітіндінің тү сі кө бірек ө згереді. Қ ай тұ з кө бірек гидролизге тү сті, яғ ни қ ай ерітінді де ОН- ионы кө бірек, неге? Гидролиз тең деуін жазың дар.
№5 Тә жрибе. Ақ ырына дейін жү ретін гидролиз.
Алюминий сульфаты ерітіндісіне натрий карбонаты ерітіндісін қ ұ йың дар. Тү зілген алюминий карбонаты алюминий гидроксидінің тұ нбасын жә не кө мір қ ышқ ыл газын тү зе гидролизге тү седі. Реакция тең деуін жазың дар. Алюминий карбонаты тұ нба қ ұ рамына кірмейтіндігін дә лелдең дер. Ол ү шін тұ нбаны судан бө ліп алып, жуып, тұ нбағ а тұ з қ ышқ ылын қ ұ йың ыздар. Егер кө мірқ ышқ ыл газы бө лінбесе, тұ нбада Al2(CO3)3 жоқ.
№6 Тә жрибе. Ерітіндіні сұ йылтқ анда гидролиз тепе-тең дігінің ығ ысуы. Концентрлі қ орғ асын нитратының тү ссіз екенін бірінші кө ріп алың дар.
Пробиркағ а 10-15 мл краннан су ағ ызың дар да, оғ ан 1-2 тамшы концентрлі қ орғ асын нитратының ерітіндісін (Pb(NO3)2) тамызың дар. Тұ нба пайда болғ анын байқ аң дар. Гидролиз тең деуін жазың дар, неге концентрлі Pb(NO3)2 ерітіндісі тү ссіз, тұ нбасыз екенін тү сіндірің іздер. Метилоранж арқ ылы ортасын анық таң ыздар. Гидролиз реакциясына ерітіндісінің сұ йылту ә сері туралы қ орытынды жасаң ыздар.
№7 Тә жрибе. Температураны ө згерту нә тижесінде гидролиз тепе-тең дігін ығ ыстыру.
Пробиркағ а 5-6 тамшы фенолфталеин тамызың дар, тү сін байқ аң дар. Пробирканы ерітінді қ айнағ анғ а дейін қ ыздырың ыздар. Ерітінді тү рі қ алай ө згереді? Фенолфталеин тү сінің ө згеруі арқ ылы ОН- ионының концентрациясының ө згеруі туралы қ орытынды жасаң дар. Гидролиз тең деуі қ ай жақ қ а ығ ысады? Температура ө згеруіне байланысты неге гидролиз дә режесі ө згереді?
Ө зін ө зі бақ ылауғ а жә не зертханалық жұ мыстарды қ орғ ауғ а арналғ ан сұ рақ тар:
- Электролиттік диссоциация дегеніміз не?
- Кө мір қ ышқ ылының диссоциациялану сатылап тең деулерін жазындар.
- Тө мендегі тұ здардың гидролиз реакциясының тең деуін иондық жә не молекулалық тү рде жазың дар: K2S, Na3PO4, Mg(NO3)2, ZnSO4, AlCl3, CH3COONH4, (NH4)2CO3, Cu(CH3COO)2, Al2S3. Бұ л тұ здардың ерітіндісіндегі реакция ортасын кө рсетің дер.
- Гидролиз деген не? Қ андай тұ здар гидролизге кө бірек тү седі? Қ андай тұ здар гидролизге тү спейді?
- Гидролиз дә режесі деген не жә не ол неге байланысты?
- Қ айтымсыз гидролиз деген не? Мысал келтір.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|