
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
№1 сурет Металл эквивалентінің молярлық массасын анықтауға арналған құрал.
№1 сурет Металл эквивалентінің молярлық массасын анық тауғ а арналғ ан қ ұ рал.
№1 кесте Қ анық қ ан су буының сумен тепе-тең дігі қ ысымы.
| Температура 0С | Будың қ ысым Па∙ 103 (мм сынап бағ анасы) |
| 0, 61 (4, 58) | |
| 0, 87 (6, 54) | |
| 1, 23 (9, 20) | |
| 1, 70 (12, 79) | |
| 1, 82 (13, 63) | |
| 2, 20 (16, 48) | |
| 20 | 2, 37 (17, 53) |
| 2, 48 (18, 65) | |
| 2, 64 (19, 82) | |
| 2, 80 (21, 09) |
№2 кесте Қ орытынды кесте
| m, г | tтә жірибе 0С | Р, кПа | РН2О, кПа | Vтә ж | V0, мл | M (fэкв Ме) |
Ө зін ө зі бақ ылауғ а жә не зертханалық жұ мыстарды қ орғ ауғ а арналғ ан сұ рақ тар:
- Заттың эквиваленті дегеніміз не?
- Эквиваленттің молярлық массасы дегеніміз не?
- Кү рделі заттардың (қ ышқ ылдар, негіздер, тұ здар) жә не жай заттардың эквиваленттерінің молярлық массасы қ алай анық талады?
- Эквиваленттер заң ы қ алай оқ ылады? Математикалық ө рнегі қ андай?
- Неше моль жә не неше грамм болады: а) 6, 02∙ 102 ацетилен С2Н2 молекулаларын. б) 2, 00∙ 1023 азот молекулаларын.
№ 3 Зертханалық сабақ
Нейтралдау реакциясының энтальпиясын анық тау
Жұ мыстың мақ саты: Химиялық реакция энергетикасын калориметрия ө лшеп жә не термодинамикалық есептеу арқ ылы анық тау.
Жұ мысты жү ргізу:
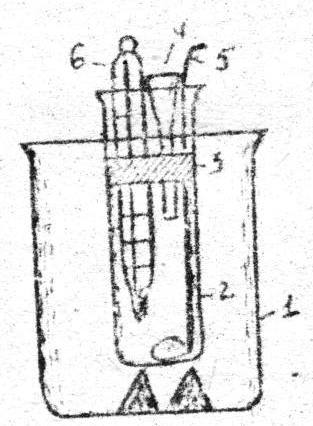
Химиялық реакцияның энтальпиясын калориметр деген қ ұ рал арқ ылы ө лшейді. 1- сыртқ ы стакан, 2- реакция жү ретін стакан, 3- қ ақ пақ, 4- воронка, 5- ерітінді араластыратын қ ұ рал, 6-термометр.
 Кү шті қ ышқ ылды кү шті негізбен нейтралдау реакциясының энтальпиясы жә не реакцияның Гиббс энергиясын есептеу. Электролиттік диссоциация теориясы бойынша кү шті қ ышқ ыл мен кү шті негіз арасында мынадай реакция жү реді:
Кү шті қ ышқ ылды кү шті негізбен нейтралдау реакциясының энтальпиясы жә не реакцияның Гиббс энергиясын есептеу. Электролиттік диссоциация теориясы бойынша кү шті қ ышқ ыл мен кү шті негіз арасында мынадай реакция жү реді:
NaOH + HCl = NaCl + H2O
NaOH + HNO3 = NaNO3 + H2O
№4 сурет Калориметр
Нейтралдау реакциясының термохимиялық тең деуін былай жазуғ а болады:
Н+ + ОН- =Н2О: Δ Н=-57 кДж
Нейтралдау реакциясы ү шін бірдей кө лемдер алу керек, мысалы: 100 мл қ ышқ ыл, 100 мл негіз.
Реакция жү ретін стаканғ а (2) негіздің белгілі кө лемін (20 мл концентрациясы 1 М) қ ұ йың дар да температурасын 0, 10К дә лдікке дейін ө лшең дер (Т1), оны зертханалық дә птерге жазың дар. (Қ ышқ ылдың да температурасын осындай дә лдікпен ө лшең дер, екі температура тең болуы керек). Сондай кө лем (20 мл) қ ышқ ылды кұ йып (1М) араластырып, ең жоғ ары температураны ө лшең дер (Т2).
Тә жірибе нә тижесін кестеге жазың дар:
| Жү йе | Стакандағ ы жалпы кө лем, V мл | Т1, К | Т1, К | Т = Т2- Т1 |
| NaOH HCl | ||||
| NaOH HNO3 |
Тә жірибе нә тижесінен мыналарды анық таң дар:
1. Температуралар айырмашылығ ын Δ Т = Т2- Т1
2. Стакандағ ы ерітіндінің массасын (m) (ерітінді тығ ыздығ ын бірге тең деп алың дар).
3. Реакция нә тижесінде бө лінген жылуды (q): q= C∙ m∙ Δ T
C- ерітіндінің жылу кө лемі 4, 18 кДж (кг∙ К)
m- ерітінді массасы
Тә жірибе нә тижесінде табылғ ан жылу мө лшері 0, 1 моль сілтіні нейтралдағ андағ ы жылу мө лшері болып табылады.
4. 1 моль ү шін нейтралдау энтальпиясы (кДж/моль);
Δ Ннейтралдау = -q/0, 1 кДж/моль
5. Теория бойынша нейтралдау энтальпиясы Δ Ннейтралдау = -57 кДж/моль болса, салыстырмалы қ ате %қ ате = ((Δ Нтеор. – Δ Нтә ж. )/ Δ Нтеор. )∙ 100
6. Энтропия мә ндерін кестеден тауып, нейтралдау реакциясының энтропиясының ө згеруін табың дар
7. Нейтралдау реакциясының Гиббс энергиясын есептең дер.
Δ G = Δ H + TΔ S
Кү шті қ ышқ ыл мен кү шті негіз ә рекеттескенде неге энтропия азаяды, соны тү сіндірің дер.
Табылғ ан Δ Н, Δ S, Δ G мә ндеріне сү йеніп, нейтралдау реакциясы ө здігінен жү ретіндігі туралы қ орытынды жасаң дар.
Ө зін ө зі бақ ылауғ а жә не зертханалық жұ мыстарды қ орғ ауғ а арналғ ан сұ рақ тар:
- Термохимия нені зерттейді?
- Экзотермиялық жә не эндотермиялық деп қ андай реакцияларды айтады?
- Гесс заң ын жә не оның салдарын айтып берің із.
- Ішкі энергия деген не?
- Энтальпия деген не жә не оның физикалық мә ні қ андай?
- Термодинамиканың бірінші заң ын айтып берің із. Энтропия деген не? Стандартты энтропия деген не? Энтропиялық бірлік деген не?
- Изобаралы-изотермиялық потенциал деп немесе Гиббс энергиясы деп қ андай шаманы айтады? ∆ G қ андай бірлікпен ө лшенеді?
- Жү йенің энтропиялық жә не энтальпиялық факторлары деген не?
- Δ Н пен Δ S байланысы қ андай тең деумен ө рнектеледі?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|